

Special Article - Year 2006 - Volume 21 -
Pyoderma gangrenosum - a severe and ill-known complication of healing
Pioderma Gangrenoso: Grave e Mal Conhecida Complicação da Cicatrização
ABSTRACT
Pyoderma gangrenosum is an uncommon, ill-known, inflammatory skin disease. It appears in association with other maladies or by itself. It can also be an important complication of operations, giving rise to devastating post-operative skin losses. In this work, a brief revision on this disease is made, focusing on its aspects pertaining to plastic surgery. A case of postoperative pyoderma gangrenosum, with a 3-years follow-up, is also reported.
Keywords: Pyoderma gangrenosum. Postoperative complications. Skin ulcer
RESUMO
O Pioderma Gangrenoso, doença inflamatória da pele, é incomum e pouco conhecido. Surge em associação com outras doenças ou isoladamente. Também pode ser importante complicação de operações, causando perdas cutâneas devastadoras durante o período pós-operatório. Neste trabalho, faz-se uma breve revisão sobre este distúrbio, com foco nas repercussões sobre a Cirurgia Plástica. Apresenta-se, também, um caso de pioderma gangrenoso pós-operatório com três anos de evolução.
Palavras-chave: Pioderma gangrenoso. Complicações pós-operatórias. Ulcera cutânea
Embora incomum, a perda extensa de pele após operações pode ocorrer e, neste caso, constitui uma complicação devastadora. Freqüentemente, o cirurgião plástico desconhece as razões de tais desastres. Um dos processos possíveis é muito pouco conhecido e pode ser confundido com inúmeras outras alterações patológicas. Este "grande malfeitor" é o Pioderma Gangrenoso (PG), que não tem etiologia infecciosa. Embora mais de um século já tenha decorrido desde a primeira descrição, o PG permanece relativamente ignoto. Isto não deveria ser assim, pois esta doença pode surgir como uma seríssima complicação pós-operatória. O PG é uma doença inflamatória da pele, apresentando-se tipicamente como ulcerações dolorosas e destrutivas1. Embora o sítio anatômico mais comumente afetado seja a perna, o processo pode ocorrer em qualquer local do corpo2. Pode associar-se a doença inflamatória intestinal, doenças reumáticas3,4 e outras afecções ou, então, apresentar-se per se1. Pode ser originado por traumatismos, incluindo os cirúrgicos, constituindo um fenômeno denominado patergia5 - excelente razão para que os cirurgiões plásticos conheçam melhor este problema.
Neste trabalho, faz-se uma revisão sobre o PG, com foco especial nos aspectos concernentes à Cirurgia Plástica, bem como apresenta-se um caso da doença.
REVISÃO
O PG foi descrito originalmente por Brocq, em 1916 (citado por Bennett et al. 6) e, posteriormente, em 1930, por Brunsting et al.7. Não é uma doença comum; pesquisa retrospectiva feita no Brasil8 mostrou um índice de 0,38 casos por 10.000 atendimentos. Pode afetar pacientes de todas as idades, inclusive crianças, sendo, entretanto, observado com mais freqüência após os 30 anos1. Incide mais no sexo feminino9.
Nos casos não associados com traumatismos, a lesão inicial pode ser uma pústula, uma pápula, um nódulo (semelhante ao do eritema nodoso) ou uma placa1. Em pouco tempo, surge uma úlcera, com expansão centrífuga e um centro necrótico, com sangue, pus e tecido de granulação. A necrose pode ter profundidade variável. A borda da úlcera é característica: elevada, de cor vermelha escura ou purpúrea, sendo a borda escavada e a pique6. A pele próxima da borda é eritematosa e pode exibir pústulas. À palpação e expressão, pode surgir secreção purulenta sob a borda. A dor é uma queixa relevante2. As úlceras podem expandir- se de modo lento ou rápido; podem ser isoladas ou múltiplas, sendo eventualmente confluentes. Na perna, grandes úlceras podem tornar-se circunferenciais. As lesões podem aparecer em qualquer localização: cabeça, pescoço, membros superiores, abdome, genitais. Na região vulvar, peniana ou perineal, a destruição causada pelo PG pode levar a mutilações graves1.
Associação com outras doenças
Como já mencionado, o PG pode associar-se a outras doenças, embora 50% dos casos surjam isoladamente3. Processos patológicos freqüentemente associados são: doenças intestinais inflamatórias (retocolite ulcerativa crônica e doença de Crohn)10, artrites (seronegativa, reumatóide, espondilite, osteoartrite), problemas hematológicos (leucemias mielocíticas, leucemia de células pilosas, mielofibrose, gamapatia monoclonal).
Associações menos comuns podem ser: diverticulite intestinal, pólipos intestinais, hepatite crônica ativa, cirrose biliar primária, colangite esclerosante, mieloma, policitemia rubra vera, arterite de Takayasu, lupus eritematoso sistêmico, doença de Behçet, granulomatose de Wegener, câncer (mama, pulmão, cólon e próstata), doenças da tireóide, sarcoidose, diabetes mellitus e AIDS, dentre outras.
Patergia e PG pós-operatório
Lesões patérgicas são aquelas que surgem após algum tipo de trauma, muitas delas sendo complicações pós-operatórias da cicatrização - daí o seu interesse cirúrgico. Cerca de 40% das lesões de PG surgiram após pequenos traumas1. O PG pós-operatório, também conhecido como gangrena progressiva pós-operatória de Cullen, foi descrito pela primeira vez por este autor, em 1924, segundo Schofer e Baur11. O PG já foi descrito surgindo após colostomias e ileostomias12, toracotomia13, operações da articulação coxo-femural14, cesareanas15, cirurgia cardíaca16, herniorrafia videolaparoscópica17, excisão de pseudotumor orbital18, mastectomia19, colecistectomia20, biópsia da mama21, amputação da perna22 e laparotomia23. Assume relevante importância para o cirurgião plástico o fato de o PG já ter sido relatado após mamaplastias redutoras24-29 e de aumento30, reconstruções mamárias31, bem como após retalho fasciocutâneo32.
Etiologia
A etiologia do PG permanece desconhecida. Não é - fato importante - uma doença infecciosa. Sua associação com doenças da imunidade e seu tratamento com agentes imunomoduladores sugerem uma causa imunológica. Os defeitos imunitários já relatados incluem: anormalidades da imunidade celular, humoral e do complemento; deposição de complexos imunes; fatores circulantes alterando a função linfocitária. Em alguns pacientes, descreveu-se uma associação do PG com gamapatia monoclonal benigna, especialmente do tipo IgA1. Também foram descritas anomalias da quimiotaxia e da fagocitose de neutrófilos e de monócitos.
O papel dos leucócitos polimorfonucleares (neutrófilos) parece ser muito importante, o que é evidenciado pela presença de pus e de grande infiltrado neutrofílico nas lesões. Quando a inflamação acontece na pele, a infiltração de células inflamatórias segue-se ao aumento de moléculas de adesão nas células do endotélio de vênulas33. A ativação endotelial pode dar-se pela ação de citocinas como a interleucina-1 (IL-1), produzida por macrófagos, e o TNF-a (fator de necrose tumoral alfa), também gerado pelos macrófagos e linfócitos. Estas citocinas conduziriam à expressão de selectina-E e da molécula de adesão intercelular-1 (ICAM-1), com a conseqüente adesão de neutrófilos ao endotélio1.
Poderia, então, haver uma série de diferentes alterações imunológicas levando a um mecanismo comum: infiltração neutrofílica e destruição tecidual. A melhora rápida do PG, em vários casos, com o uso de ciclosporina, sugere o envolvimento de linfócitos T na sua patogênese, pois o principal mecanismo de ação desta droga é a inibição da ativação deste tipo de linfócitos, com redução da produção de interleucina-2 (IL-2) - embora a ciclosporina também iniba a fagocitose de neutrófilos e monócitos, bem como a produção de superóxido pelos polimorfonucleares. Um mecanismo similar (sobre os linfócitos T) acontece com o tacrolimus, que também é eficaz no tratamento do PG34.
Quanto às lesões patérgicas, o mecanismo etiológico poderia ser o mesmo já sugerido para outra dermatose neutrofílica, a doença de Behçet: haveria uma reação de hipersensibilidade retardada, independente de antígeno, diferindo da resposta normal ao trauma por haver liberação exagerada de citocinas inflamatórias pelos queratinócitos lesados, o que poderia ser amplificado por linfócitos ativados35.
Diagnóstico do PG pós-operatório
O diagnóstico do PG é clínico, pois não existem achados específicos, sejam eles serológicos ou histológicos. Quando úlceras necróticas destrutivas e dolorosas complicam a evolução pós-operatória, especialmente em pacientes que sofram ou sofreram de doença inflamatória intestinal ou de artrite, e não há infecção, deve-se considerar a possibilidade de PG.
Embora a histopatologia não produza achados específicos e sempre exista o risco de aumentar as lesões pelo mecanismo da patergia, a biópsia pode ser útil. Os achados mais comuns são: infiltração neutrofílica supurativa, necrotizante e leucocitoclase1. Tais características, conquanto inespecíficas, serão indícios adicionais à hipótese de PG. A cultura e os testes de sensibilidade podem ser úteis no diagnóstico diferencial; fungos e bactérias atípicas devem ser procurados. Também serão úteis os estudos microbiológicos para o diagnóstico de infecções complicando o PG.
Cumpre enfatizar que o PG não é uma doença infecciosa. A presença de secreção purulenta não deve ser encarada como sinônimo de infecção bacteriana. Na verdade, é a presença maciça de neutrófilos, sem infecção, que gera o pus. Os pacientes com PG não exibem sinais sistêmicos de infecção, dado valioso para o diagnóstico desta grave moléstia.
O diagnóstico diferencial deve incluir uma lista de problemas: vasculite, doença de Behçet, lupus eritematoso, micoses diversas (esporotricose, blastomicose, criptococose), sífilis, necrobiose lipoídica do diabetes, granulomatose de Wegener, infecção por micobactérias atípicas, amebíase cutânea e infecções de sítio cirúrgico1. Destas, deve ser enfatizada a gangrena sinergística de Meleney. Produz também lesões pós-operatórias ulceradas, dolorosas e progressivas - mas há sinais de infecção, os estudos microbiológicos mostram estreptococos e estafilococos associados e há resposta à antibioticoterapia.
Tratamento
O tratamento do PG se baseia na imunossupressão. Apenas lesões muito pequenas e precoces respondem a tratamentos locais. A área afetada deverá ser mantida limpa e úmida, sendo úteis os curativos oclusivos ou de hidrogel. O desbridamento deve ser evitado, pois poderá causar aumento das lesões pela patergia. Pode ser utilizado o cromoglicato dissódico em solução a 2%, aplicado diariamente com oclusão. Melhor resultado advém da infiltração intralesional de triamcinolona (20 mg/mL em aplicações mensais), que pode acarretar a remissão após cinco a oito semanas3. A ciclosporina pode ser usada localmente, mediante injeções intralesionais de uma solução 1:3 em salina fisiológica, na freqüência de duas vezes por semana.
O uso de analgésicos eficazes costuma ser indispensável, visto que as lesões de PG podem ser bastante dolorosas; opiáceos podem ser necessários1.
Entretanto, o tratamento sistêmico está indicado na grande maioria dos casos. A terapêutica local, inobstante, poderá ser mantida como coadjuvante do tratamento geral. Os corticosteróides podem ser usados, inicialmente em doses altas (prednisona ou prednisolona oral, 1-3 mg/kg/dia)1,3, ou em forma de pulsoterapia (metilprednisolona, 1 g/dia por três dias), nos casos mais graves ou resistentes à terapia per os. À medida que a doença for controlada, as doses serão gradualmente reduzidas. A droga de escolha é a ciclosporina1, cuja administração e manejo demandam um médico com experiência na sua utilização. A maioria dos pacientes com PG responde a doses relativamente baixas da ciclosporina (3-6 mg/kg/dia). Os pacientes devem ser cuidadosamente monitorados quanto à elevação da pressão arterial, redução da função renal e hepática e elevação de triglicérides. Outros agentes são: tacrolimus34, azatioprina, dapsona (100-200 mg/ dia, por via oral), talidomida (400 mg/dia, por via oral) e clofazimina11. A clofazimina possui ação antiinflamatória e melhora a fagocitose neutrofílica; deve ser utilizada a razão de 100-400 mg/dia, por via oral. Seus efeitos colaterais incluem secura e pigmentação escura ou avermelhada da pele (reversíveis), infarto esplênico e deposição de cristais no intestino3. Mais recentemente, um novo medicamento, o infliximabe, tem sido utilizado com sucesso nos casos resistentes a outras terapêuticas36. O infliximabe é um anticorpo monoclonal anti-TNF-a. Um problema com este medicamento é seu custo elevado; é, ainda, contra-indicado na insuficiência cardíaca.
A infecção tem obrigatoriamente que ser excluída, visto que as substâncias citadas são imunossupressoras. A cirurgia tem lugar no tratamento final do PG, quando enxertos ou retalhos poderão ser necessários para o fechamento de grandes áreas de perda cutânea, após o controle da doença37.
RELATO DE CASO
Paciente de 37 anos, casada, do lar, feodérmica, previamente assintomática, foi submetida, por ginecologista, a histerectomia, através de uma laparotomia mediana infraumbilical. Cerca de 40 dias depois, na cicatriz, surgiram eritema, pústulas e, depois, necrose e ulceração com evolução crônica (Figura 1). Tratamento com antibiótico sistêmico e cuidados locais foi ineficaz. Várias culturas de material colhido nas lesões foram negativas. Um primeiro desbridamento, com ressutura, resultou em recidiva do problema (Figura 2). A paciente foi encaminhada ao autor, sendo feito outro desbridamento. O estudo histopatológico do material do desbridamento acusou processo inflamatório inespecífico. Nova recidiva surgiu em pouco tempo. A paciente negava sintomas de doenças reumáticas ou intestinais. Mesmo assim, foi solicitado um estudo radiológico (de trânsito) do intestino delgado. Este mostrou sinais radiológicos compatíveis com doença de Crohn. Foi feito, então, o diagnóstico presuntivo de PG, sendo iniciado o uso de prednisona (20 mg/ dia), com melhora lenta, mas perceptível.
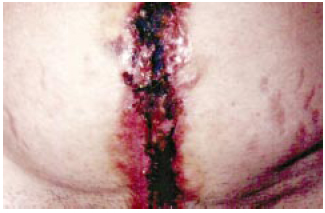
Figura 1 - Área da cicatriz de laparotomia com PG em atividade.
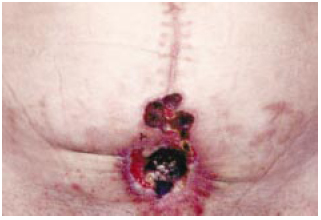
Figura 2 - Área da cicatriz de laparotomia após o primeiro desbridamento e recorrência do PG.
Entretanto, tendo surgido moderados efeitos colaterais, a paciente se recusou a continuar o uso do corticosteróide e procurou atenção médica alhures. Três anos mais tarde, já tinha sido submetida, em outro serviço, a mais três procedimentos de desbridamento, com invariável recidiva do processo. Foi também submetida a tentativa de reconstrução por retalho em ilha do músculo reto do abdome, com sucesso apenas passageiro. Permanecendo ignorado o diagnóstico de PG, sua doença de base não foi tratada. A região afetada restava com ulceração crônica (Figura 3).
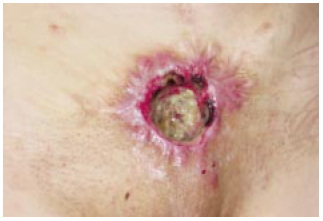
Figura 3 - Área afetada três anos mais tarde; o PG permanece em atividade após vários outros procedimentos operatórios.
COMENTÁRIOS
Dentre as inúmeras causas de complicações pós-operatórias na Cirurgia Plástica, poucas serão tão sérias e devastadoras quanto o PG. Tais lesões são devastadoras para o paciente e também para o profissional. Este, frente a um caso desta doença liquidando um resultado que, de outra forma, seria satisfatório, terá postas à prova todas as suas habilidades técnicas, científicas e de relacionamento.
O fato de ser raro não faz do PG uma afecção cujo desconhecimento, pelo cirurgião plástico, possa ser escusado. Ninguém faz diagnósticos de afecções que não conhece e, no caso do PG, a ausência do diagnóstico pode piorar consideravelmente sua evolução. Deveria ser citado em termos de consentimento, dentre as complicações possíveis em todas as operações.
Cuidados especiais são requeridos quando o cirurgião plástico vai operar quem já tem diagnóstico de doenças em que o PG incide como complicação. Destaquem-se, especialmente, as doenças inflamatórias intestinais (doença de Crohn e retocolite ulcerativa) e reumáticas. Nestes casos, é indispensável uma discussão franca entre o médico e o candidato à operação. Ao paciente devem ser dados todos os esclarecimentos possíveis, ficando bem claro que, em que pese sua raridade, o PG incide mais em quem tem precedentes de processo inflamatório crônico. Nestes casos, o termo de consentimento deveria mencionar expressamente que o paciente foi advertido a respeito da possibilidade da ocorrência do PG e que tomou pleno conhecimento de sua possível evolução e de sua gravidade.
Ao deparar-se com o PG, aconselha-se que o cirurgião plástico tome uma série de cuidados especiais. Deverá documentar minuciosamente o curso do problema, tanto nas anotações de prontuário quanto no que tange a fotografias. Será de bom alvitre o auxílio de outros especialistas, como dermatologistas, imunologistas e clínicos gerais. O tratamento irá demandar o emprego de medicamentos imunossupressores, cujo manejo não está, normalmente, na alçada da Cirurgia Plástica. O paciente deverá ser visto repetidamente e todos os recursos possíveis deverão ser postos à sua disposição. Será necessária boa dose de abnegação e outro tanto de renúncias, tudo em prol de manter a melhor relação possível com o paciente. Uma espécie de tentação, à qual se deve fugir nestes casos, é aquela do intervencionismo exagerado: desbridamentos e ressuturas devem ser evitados pois, como já se disse, irão piorar o quadro, em decorrência da patergia. Também cumpre lembrar que, não sendo o PG uma doença infecciosa, será parcimonioso o uso de antibióticos, sendo indicados apenas se alguma infecção surgir - há, aqui, um paralelo com as queimaduras.
CONCLUSÕES
1. O PG é uma doença incomum e de etiologia obscura.
2. O PG pode ser uma grave complicação pós-operatória, requerendo tratamento imediato e agressivo.
3. O cirurgião plástico necessita conhecer esta doença.
4. O desconhecimento pode levar a tratamento inadequado e piora de sua evolução.
AGRADECIMENTO
Ao Dr. Luiz Roberto Lajara (Titular da SBCP, Varginha, MG), pela cessão da Figura 3.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Blitz NM, Rudikoff D. Pyoderma gangrenosum. Mt Sinai J Med. 2001;68(4-5):287-97.
2. Wines N, Wines M, Ryman W. Understanding pyoderma gangrenosum: a review. Med Gen Med. 2001;3(3):6.
3. Costa IMC, Nogueira LSC. Pioderma gangrenoso e artrite reumatóide: relato de caso. An Bras Dermatol. 2005;80(1):81-2.
4. Wollina U. Clinical management of pyoderma gangrenosum. Am J Clin Dermatol. 2002;3(3):149-58.
5. Born S, Marsch WC. Postoperative pyoderma gangrenosum. Chirurgie. 2001;72(9):1043-7.
6. Bennett ML, Jackson JM, Jorizzo JL, Fleischer AB Jr, White WL, Callen JP. Pyoderma gangrenosum: a comparison of typical and atypical forms with an emphasis on time to remission. Case review of 86 patients from 2 institutions. Medicine (Baltimore). 2000;79(1):37-46.
7. Brunsting LA, Goeckerman WH, O'Leary PA. Pyoderma (ecthyma) gangrenosum: clinical and experimental observations in five cases occurring in adults. Arch Dermatol Syphilol. 1930;22:655-80.
8. Souza CS, Chioss MPV, Takada MH, Foss NT, Roselino AMF. Pioderma gangrenoso: casuística e revisão de aspectos clínico-laboratoriais e terapêuticos. An Bras Dermatol. 1999;74(5):465-72.
9. Powell FC, Su WP, Perry HO. Pyoderma gangrenosum: classification and management. J Am Acad Dermatol. 1996;34(3):395-412.
10. Teixeira GJT, Silva JH, Teixeira MG, Almeida MG, Calache JE, Habr-Gama A. Manifestações extra-intestinais após tratamento cirúrgico da retocolite ulcerativa. Rev Bras Coloproct. 2001;21(1):9-18.
11. Schofer H, Baur S. Successful treatment of postoperative pyoderma gangrenosum with cyclosporin. J Eur Acad Dermatol Venereol. 2002;16(2):148-51.
12. Sheldon DG, Sawchuk LL, Kozarek RA, Thirlby RC. Twenty cases of peristomal pyoderma gangrenosum: diagnostic implications and management. Arch Surg. 2000;135(5): 564-9.
13. Wong YW, Lyon CC, Benbow EW, Bradley BL, Beck MH.
Pyoderma gangrenosum in a thoracotomy wound associated with a pulmonary cavitating lesion. Clin Exp Dermatol. 2003;28(3):274-6.
14. Kuhn C, Vente C, Dorner J, Rataysky H, Burchardi H. Pyoderma gangrenosum: an important differential diagnosis from wound infection. Case report of a life threatening course. Anaesthesist. 2000;49(9):829-33.
15. Ronnau AC, von Schmiedeberg S, Bielfeld P, Ruzicka T, Schuppe HC. Pyoderma gangrenosum after cesarean delivery. Am J Obstet Gynecol. 2000;183(2):502-4.
16. Rand RP, Olerud JE, Verrier ED. Pyoderma gangrenosum after coronary artery bypass grafting. Ann Thorac Surg. 1993;55(4):1016-8.
17. Michel P, Wullstein C, Hopt UT. Pyoderma gangrenosum after TAPP hernioplasty: a rare differential necrotizing wound infection diagnosis. Chirurgie. 2001;72(12):1501-3.
18. Born S, Marsch WC. Postoperative pyoderma gangrenosum. Chirurgie. 2001;72(9):1043-7.
19. Baruch J, Julien M, Touraine R, Slaoui SE, Auffret P. Postoperative pyoderma gangrenosum and cancer of the breast. Apropos of a case. Chirurgie. 1989;115(2):142-5.
20. Borlu M, Utas S. Pyoderma gangrenosum after cholecystectomy. J Eur Acad Dermatol Venereol. 2001;15(2):185-6.
21. Swinson BD, Morrison CM, Sinclair JS. Pyoderma gangrenosum: a complication of breast biopsy. Ulster Med J. 2002;71(1):66-7.
22. Umezawa Y, Oyake S, Oh-i T, Nagae T, Ishimaru S. A case of pyoderma gangrenosum on the stump of an amputated right leg. J Dermatol. 2000;27(8):529-32.
23. Meyer TN. Pioderma gangrenoso: uma grave complicação da cicatrização. In: V Simpósio da Clínica de Cirurgia Plástica do Hospital Mater Dei, 2003 Jun 19-21, Belo Horizonte, Brasil.
24. Gulyas K, Kimble FW. Atypical pyoderma gangrenosum after breast reduction. Aesthetic Plast Surg. 2003;27(4):328-31.
25. Berry MG, Tavakkolizadeh A, Sommerlad BC. Necrotizing ulceration after breast reduction. J R Soc Med. 2003;96(4):186-7.
26. Gudi VS, Julian C, Bowers PW. Pyoderma gangrenosum complicating bilateral mammaplasty. Br J Plast Surg. 2000;53(5):440-1.
27. Lifchez SD, Larson DL. Pyoderma gangrenosum after reduction mammaplasty in an otherwise healthy patient. Ann Plast Surg. 2002;49(4):410-3.
28. Grau Salvat C, Miquel FJ, Pont V, Aliaga A. Pyoderma gangrenosum: unusual complication following mammoplasty reduction. Int J Dermatol. 1998;37(10):794-6.
29. Gonçalves J, Capon Degardin N, Laurent F, Batard ML, Pellerin P. Familial pyoderma gangrenosum following a mammoplasty reduction: a case report. Ann Chir Plast Esthet. 2002;47(4):308-10.
30. Sotillo-Gago I, Munoz-Perez MA, Camacho-Martinez F. Pyoderma gangrenosum after augmentation mammoplasty. Acta Derm Venereol. 1999;79(6):486.
31. MacKenzie D, Moiemen N, Frame JD. Pyoderma gangrenosum following breast reconstruction. Br J Plast Surg. 2000;53(5):441-3.
32. Jain A, Nanchahal J, Bunker C. Pyoderma gangrenosum occurring in a lower limb fasciocutaneous flap: a lesson to learn. Br J Plast Surg. 2000;53(5):437-40.
33. Robert C, Kupper TS. Inflammatory skin diseases, T cells, and immune surveillance. N Engl J Med. 1999;341(24):1817-28.
34. D'Inca R, Fagiuoli S, Sturniolo GC. Tacrolimus to treat pyoderma gangrenosum resistant to cyclosporine. Ann Intern Med. 1998;128(9):783-4.
35. Gul A, Esin S, Dilsen N, Konice M, Wigzell H, Biberfeld P. Immunohistology of skin pathergy reaction in Behcet's disease. Br J Dermatol. 1995;132(6):901-7.
36. Regueiro M, Valentine J, Plevy S, Fleisher MR, Lichtenstein GR. Infliximab for treatment of pyoderma gangrenosum associated with inflammatory bowel disease. Am J Gastroenterol. 2003;98(8):1821-6.
37. Rozen SM, Nahabedian MY, Manson PN. Management strategies for pyoderma gangrenosum: case studies and review of literature. Ann Plast Surg. 2001;47(3):310-5.
Doutor em Cirurgia pela UFMG (Universidade Federal de Minas Gerais). Professor da UNINCOR (Universidade do Vale do Rio Verde). Membro Titular da Sociedade Brasileira de Cirurgia Plástica.
Correspondência para:
Tufi Neder Meyer
Rua Desembargador Alberto Luz, 129 - Centro
Três Corações, MG - CEP: 37410-000
Telefax: 0xx35 3231-2147
E-mail: tufimeyer@uol.com.br
Trabalho realizado na UNINCOR (Universidade do Vale do Rio Verde) e Sulplast Clínica Cirúrgica, Três Corações, MG. Trabalho apresentado no 40º Congresso Brasileiro de Cirurgia Plástica, Fortaleza, 19 a 22 de novembro de 2003.
Artigo recebido: 11/01/2006
Artigo aprovado: 06/04/2006


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter