

Face I - Year 2018 - Volume 33 - (Suppl.1)
Angioedema facial em paciente submetido à lifting cervical: um relato de caso
RESUMO
INTRODUÇÃO: Pouco se sabe sobre os casos de angioedema pós-operatórios graves e muitas vezes essa entidade é de difícil diagnóstico e pode passar despercebida, com repercussões no desfecho dos pacientes. Dentre os diagnósticos diferenciais, estão o angioedema hereditário, angioedema não hereditário, alérfico, andioedema adquirido, idiopático. Diferenciar essas entidades é importante para que o tratamento seja rapidamente instituído e o paciente evolua de forma favorável.
OBJETIVO: Relatar o caso de um paciente que desenvolveu angioedema de face grave após uma cirurgia de lifting facial.
MÉTODOS: As informações foram obtidas por meio de revisão do prontuário, entrevista com a paciente, registro fotográfico e revisão da literatura.
Resultados/Relato do Caso: Paciente feminino, 64 anos, submetida à cirurgia de lifting facial completo evoluiu com angioedema agudo no terceiro dia pós-operatório, com necessidade de suporte ventilatório. Inicialmente, o tratamento instituído foi com anti-histamínicos, glicocorticoides e adrenalina na suspeita de angioedema alérgico, porém, a paciente não teve melhora dos sintomas. Frente à suspeita de angioedema idiopático, iniciou-se terapia com plasma fresco congelado, quando houve melhora paulatina do quadro clínico. A paciente seguiu acompanhamento ambulatorial frequente. Teve como complicação do angioedema o sofrimento isquêmico do retalho retroauricular, necessitando de desbridamento, o qual foi deixado cicatrizar por segunda intenção. Atualmente, paciente encontra-se bem, sem quaisquer queixas.
CONCLUSÃO: O cirurgião plástico deve estar alerta para complicações pós-operatórias como a descrita, pois a terapêutica deve ser iniciada com maior brevidade para melhores desfechos. A rápida evolução do caso nos atenta para a gravidade da complicação e necessidade do conhecimento desta entidade.
Palavras-chave: Angioedema; Angioedemas hereditários; Procedimentos cirúrgicos reconstrutivos cosméticos.
O angioedema hereditário (HAE - em inglês hereditary angioedema) é uma entidade pouco conhecida, relativamente rara, com prevalência de aproximadamente 1:50.000 pessoas1; tem caráter autossômico dominante e se apresenta clinicamente com episódios recorrentes de angioedema2.
É causada por deficiência da esterase inibidora de C1 (C1-INH), uma proteína do sistema do complemento que controla a permeabilidade vascular3, além de estar envolvida na cascata da calicreina-cinina, cascata fibrinolítica e da coagulação2. Não há diferenças étnicas ou de gênero nos pacientes com HAE. Há mais de 200 mutações descritas e estão localizadas no cromossomo 11 (11q11-q13.1), com a posição relativa do gene ditando qual o tipo de HAE resultante4.
Há 3 variantes de angioedema hereditário: o HAE tipo I afeta 85% dos pacientes e é caracterizado por níveis baixos de C1 INH (aproximadamente 30% dos níveis normais); o tipo II afeta 15% dos pacientes, há produção de C1 INH inativo mas níveis plasmáticos são normais5; o tipo III, é muito raro, afeta principalmente mulheres e é caracterizado por níveis normais de C1 INH e pode ser estrógeno dependente1,6.
HAE é caracterizada por episódios de edema da laringe, face, trato gastrointestinal e extremidades. O edema laríngeo já foi descrito como complicação após cirurgia na cavidade oral2 e pode ser uma condição ameaçadora da vida por obstrução da via aérea. Os ataques normalmente ocorrem 4-30h após a cirurgia e normalmente próximos à área do trauma cirúrgico7.
Ataques não tratados normalmente duram 3-5 dias; o início dos sintomas normalmente acontece na infância, com aumento da sintomatologia na adolescência e ataques recorrentes durante o resto da vida. A maior parte dos ataques são espontâneos, resultando em manifestações imprevisíveis, e os fatores desencadeantes são de difícil identificação. Entretanto, há alguns gatilhos descritos na literatura como: cirurgia oral (inclusive procedimentos dentários), ferimentos menores e trauma, infecções, estresse emocional, certas medicações (inclusive as utilizadas em anestesia), alimentos e até mesmo menstruação8-11.
O angioedema não-hereditário com inibidor da esterase C1 normal pode ser presumivelmente mediado por bradicinina ou por mastócitos, ou até mesmo de causa desconhecida12. O acúmulo de bradicinina pode também ser causado pelo uso de inibidores da ECA, com incidência de 0,68% em pacientes que fazem uso dessa medicação13.
Entretanto, a maioria dos pacientes tem angioedema adquirido idiopático, no qual há o C1 INH está em níveis normais e não há história familiar de angioedema, e, além disso, foram excluídas outras causas conhecidas de AE12. O angioedema adquirido normalmente apresenta-se após a quarta década de vida e não há história familiar. Muitos pacientes têm desordens hematológicas ou imunológicas subjacentes. Podemos citar das hematológicas a gamapatia monoclonal, neoplasias linfoproliferativas, macroglobulinemia de Waldenstroms; das imunológicas, lúpus eritematoso sistêmico14.
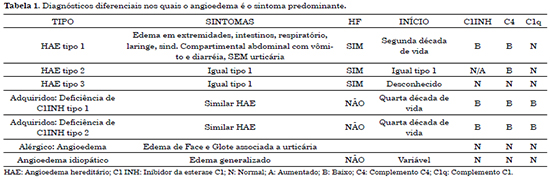
É importante fazer o diagnóstico diferencial dessas entidades, pois a evolução favorável do paciente vai depender do diagnóstico correto e imediata administração do tratamento específico. A localização do edema e a presença de urticária contribuem para diferenciar AE alérgico do não alérgico. A Tabela 1 lista os diagnósticos diferenciais, alérgicos e não alérgicos, no qual o angioedema é a sintoma predominante. Como dito, o diagnóstico diferencial é de suma importância, uma vez que o tratamento para angioedema alérgico é a administração de anti-histamínicos ou glicocorticoides, os quais não têm papel na HAE ou no angioedema idiopático. A Tabela 1 cita como fazer o diagnóstico diferencial.
Várias medicações estão hoje disponíveis para o tratamento, como: ácido tranexâmico, danazol, plasma fresco congelado, ecallantide (inibidor seletivo da calicreína plasmática), icatibant (antagonista seletivo do receptor B2 da bradicinina). Algumas dessas drogas são liberadas para ataques agudos, outras para tratamento profilático15.
O ácido tranexâmico e antifibrinoliticos melhoram sintomas de ataques agudos, mas a sua eficácia não foi provada em estudos clínicos. Antiandrógenos reduzem o número e a gravidade dos ataques quando usados profilaticamente, porém têm importantes efeitos adversos. A terapia endovenosa com inibidor da C1 esterase reverte ataques agudos, mas estão disponíveis em poucos países16.
Independentemente do mecanismo ou sitio do trauma, o estrese psicológico associado com o procedimento/cirurgia, e até mesmo alguma doença subjacente que tenha passado despercebida na avaliação pré-operatória, podem contribuir para o surgimento do angioedema. O angioedema perioperatório pode ser a primeira manifestação de angioedema hereditário. A importância de ter conhecimento do diagnóstico do HAE e as características da doença antes da cirurgia é evidente, para que a equipe médica possa precaver-se e para que haja estrutura para o manejo e tratamento imediato caso o ataque ocorra3.
Mesmo que a incidência seja baixa sem profilaxia, a natureza imprevisível dos ataques impõe a necessidade considerar a profilaxia antes de cirurgias para pacientes com HAE conhecida. Há registro de pacientes que tiveram angioedema perioperatório em uma ocasião e não tiveram novos episódios em procedimentos realizados posteriormente, o que fortalece o caráter imprevisível da doença.
Há significante mortalidade associada com HAE. Se não for diagnosticada, a mortalidade pode chegar a 30-40%, principalmente por obstrução da via aérea superior.
OBJETIVO
Relatar o caso de um paciente que desenvolveu angioedema de face grave após uma cirurgia de lifting cervical.
MÉTODOS
As informações contidas neste trabalho foram obtidas por meio de revisão do prontuário, entrevista com a paciente, registro fotográfico e revisão da literatura.
RESULTADOS
Paciente do gênero feminino, 64 anos, foi submetida à cirurgia de lifting facial completo no dia 18/04/2017. Apresentou boa evolução pós-operatória imediato, razão pela qual a equipe de cirurgia plástica decidiu dar alta no mesmo dia da cirurgia. No dia seguinte, a paciente relatou edema na ferida operatória, que aumentou progressivamente e migrou para a região periocular, e posteriormente região peribucal e cervical anterior, culminando em insuficiência respiratória no 3º dia de pós-operatório.
Foi admitida na Unidade de Terapia Intensiva (UTI) da clínica da Unimed em São José - SC, onde foi imediatamente submetida à entubação orotraqueal. Solicitados exames de imagem (Figura 1). Inicialmente, o tratamento instituído foi com anti-histamínicos, glicocorticoides e adrenalina na suspeita de angioedema alérgico, porém a paciente não teve melhora dos sintomas. Solicitados exames laboratoriais e de imagem, cujos resultados estão na Tabela 2 e na Figura 1.
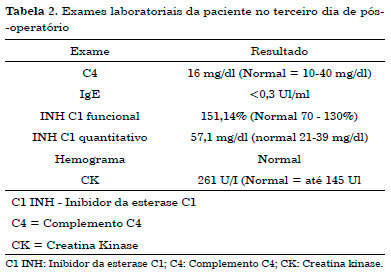
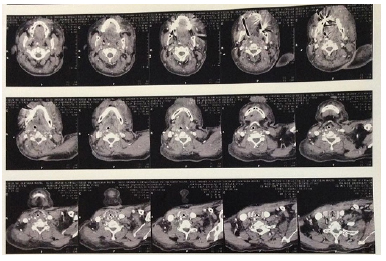
Figura 1. TC cervical no 3º PO (21/04/2017): edema difuso de faringe e laringe com obliteração das vias aéreas, infiltração da gordura dos espaços cervicais anterior e posterior.
Frente à suspeita de angioedema idiopático, iniciou-se terapia com plasma fresco congelado, quando houve melhora paulatina do quadro clínico. O edema diminuiu consideravelmente e melhorou o padrão respiratório até o dia 03/05/2017, quando foi dada de alta da UTI; a alta hospitalar definitiva foi no dia 10/05/2017.
Paciente tinha como antecedentes: dislipidemia em tratamento com sinvastatina 20 mg/dia (suspensa um mês antes da cirurgia), negava alergias e tabagismo e já havia realizado 2 cesarianas (há 35 e 30 anos, respectivamente) e 2 implantes dentários (há 2 anos e o último 3 semanas antes da cirurgia de lifting facial).
A paciente seguiu acompanhamento ambulatorial frequente. Teve como complicação do angioedema o sofrimento isquêmico do retalho retroauricular, necessitando de desbridamento. Na ocasião, foi optado por deixar cicatrizar por segunda intenção. Atualmente, paciente encontra-se bem, sem quaisquer queixas. (Evolução do quadro nas Figuras 2, 3 e 4).
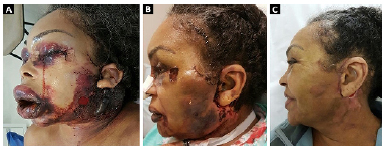
Figura 2. Pós-operatórios: A: 3 dias; B: 17 dias; C: 1 mês 5 dias.
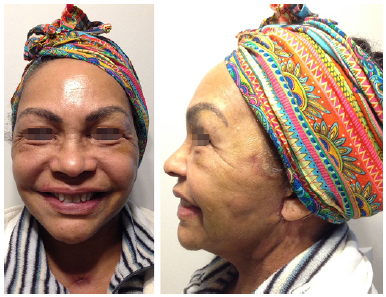
Figura 3. Pós-operatório tardio (2 meses).
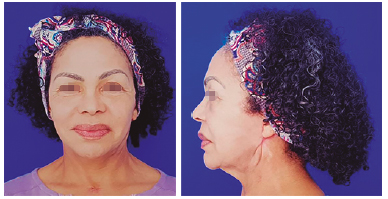
Figura 4. Pós-operatório tardio (6 meses).
DISCUSSÃO
Angioedema hereditário (HAE) leva a edema imprevisível de tecidos subcutâneos e mucosas com potenciais complicações fatais. A grande maioria dos pacientes (85%) tem o inibidor da C1 baixos com nível de C1 aumentados, porém 15% dos pacientes têm níveis normais ou até elevados de inibidores da C1. O angioedema não hereditário com inibidor da esterase C1 normal pode ser presumivelmente mediado por bradicinina ou por mastócitos, ou até mesmo de causa desconhecida12.
Entretanto, a maioria dos pacientes tem angioedema adquirido idiopático, no qual há angioedema com C1 INH normal sem história familiar de angioedema. Nesses, é imperativa a exclusão de outras causas conhecidas de AE12. O angioedema idiopático não histaminérgico se caracteriza por ser uma forma não hereditária de angioedema em que todas as causas conhecidas de angioedema foram excluídas e os sintomas persistem apesar do tratamento contínuo com altas doses de anti-histamínicos. Não há dados que permitam estimar a frequência deste tipo de angioedema na população17.
É importante salientar que, independentemente do mecanismo ou sitio do trauma, o estresse psicológico associado com o procedimento/cirurgia ou alguma doença subjacente que tenha passado despercebido podem contribuir para o surgimento do angioedema. O angioedema adquirido normalmente se manifesta após a quarta década e não há história familiar normalmente. Muitos pacientes têm alguma desordem autoimune ou hematológica subjacente como fator causador14.
Os ataques de angioedema normalmente ocorrem 4-30h após a cirurgia e normalmente próximo a área do trauma cirúrgico7, o que está de acordo com o que ocorreu com nossa paciente, que teve insuficiência respiratória, necessitou de internação em UTI, entubação orotraqueal. Em um estudo norte-americano que incluiu 367 pacientes com angioedema, entubação ocorreu em apenas 3,3% e traqueostomia ou cricotireoidostomia em apenas 0,3%18.
Quanto aos tratamentos, mesmo que não aprovado pelo FDA, o plasma fresco congelado pode ser usado para HAE, caso não haja terapias mais específicas. O angioedema pode inicialmente piorar devido ao aumento de bradicinina causado pelo substrato kininogênio19. Nossa paciente levou aproximadamente 24h para iniciar melhora do quadro após início da terapia.
Curiosamente, nossa paciente apresentou angioedema no pós-operatório com níveis normais de C4 (complemento) e níveis elevados de inibidor da C1 funcional e quantitativa, o que vai contra o diagnóstico HAE tipo I, II ou angioedema adquirido. Além disso, não teve urticária, o que afasta AE alérgico e não tinha história familiar, que afasta a possibilidade de HAE tipo III.
Apesar de o caso não ter sido completamente elucidado, a paciente teve diagnóstico presuntivo de angioedema idiopático, pois não pode ser caracterizada em nenhum dos outros diagnósticos diferenciais.
CONCLUSÃO
O cirurgião plástico deve estar alerta para complicações pós-operatórias como a descrita, pois a terapêutica deve iniciada com maior brevidade para melhores desfechos. A rápida evolução do caso nos atenta para gravidade da complicação e necessidade do conhecimento desta entidade.
REFERÊNCIAS
1. Zuraw BL. Clinical practice. Hereditary angioedema. N Engl J Med. 2008;359(10):1027-36.
2. Cifuentes J, Palisson F, Valladares S, Jerez D. Life-threatening complications following orthognathic surgery in a patient with undiagnosed hereditary angioedema. J Oral Maxillofac Surg. 2013;71(4):e185-8.
3. Aygören-Pürsün E, Martinez Saguer I, Kreuz W, Klingebiel T, Schwabe D. Risk of angioedema following invasive or surgical procedures in HAE type I and II--the natural history. Allergy. 2013;68(8):1034-9.
4. Pappalardo E, Caccia S, Suffritti C, Tordai A, Zingale LC, Cicardi M. Mutation screening of C1 inhibitor gene in 108 unrelated families with hereditary angioedema: functional and structural correlates. Mol Immunol. 2008;45(13):3536-44.
5. Gompels MM, Lock RJ, Abinun M, Bethune CA, Davies G, Grattan C, et al. C1 inhibitor deficiency: consensus document. Clin Exp Immunol. 2005;139(3):379-94.
6. Gavigan G, Yang WH, Santucci S, Harrison R, Karsh J. The prophylactic use of C1 inhibitor in hereditary angioedema patients undergoing invasive surgical procedures: a retrospective study. Allergy Asthma Clin Immunol. 2014;10(1):17.
7. Craig T, Aygören-Pürsün E, Bork K, Bowen T, Boysen H, Farkas H, et al. WAO Guideline for the Management of Hereditary Angioedema. World Allergy Organ J. 2012;5(12):182-99.
8. Davis AE III, Bissler JJ, Aulak KS. Genetic defects in the C1 inhibitor gene. Complement Today. 1993;1:133-50.
9. Cicardi M, Johnston DT. Hereditary and acquired complement component 1 esterase inhibitor deficiency: a review for the hematologist. Acta Haematol. 2012;127(4):208-20.
10. Bowen T, Cicardi M, Bork K, Zuraw B, Frank M, Ritchie B, et al. Hereditary angiodema: a current state-of-the-art review, VII: Canadian Hungarian 2007 International Consensus Algorithm for the Diagnosis, Therapy, and Management of Hereditary Angioedema. Ann Allergy Asthma Immunol. 2008;100(1 Suppl 2):S30-40.
11. Bork K, Hardt J, Schicketanz KH, Ressel N. Clinical studies of sudden upper airway obstruction in patients with hereditary angioedema due to C1 esterase inhibitor deficiency. Arch Intern Med. 2003;163(10):1229-35.
12. van den Elzen M, Go MF, Knulst AC, Blankestijn MA, van Os-Medendorp H, Otten HG. Efficacy of Treatment of Non-hereditary Angioedema. Clin Rev Allergy Immunol. 2016.
13. Baş M, Greve J, Stelter K, Havel M, Strassen U, Rotter N, et al. A randomized trial of icatibant in ACE-inhibitor-induced angioedema. N Engl J Med. 2015;372(5):418-25.
14. LoVerde D, Files DC, Krishnaswamy G. Angioedema. Crit Care Med. 2017;45(4):725-35.
15. Cicardi M, Aberer W, Banerji A, Bas M, Bernstein JA, Bork K, et al.; HAWK under the patronage of EAACI (European Academy of Allergy and Clinical Immunology). Classification, diagnosis, and approach to treatment for angioedema: consensus report from the Hereditary Angioedema International Working Group. Allergy. 2014;69(5):602-16.
16. Cicardi M, Banerji A, Bracho F, Malbrán A, Rosenkranz B, Riedl M, et al. Icatibant, a new bradykinin-receptor antagonist, in hereditary angioedema. N Engl J Med. 2010;363(6):532-41.
17. Ferraro MF, Arruda LK, Maia LSM, Moreno AS. Angioedema hereditário e outras formas de angioedema por bradicinina: atualização no diagnóstico e tratamento. Braz J Allergy Immunol. 2014;2(1):6-20.
18. Tai S, Mascaro M, Goldstein NA. Angioedema: a review of 367 episodes presenting to three tertiary care hospitals. Ann Otol Rhinol Laryngol. 2010;119(12):836-41.
19. Lewis LM. Angioedema: etiology, pathophysiology, current and emerging therapies. J Emerg Med. 2013;45(5):789-96.
Universidade Federal de Santa Catarina HU/UFSC, Florianópolis, SC, Brasil
Endereço Autor:
Carlo Mognon Mattiello
Rua Professora Maria Flora Pausewang, s/nº, Trindade
Florianópolis, SC, Brasil - CEP 88036-800
E-mail: carlommattiello@hotmail.com


 Read in Portuguese
Read in Portuguese
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter