

Original Article - Year 2007 - Volume 22 -
Construction of an in vitro equivalent skin
CONSTRUÇÃO DE EQUIVALENTE DERMO-EPIDÉRMICO IN VITRO*
ABSTRACT
Background: Human skin is a tegument composed by two different layers: a dermis and epidermis. In situations like trauma and burns, partial or complete loss of this tegument may occur. In 1979, Bell et al. have demonstrated that human fibroblast cultivated over a type I mouse collagen lattice could cause contract that lattice. Methods: In this study, we construct an artificial skin equivalent composite using keratinocytes, cultured over a collagen lattice populated by fibroblasts. This cocultured system was investigated for 3 weeks, and saw in the light microscopic level in the days 4, 7, 14 and 21 days. Results: This study showed the stratification and differentiation of the epithelium in contact with the air is much better than without. Maybe, this system can be use like a skin-substitute.
Keywords: Keratinocytes. Fibroblasts. Artificial skin. Collagen
RESUMO
Introdução: Dentre as diversas pesquisas realizadas na área de bioengenharia de tecidos, a criação in vitro de tecidos vivos tornase uma das mais promissoras formas de atuação científica. Neste caminho, cada vez mais têm sido descritos novos substitutos cutâneos para o tratamento de grandes lesões da pele. Bell et al. descreveram um modelo de matriz colágena tipo I contrátil após a adição de fibroblastos. Método: O presente estudo propõe a elaboração in vitro de um equivalente dermo-epidérmico composto por uma "derme" de colágeno povoada por fibroblastos, acompanhado de um epitélio de queratinócitos cultivados em sua superfície anterior no papel de "epiderme". Além disso, estuda as alterações histológicas encontradas nos dias de cultura 4, 7, 14 e 21, avaliando a influência da interface ar-líquido na estratificação do epitélio. Resultados: Os resultados mostraram que houve a criação de um substituto dermo-epidérmico in vitro, com a formação de um epitélio com boa estratificação, sendo que o contato com o ar aumenta esta estratificação.
Palavras-chave: Ceratinócitos. Fibroblastos. Pele artificial.Colágeno
Diversas situações, como queimaduras e traumatismos, podem proporcionar a destruição do revestimento cutâneo. A interrupção acidental da continuidade da pele predispõe a infecções e perdas volêmicas importantes, resultando em grande morbidade e mortalidade. O consenso em relação à importância da oclusão precoce de áreas cruentas resultantes desses traumas motivou o interesse por materiais sintéticos ou biológicos a serem utilizados como substitutos cutâneos, entre eles: auto-enxertos e aloenxertos de pele, curativos biosintéticos e, como proposto neste trabalho, equivalentes dermo-epidérmicos construídos in vitro.
Não há dúvida de que os enxertos autógenos perduram como a alternativa de escolha para o fechamento definitivo de áreas cruentas. Porém, alguns pacientes apresentam escassez de áreas doadoras de pele. Apesar do desenvolvimento da expansão de enxertos autógenos sob a forma de malha (mesh graft) proposta por Tanner e Vandeput1, o problema da escassez de áreas doadoras nunca foi totalmente solucionado.
Em 1943, Gibson e Medawar2 já verificavam que os aloenxertos preveniam o ressecamento das áreas cruentas, auxiliavam o desenvolvimento do tecido de granulação, diminuíam as perdas evaporativas, protéicas e de calor, limitavam a proliferação bacteriana e reduziam a dor. Infelizmente, os mecanismos biológicos de rejeição os tornavam opção apenas de uso temporário, devendo ser substituídos por novo lote de aloenxertos ou por auto-enxertos. Alguns autores propuseram o uso de drogas, como a ciclosporina, para a modulação dos fenômenos imunológicos, mas os riscos conseqüentes a esta imunossupressão tornavam questionável a conduta3.
O conceito da elaboração de um equivalente dermo-epidérmico surgiu a partir da possibilidade de cultivo in vitro de fibroblastos e queratinócitos, e do uso de matrizes que simulem a derme.
Rheinwald e Green4 desenvolveram protocolo próprio de cultura de queratinócitos a partir de células isoladas, no qual queratinócitos com potencial clonogênico multiplicavam-se, coalesciam, formavam epitélio transplantável ou podiam ser utilizados em culturas secundárias. Posteriormente, Gallico et al.5 descreveram, com sucesso, a utilização clínica dos epitélios autólogos cultivados in vitro em pacientes vítimas de queimaduras. Devido aos resultados insatisfatórios, com grande ulceração dos pacientes, buscou-se a produção de compostos dermo-epidérmicos, em que as culturas de queratinócitos eram realizadas sobre diferentes tipos de matrizes dérmicas.
Bell et al.6,7 mostraram que fibroblastos humanos semeados em gel de colágeno tipo I contraíam este substrato. Atualmente, este modelo é utilizado por diversos autores como meio de estudo do processo contrátil da cicatrização humana.
Em vista da importância de se dispor de substitutos definitivos para o tratamento de grandes perdas cutâneas, e dos benefícios originados pela elaboração de compostos dermoepidérmicos para tal finalidade, propõe-se, neste trabalho, a elaboração in vitro de um equivalente dermo-epidérmico composto por colágeno povoado por fibroblastos no papel de derme, acompanhado de um epitélio de queratinócitos cultivados em sua superfície anterior como epiderme. Além disso, propõe-se analisar o efeito do contato com o ar na estratificação do epitélio do novo composto.
MÉTODO
Cultura de queratinócitos e fibroblastos
Ambas as células humanas foram isoladas de fragmentos cutâneos de espessura total removidos de mamoplastias redutoras, realizadas em pacientes saudáveis do sexo feminino, com idade entre 18 e 42 anos, que doaram a pele para pesquisa com aprovação do Comitê de Ética do HCFMUSP.
Os queratinócitos foram isolados segundo o método de tripsinização seriada, descrito por Rheinwald e Green4, enquanto os fibroblastos foram isolados pelo método de explante. O meio utilizado para o cultivo de queratinócitos foi baseado no proposto por Reinwald e Green4. As garrafas de cultura foram colocadas em estufa com atmosfera de CO2 a 5% e temperatura constante de 37ºC. O meio de cultura foi trocado a cada 48 horas, até a semiconfluência das células.
Polimerização da solução de colágeno tipo I
Para polimerização do colágeno tipo I e formação de matrizes, foi escolhido o método descrito pela Collagen Biomaterials - Vitrogen 100®, que consiste na adição de 400 ml de solução ácida de colágeno do tipo I + 400 ml de PBS 10X + 100 ml de PBS 10 vezes concentrado + 100 ml de NaOH (0,1N).
Preparação da matriz de colágeno povoada por fibroblastos
Em placas multipoços de 24 poços (Falcon), foram incluídos aproximadamente 5X 104 fibroblastos ressuspendidos em 400 µl de PBS 1X. Posteriormente, foram adicionados 100 µl de PBS 10X, 400 µl de solução ácida de colágeno e em 100 µl de NaOH (0,1N). Estas matrizes foram mantidas em estufa com 5% de CO2 a 37ºC por 12 horas, quando já estavam suficientemente polimerizadas.
Culturas secundárias dos queratinócitos sobre as matrizes colágenas povoadas por fibroblastos (criação de composto dermo-epidérmico)
Após 12 horas da polimerização das matrizes colágenas povoadas com fibroblastos, foram semeadas 1,2 X 105 queratinócitos sobre a superfície superior destas matrizes, formando co-culturas. O meio de cultura utilizado para manutenção da co-cultura foi o mesmo proposto por Reinwald e Green4, porém sem o acréscimo de adenina para evitar a morte de fibroblastos. As culturas são mantidas em estufa com 5% de CO2 a 37ºC por 48 horas.
Estabelecimento de modelo dermo-epidérmico in vitro
Foram criados 6 géis de co-culturas. Estes géis não foram desprendidos das paredes dos micropoços de cultura, e foram mantidos imersos em meio, na estufa a 5% de CO2 a 37ºC, com trocas de meio de cultura a cada 48 horas. Com 4 e 7 dias de cultura, um dos géis foi retirado cuidadosamente e conservado em formol a 10%. A partir do 7º dia, buscou-se avaliar a influência da interface ar-líquido. Para isto, dois compostos dermoepidérmicos foram suspensos em grelhas de aço inoxidável, de maneira que a base dérmica ficasse em contato com o meio de cultura, e os queratinócitos expostos ao ar. Com 14 e 21 dias foram enviados um gel imerso e outro emerso para análise histológica.
Estudos histológicos - microscopia ótica
O material da co-cultura com 4, 7, 14 e 21 dias (os últimos dois com imerso e com interface ar-líquido) foram enviados para inclusão em parafina, cortes e coloração com hematoxilina- eosina. As lâminas foram, então, analisadas em microscopia ótica.
RESULTADOS
Culturas secundárias dos queratinócitos sobre matrizes colágenas Neste estudo, observamos que ocorreu proliferação uniforme dos queratinócitos, tanto na situação imersa, como na presença de interface ar-líquido, demonstrando a eficiência do método de queratinócitos viáveis, a adequação da densidade proposta de semeadura das células e do meio de cultura utilizado (Figura 1). As grelhas de aço inoxidável possibilitaram criar de maneira eficiente a interface ar-líquido desejada, permitindo o contato exclusivo da matriz de colágeno com o meio de cultura e exposição ao ar das células proliferando na superfície (Figura 2).
Figura 1 - Composto dermo-epidérmico, em situação imersa, com 48 horas.

Figura 2 - Composto dermo-epidérmico, sobre grelha inoxidável, em situação emersa, com 10 dias de cultura.
Análise histológica do modelo dermo-epidérmico
No 4º e 7º dias de co-cultura dos compostos dermo-epidérmicos in vitro, no ambiente imerso, observa-se a formação de um epitélio em monocamada, sendo que, com o passar do tempo, observa-se que o epitélio torna-se mais contínuo, ou seja, sem áreas de falha.
A partir do 7º dia, houve uma divisão do experimento, mantendo metade dos géis imersos e a outra metade colocada sobre o efeito da interface ar-líquido.
No 14º dia, nota-se início de estratificação dos epitélios, com a formação duas a três camadas de células, porém ainda com uma certa desorganização epitelial. No sistema ar-líquido, o epitélio apresenta-se um pouco mais estratificado.
No 21º dia, nota-se uma estratificação muito maior, principalmente no sistema de interface ar-líquido, no qual se percebe o início da formação de um estrato córneo mostrado por lamelas de material queratinizado fortemente eosinófilo.
Na Figura 3, observa-se a evolução histológica do composto ao longo do tempo, tanto na situação emersa como imersa.
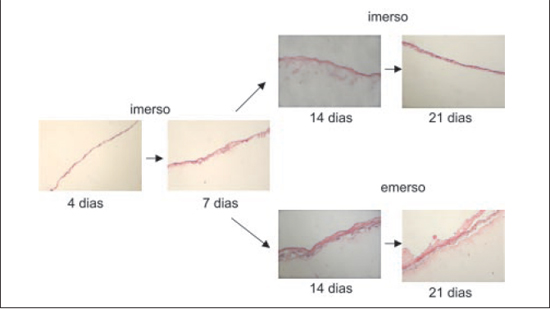
Figura 3 - Evolução histológica do composto ao longo do tempo.
DISCUSSÃO
Dentre as diversas aplicações da bioengenharia está a busca pela formação de novos tecidos. Neste trabalho, procurou- se investigar a viabilidade de construção in vitro de um composto dermo-epidérmico, baseado no cultivo de queratinócitos sobre matrizes colágenas povoadas por fibroblastos. Ambicionava-se a obtenção de uma estrutura de maior resistência mecânica, biocompatível e com algumas características morfológicas semelhantes à pele humana.
O composto proposto neste estudo foi executado sem dificuldade, podendo ser reproduzido. Trata-se de uma base dérmica simplificada, em que se utiliza colágeno tipo I com fibroblastos humanos. Sobre este material foi possível o crescimento de um epitélio cultivado, gerando diferenciação celular e estratificação da epiderme. Nas imagens histológicas com 21 dias, é possível até a visibilização da produção de queratina.
A construção de um equivalente usando apenas células autógenas aumenta a chance de uma maior biocompatibilidade do composto em comparação a outros substratos dérmicos (aloderme, polímeros, etc). Assim, ao se tentar tratar uma ferida, poder-se-ia cultivar fibroblastos e queratinócitos autógenos a partir de uma minúscula biópsia, reduzindo-se a antigenicidade do produto.
Histologicamente, após 14 dias, iniciou-se a estratificação do epitélio em ambos os sistemas de cultivo. Após 21 dias, o epitélio já se mostrava mais bem formado, sendo que no sistema emerso a estratificação era maior, mostrando uma queratinização muito mais evidente. Portanto, o cultivo de queratinócitos em interface ar-líquido gera uma estrutura epitelial mais bem formada, com células mais diferenciadas e mais próximas do encontrado no tecido normal.
Apesar da formação de um epitélio confluente e estratificado, pode-se notar, tanto no sistema imerso como no emerso, uma certa desorganização celular. Talvez isto possa ser explicado por uma má formação da membrana basal, entretanto, para maior elucidação, seriam necessários estudos de microscopia eletrônica para visibilização da estruturação da membrana basal.
Neste estudo, comprovou-se ser possível estabelecer um composto dermo-epidérmico que, com mais testes e algumas modificações, pode no futuro representar uma opção interessante para a utilização como substituto dermo-epidérmico em pacientes queimados com falta de área doadora ou para tratamento de feridas crônicas8,9.
Outra interessante possibilidade de aplicação prática é o seu uso para o teste de novas drogas pela indústria farmacêutica, principalmente as de uso cosmiátrico ou para a melhor compreensão dos fenômenos cicatriciais10. Com o maior rigor das normas de teste de novas drogas em cobaias, a criação de sistemas que simulem a pele humana in vitro passa a ser fundamental para o teste de novas substâncias, avaliando como estas interferem na estratificação epitelial, na renovação celular e na queratinização do epitélio, sem a necessidade da morte de cobaias.
CONCLUSÃO
Comprovou-se a possibilidade de criação de um composto in vitro de substituto dermo-epidérmico constituído por queratinócitos cultivados sobre matrizes colágenas povoadas por fibroblastos humanos cultivados.
Estudos de microscopia ótica permitiram a observação da proliferação das células ao longo do tempo, mostrando características morfológicas nos epitélios cultivados semelhantes às observadas na epiderme humana e a situação de cultivo na interface ar-líquido desencadeou processos de proliferação e diferenciação mais acentuados do que na situação imersa, com maior estratificação.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Tanner Jr JC, Vandeput J, Olley JF. The mesh skin graft. Plast Reconstr Surg. 1964;34:287-92.
2. Gibson T, Medawar PB. Homografts. Mod Trends Plast Surg. 1966;2(1):1-15.
3. Koumans RK, Burke JF. Skin allografts and immunosuppression in the treatment of massive thermal injury. Surgery. 1969;66(1):89-96.
4. Rheinwald JG, Green H. Growth of cultured mammalian cells on secondary glucose sources. Cell. 1974;2(4):287-93.
5. Gallico GC 3rd, O'Connor NE, Compton CC, Kehinde O, Green H. Permanent coverage of large burn wounds with autologous cultured human epithelium. N Engl J Med. 1984;311(7):448-51.
6. Bell E, Ivarsson B, Merrill C. Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro. Proc Natl Acad Sci USA. 1979;76(3):1274-8.
7. Bell E, Ehlich HP, Buttle DJ, Nakatsuji T. Living tissue formed in vitro and accepted as skin-equivalent tissue of full thickness. Science. 1981;211(4486):1052-4.
8. Finesmith TH, Broadley KN, Davidson JM. Fibroblasts from wounds of different stages of repair vary in their ability to contract a collagen gel in response to growth factors. J Cell Physiol. 1990;144(1):99-107.
9. Koch RJ, Goode RL, Simpson GT. Serum-free keloid fibroblast cell culture: an in vitro model for the study of aberrant wound healing. Plast Reconstr Surg. 1997;99(4):1094-8.
10. Kamamoto F, Paggiaro AO, Rodas A, Herson MR, Mathor MB, Ferreira MC. A wound contraction experimental model for studying keloids and wound-healing modulators. Artif Organs. 2003;27(8):701-5.
I. Médico residente do Serviço de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da USP.
II. Pós graduando da disciplina de Cirurgia Plástica da Faculdade de Medicina da USP.
III. Aluno do 6º ano da Faculdade de Medicina da USP.
IV. Dra. em Ciências pelo Instituto de Pesquisas Científicas Nucleares (IPEN).
V. Médica assistente e Dra. em Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da USP.
VI. Professor titular da Faculdade de Medicina da USP.
Correspondência para:
André Oliveira Paggiaro
Rua Alves Guimarães, 455 - apto 152 - Cerqueira César
São Paulo - SP - Brasil
Tel: 0xx11 3062-4590/ 83849970
E-mail: andrepaggiaro@yahoo.com.br
Trabalho realizado no Laboratório de Cirurgia Plástica e Microcirurgia (LIM 4) da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP.
Artigo recebido: 15/03/2007
Artigo aprovado: 22/06/2007
* Trabalho vencedor do Prêmio Victor Spina de 2006 do Congresso Brasileiro de Cirurgia Plástica, realizado em Recife, no período de 12 a 15 de novembro de 2006.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter