

Articles - Year 2019 - Volume 34 - (Suppl.3)
Reação tecidual como causa do linfoma mamário
RESUMO
O linfoma primário de mama se insere como uma entidade rara que representa a minoria tanto dos linfomas não-Hodgkin (menos de 1%), quanto das neoplasias de mama (entre 0,7 e 0,04% da totalidade)1,2,3,4. Destes, 90% são linfomas de celularidade B e, apenas 10% de T, dentre os quais encontra-se o linfoma anaplásico de grandes células (LAGC)1,5. Apesar da crescente relevância desta neoplasia, em raros países os cirurgiões plásticos a incluem como uma possível complicação em seus termos de consentimento pré-operatório6.
Palavras-chave: Implante mamário; Linfoma anaplásico de células grandes; Próteses e implantes; Seroma; Patologia
INTRODUÇÃO
As neoplasias de mama são extremamente frequentes, representando importante causa de mortalidade na população feminina, com uma incidência de aproximadamente 1:8 mulheres. Conforme a OMS (Organização Mundial de Saúde), esta patologia pode ser classificada em forma primária cutânea e forma primária sistêmica; o tipo cutâneo tem apresentação indolente e sobrevida de 90% em 5 anos, enquanto o sistêmico se divide em ALK negativo (60-85% dos sistêmicos, com diagnóstico em idade média de 58 anos e apresentação agressiva, que resulta em sobrevida de aproximadamente 40% em 5 anos) e ALK positivo (diagnóstico com menos de 30 anos em média e sobrevida de 80% em 5 anos)14. As pacientes com doença ALK positivo costumam cursar com apresentação de seroma tardio, enquanto as com ALK negativo apresentam massas sólidas. Os primeiros relatos de linfoma não-Hodgkin com sítio primário em região mamária datam de 1995 e 1997, quando, respectivamente, Duvic, et al.7, descreveu três casos de linfoma cutâneo de células T em mulheres com implantes mamários; e, Keech e Creech, em 19978, relataram a existência de linfoma anaplásico de células T próximo a uma prótese salina.
OBJETIVO
O objetivo primário deste trabalho visa estudar a relação entre linfoma anaplásico e prótese mamária. Ademais, também almejamos, diante da literatura revisada, propor uma conduta de acompanhamento as pacientes submetidas à mamoplastias de aumento, mastopexias e reconstruções mamárias com o uso de próteses siliconadas, além de uma conduta frente aos casos suspeitos.
MÉTODO
Foram realizadas buscas nas bases de dados PubMed, EMBASE e Web of Science. Utilizou-se uma estratégia de busca específica para cada base de dados, porém todas com o mesmo refinamento de período (2012-2017).
Na base PubMed foi utilizada a estratégia de busca: (lymphoma, T-Cell OR lymphoma*[tiab]) AND (breast implants/adverse effects OR silicone gels/adverse effects OR silicones/adverse effects) OR breast AND (implant or implants or prosthes* or endoprosthes*) AND lymphoma*; na Web of Science: (breast AND lymphoma* AND implant* OR prosthes* OR endoprosthes* OR silicon*); e na EMBASE, (breast AND endoprosthesis/exp OR breast AND ‘t cell lymphoma’ OR lymphoma* NOT coronary stent AND [2012-2017]/py).
Excetuaram-se estudos não relacionados a seres humanos.
RESULTADOS
A incidência estimada do LACG gira em torno de 1 a 3 em cada 1.000.000 de mulheres por ano2. Sua prevalência segue incerta, uma vez que a documentação de novos casos apresenta dificuldades devido à sua raridade e ainda pelos muitos casos não relatados ou duplamente publicados6. Nos Estados Unidos, não foi demonstrado excesso de linfoma não-Hodgkin em mama na população com implantes mamários11.
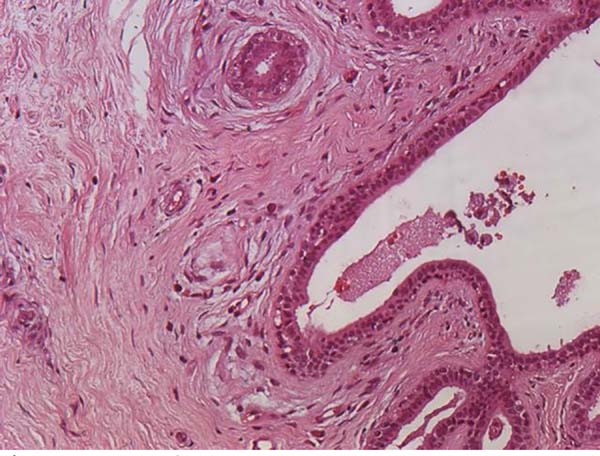
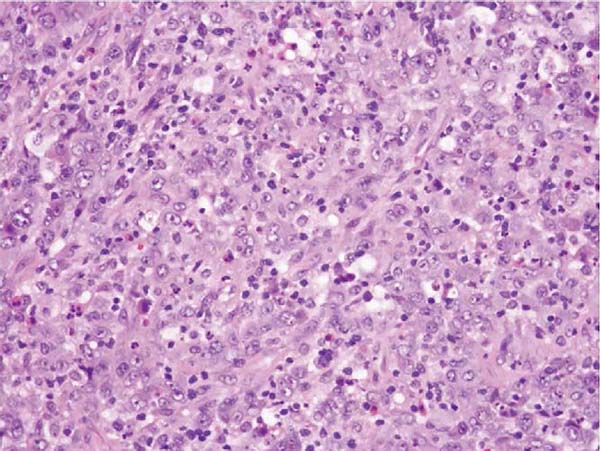
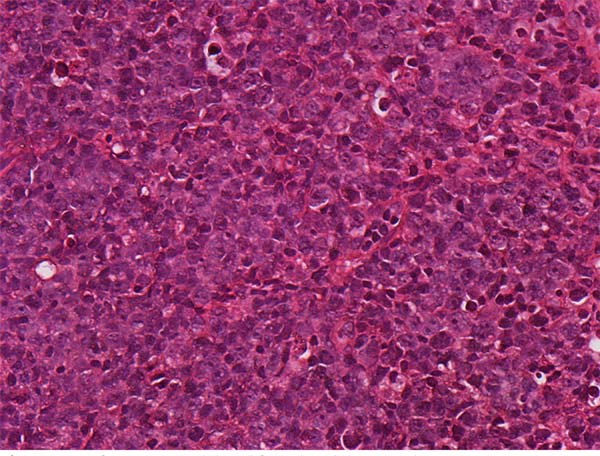
Já em se tratando de fisiopatologia, são discutidas como possíveis causas isoladas ou associadas do LAGC a resposta inflamatória autoimune, o procedimento de texturização das próteses e ainda a formação de um biofilme em seu entorno4,12,17,14,18 (Figuras 1, 2 e 3).
Sabe-se que, tradicionalmente, o risco para o desenvolvimento de neoplasias malignas hematológicas se dá por fatores como genética, idade, sexo e exposição à radiação; mais recentemente, entretanto, fatores como inflamação crônica e infecções foram acrescentados a esta lista14. Neste âmbito, a teoria relativa à inflamação crônica se justifica também por estudos que apontam o produto da degradação do poliuretano (substância presente na superfície das próteses) como agente carcinogênico em ratos18. A superfície da prótese pode influenciar no desenvolvimento tumoral de animais, porém originando sarcomas. Esta informação se faz relevante devido à semelhante origem embriológica mesodérmica dos linfomas e sarcomas20.
Quanto à teoria da formação do biofilme, esta justifica-se por um estudo de Adams, et al., que contabilizou a quantidade de bactérias encontradas na cápsula de próteses mamárias excisadas. Quando se comparou a quantidade de bactérias da prótese associada à neoplasia com a contralateral da mesma paciente, sem evidência de envolvimento neoplásico, (4,7 x 106 versus 7,6 x 105 bactérias por mg de tecido mamário, respectivamente), ficou evidente a discrepância entre as culturas de ambas as mamas, levando a afirmar a possibilidade de envolvimento de biofilme na reação de gênese tumoral17.
Atualmente, a teoria que contempla fatores de todas as anteriores sugere que uma fase linfoproliferativa antecede a fase maligna desta patologia, na qual ocorreria reação inflamatória autoimune induzida por uma infecção, o que resultaria na superexpressão de CD30 e, consequente, recrutamento de células T. Aqui reside a semelhança entre o desenvolvimento de LACG na cutis e no seroma pericapsular16.
Em revisão, Kim B, et al., demonstrou que dentre os casos relatados na literatura até 2011, 48% apresentaram seroma tardio (citologia para células malignas positiva em 79% destes); 24%, massa palpável; 31% massa evidenciada na cirurgia; 21% dor; 14% rubor; e, 7% contratura capsular2. O volume de seroma se situa entre 200 e 1000ml e a efusão drenada é tipicamente fibrinóide13.
De surgimento anos após a colocação da prótese, a apresentação clínica desta patologia é heterogênea - por vezes se dá por erupções cutâneas na região do implante ou por lesões pré-Sézary, provenientes de ruptura da prótese com consequente evolução para a própria síndrome de Sézary. Isso leva a crer que a estimulação antigênica persistente deve estar envolvida com a fisiopatologia desta doença11,32. Andrada demonstrou que exames de imagem de ultrassonografia e ressonância magnética são os mais sensíveis para detectar efusões em torno de implantes. Entretanto, para massas sólidas o PET-CT se mostrou mais sensível20.
A mamografia é efetiva em evidenciar alterações dos implantes mamários, como espessamento e irregularidades da cápsula fibrosa, porém sua sensibilidade tanto para detecção de massas quanto de efusões é inferior aos outros exames de imagem12,16. Em comparação, para o diagnóstico de LAGC - entre ultrassonografia, tomografia computadorizada, mamografia, PET-CT e ressonância magnética - a maior sensibilidade para efusões é alcançada pela ultrassonografia e para massas pela ressonância magnética.
O diagnóstico costuma ser dado pelo exame patológico18. Não raro as efusões são paucibacilares, no que Wu sugere a análise por citometria de fluxo2. O diagnóstico diferencial entre LAGC e processos inflamatórios crônicos benignos não é difícil. Enquanto a citologia de efusões periprotéticas benignas demonstra células inflamatórias, o estado das efusões provenientes de LAGC demonstra células linfóides, grandes, CD30 positivas, altamente atípicas e com expressão CD40 relativamente aumentada, ou, segundo Hoda, aglomerados de histiócitos e raros aglomerados de células pleomórficas com núcleos irregulares e nucléolos proeminentes1,20. Ainda no contexto histológico, um estudo francês evidenciou que o LAGC ALK negativo pode apresentar dois subtipos histológicos: in situ e infiltrativo, sendo o último o mais agressivo e que necessita de terapias adicionais, além da remoção do implante16.
O American Joint Comitee on Cancer propõe o estadiamento desta patologia no formato TNM onde: T representa a extensão do tumor, sendo T1 tumor confinado à efusão ou à camada luminal pericapsular, T2 infiltração superficial capsular, T3 infiltração capsular e T4 infiltração além da cápsula; N representa a invasão linfonodal, sendo N0 a ausência de envolvimento linfonodal, N1 o envolvimento de 1 linfonodo regional e N2 o envolvimento de múltiplos linfonodos locais; e M representa a existência de metástase, sendo M0 a ausência de metástase e M1 a presença em qualquer sítio15,13.
Até a data atual, não há consenso com relação ao tratamento do LAGC. Dentre as opções recomendadas estão a excisão cirúrgica completa sem adjuvante; a radioterapia; quimioterapia (CD30-alvo); e a quimioterapia neoadjuvante seguida de excisão cirúrgica. O prognóstico é mais favorável naquelas que não apresentavam massa palpável; nestes casos, Miranda, et al. 10, sugere que o tratamento conservador, representado pela capsulectomia total, seria o mais adequado. Já as pacientes com tumor ou massa associada são candidatas a remoção da prótese, capsulectomia total e associação com alguma terapia sistêmica4,18. A remissão parece ocorrer com maior frequência em pacientes com doença restrita à cápsula fibrosa14. Estima-se que 30,6% das pacientes apresentam recorrência, segundo revisão de 58 casos18 e que a sobrevida total seja de 12 anos, segundo revisão de 60 casos5. Felizmente, na minoria dos casos, há apresentação tumoral sólida e, destas, apenas 17% morrem como resultado da doença14.
Um dos parâmetros indispensáveis é a sua inclusão em Termos de Consentimento Livre e Esclarecido. Nestes, idealmente, não apenas a existência do seroma e a possibilidade de neoplasia como complicações tardias do procedimento deveriam ser incluídas, mas também seus principais sinais e sintomas, de forma a promover maiores chances de diagnóstico precoce10,18. A ciência da paciente aos riscos que está submetida e à possibilidade de futuras complicações e gastos com exames e tratamento é um direito seu e, portanto, não deveria ser encoberta11. Surpreendentemente, a inclusão do LAGC nos termos de consentimento ocorre sabidamente de forma majoritária em apenas 3 países - França, Austrália e Alemanha -, sendo este último o país que alcança o maior índice de inclusão, com 77,8%6.
DISCUSSÃO
Acreditamos na necessidade de adaptação dos termos de consentimento aplicados às pacientes no momento pré-operatório, mencionando a ocorrência rara desta patologia. Ademais, a redução dos riscos de infecção transoperatória e o acompanhamento da paciente submetida à colocação de próteses mamárias também se mostram claramente valiosos.
Na tentativa da redução da incidência de biofilme, deve-se ter em mente a crescente virulência dos microrganismos, o que justifica maior atenção à profilaxia antibiótica e medidas de cuidado especial no momento cirúrgico. Dentre as recomendações propostas, destacamos a realização de hemostasia minuciosa; a troca de luvas ao manipular a prótese; o uso de luvas sem talco; o fechamento da incisão em camadas; a redução do uso de drenos; o uso de aspirador dentro da loja, em detrimento ao uso de compressas16.
Para um apropriado seguimento das pacientes em uso de próteses mamárias as recomendações são claras quanto a realização de exame físico bimanual anual de mama e exame de imagem - este preferencialmente bi ou trianual, a ser realizado com ultrassonografia. Em casos de seroma tardio, deve-se considerar a suspeita de LACG e realizar punção aspirativa com pesquisa citológica, além de imunohistoquímica para ALK e CD30, a fim de definir prognóstico em caso de positividade para LACG.
De forma a colaborar com o levantamento de dados em relação à origem, ao melhor tratamento e à verdadeira incidência do LAGC, os autores concordam com a proposição do FDA que orienta a notificação ou o relato, na comunidade científica, de todos os casos.
CONCLUSÃO
Enquanto os cirurgiões plásticos aguardam respostas definitivas, é imprescindível que se tome conhecimento de todos os dados possíveis e que sejam aplicados os melhores métodos para seu diagnóstico e tratamento. As recomendações da ASAPS e ISAPS incluem rastreio ultrassonográfico a cada 3 anos em todas as pacientes submetidas a implantes mamários e rastreio por ressonância magnética apenas nos casos suspeitos.
Os autores se posicionam a favor da adequação dos Termos de Consentimento Livre e Esclarecido de forma a alertar a população que deseja realizar aumento mamário, além de consultas anuais para revisão das próteses por exame físico e de orientações sobre a busca imediata de atendimento médico em caso de seroma, e rastreio por ultrassonografia e ressonância magnética em casos suspeitos.
REFERÊNCIAS
1. Chai SM, Kavangh S, Ooi SS, Sterrett GF, Cull G, Plunkett M, Amanuel B, et al. Anaplastic large-cell lymphoma associated with breast implants: a unique entity within the spectrum of peri-implant effusions. Diagn Cytopathol. 2014 Nov;42(11):929-38. PMID: 24687769 DOI: https://doi.org/10.1002/dc.23152
2. Kim B, Roth C, Chung KC, Young VL, van Busum K, Schnyer C, et al. Anaplastic large cell lymphoma and breast implants: a systematic review. Plast Reconstr Surg. 2011 Jun;127(6):2141-50. PMID: 21358562 DOI: https://doi.org/10.1097/PRS.0b013e3182172418
3. Olack B, Gupta R, Brooks GS. Anaplastic large cell lymphoma arising in a saline breast implant capsule after tissue expander breast reconstruction. Ann Plast Surg. 2007 Jul;59(1):56-57. DOI: https://doi.org/10.1097/SAP.0b013e31804d442e
4. Brody GS, Deapen D, Taylor CR, Pinter-Brown L, House-Lightner SR, Andersen JS, et al. Anaplastic large cell lymphoma occurring in women with breast implants: analysis of 173 cases. Plast Reconstr Surg. 2015 Mar;135(3):695-705. PMID: 25490535 DOI: https://doi.org/10.1097/PRS.0000000000001033
5. Singh E, Frost E, Morris EJ, Raza S. Anaplastic lymphoma masquerading as breast abscess in a patient with silicone implants. Breast J. 2013 Sep/Oct;19(5):543-5. DOI: https://doi.org/10.1111/tbj.12161
6. Pittman TA, Fan KL, Rudolph MA. Anaplastic large cell lymphoma: emerging consent and management patterns among American and International board certificated plastic surgeons. Plast Reconstr Surg. 2016 Nov;138(5):811e-818e. DOI: https://doi.org/10.1097/PRS.0000000000002622
7. Duvic M, Moore D, Menter A, Vonderheid EC. Cutaneous T-cell lymphoma n association with silicone breast implants. J Am Acad Dermatol. 1995 Jun;32(6):939-42. DOI: https://doi.org/10.1016/0190-9622(95)91328-9
8. Keech JA, Creech BJ. Anaplastic T-cell lymphoma in proximity to a saline-filled breast implant. Plast Reconstr Surg. 1997 Aug;100(2):554-5. PMID: 9252643 DOI: https://doi.org/10.1097/00006534-199708000-00065
9. U.S. Food and Drug Administration. Anaplastic Large Cell Lymphoma (ALCL) in Women With Breast Implants: Preliminary FDA Findings and Analyses. Washington, DC: U.S. Department of Health and Human Services; 2011.
10. Clemens MW, Miranda RN, Butler CE. Breast implant informed consentiment should include the risk of anaplastic large cell lymphoma. Plast Reconstr Surg. 2016 Apr;137(4):1117-22. PMID: 27018666 DOI: https://doi.org/10.1097/01.prs.0000481103.45976.b1
11. Brinton LA. The relationship of silicone breast implants and cancer at other sites. Plast Reconstr Surg. 2007 Dec;120(7 Suppl 1):94S-102S. DOI: https://doi.org/10.1097/01.prs.0000286573.72187.6e
12. Brody GS. The Case against Biofilm as The Primary Initiator of Breast Implant-Associated Anaplastic Large Cell Lymphoma. Plast Reconstr Surg. 2016 Apr;137(4):766e-7e. DOI: https://doi.org/10.1097/01.prs.0000480003.80422.03
13. Swanson E. Textured breast implants, anaplastic large-cell lymphoma (alcl), and conflict of interest. Plast Reconstr Surg. 2017 Fev;139(2):558e-9e. DOI: https://doi.org/10.1097/PRS.0000000000002966
14. Bizjak M, Selmi C, Praprotnik S, Bruck O, Perricone C, Ehrenfeld M, et al. Silicone implants and lymphoma: the role of inflammation. J Autoimmun. 2015 Dec;65:64-73. PMID: 26330346 DOI: https://doi.org/10.1016/j.jaut.2015.08.009
15. Clemens MW, Medeiros LJ, Butler CE, Hunt KK, Fanale MA, Horwitz S, et al. Complete surgical excision is essential for the management of patients with breast implant-associated anaplastic large-cell lymphoma. J Clin Oncol. 2016 Jan;34(2):160-8. PMID: 26628470 DOI: https://doi.org/10.1200/JCO.2015.63.3412
16. Laurent C, Delas A, Gaulard P, Haioun C, Moreau A, Xerri L, et al. Breast implant associated anaplastic large cell lymphoma: two distinct clinicopathological variants with different outcomes. Ann Oncol. 2016 Feb;27(2):306-14. DOI: https://doi.org/10.1093/annonc/mdv575
17. Adams Junior WP. Discussion: bacterial biofilm infection detected in breast implant-associated anaplastic cell lymphoma. Plast Reconstr Surg. 2016 Jun;137(6):1670-2. DOI: https://doi.org/10.1097/PRS.0000000000002170
18. Hart AM, Lechowicz MJ, Peters KK, Holden J, Carlson GW. Breast implant-associated anaplastic large cell lymphoma: report of 2 cases and review of the literature. Aesthet Surg J. 2014 Aug;34(6):884-94. PMID: 24938778 DOI: https://doi.org/10.1177/1090820X14539503
19. Montandon RE. Estudo de complicações em próteses mamárias: avaliação de 546 casos em oito anos. Rev Bras Cir Plast. 2014;29(3):352-60.
20. Deva AK, Adams Junior WP, Vickery K. The role of bacterial biofilms in device-associated infection. Plast Reconstr Surg. 2013 Nov;132(5):1319-28. DOI: https://doi.org/10.1097/PRS.0b013e3182a3c105
1. Hospital São Lucas da Pontifícia Universidade
Católica do Rio Grande do Sul, Porto Alegre, Brasil.
2. Sociedade Brasileira de Cirurgia Plástica,
Brasil.
Endereço Autor: Marcelo Lopes Dias Kolling, Avenida Alberto Bins 456 Apto.21, Centro histórico, Porto Alegre, RS, Brasil. CEP 90030-140. E-mail: marcelokolling91@gmail.com





 Read in Portuguese
Read in Portuguese
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter