

Original Article - Year 2009 - Volume 24 -
In vitro study of effects of calcium channel blocker (verapamil) on biosyntheses and contraction of the extracellular matrix
Estudo in vitro dos efeitos do bloqueador do canal de cálcio (verapamil) sobre a biossíntese e contração da matriz extracelular
ABSTRACT
Background: The appropriate formation of the granulation tissue depends on the balance between the biosyntheses and the degradation of the extracellular matrix (EM). The excessive synthesis of collagen and the deficient degradation of the EM might cause dermal lesions such as keloids and hypertrophic scars. Methods: In this study we used an experimental model where collagen gels populated by dermal human fibroblast underwent progressive contraction. Fluorescence preparations were studied by confocal microscopy. Collagenase activity (MMP-I) was determined in conditioned medium from fibroblasts using immunoblot. Results: This study showed a greater contraction of the gels populated with control fibroblasts per the time studied in relation to the gels populated with fibroblasts treated with verapamil. Perhaps this higher contracting ability is involved with actin organization and levels of cytosolic calcium. We also observed that verapamil increase the secretion of MMP-I. Conclusion: We conclude that cellular calcium metabolism appears to regulate EM production and contraction and those hypertrophic disorders of wound healing (keloids and hypertrophic scars) may respond to therapy with calcium antagonist drugs (verapamil).
Keywords: Verapamil. Fibroblasts. Collagen. Extracellular matrix.
RESUMO
Introdução: A adequada formação do tecido de granulação depende do equilíbrio entre a biossíntese e a degradação da matriz extracelular (MEC). A síntese excessiva de colágeno e a deficiente remodelação da MEC podem induzir o aparecimento de lesões dérmicas tipo quelóides e cicatrizes hipertróficas. Método: No presente estudo, utilizamos fibroblastos dérmicos humanos povoados em gel de colágeno I, tratados ou não pelo bloqueador de canal de cálcio (verapamil). Uma vez no gel de colágeno, a morfologia tridimensional dos fibroblastos foi analisada por microscopia confocal e em cortes corados por hematoxilina & eosina. A atividade da colagenase (MMP-I) foi determinada por "immunoblot" do meio condicionado. Resultados: Observamos neste estudo maior contração do gel de colágeno povoado por fibroblastos controle, quando comparado ao gel povoado por fibroblastos tratados com verapamil. A maior contração demonstrada pelos fibroblastos controle foi relacionada à reorientação das fibras colágenas, à organização dos filamentos de actina e aos níveis de cálcio citosólico. Observamos, também, que o verapamil aumenta a secreção de colagenase. Conclusão: Concluímos que o verapamil, ao alterar o metabolismo celular do cálcio, exerce influência sobre a contração da MEC e produção de proteases, com consequente efeito sobre o desenvolvimento de afecções cicatriciais, como quelóides e cicatrizes hipertróficas.
Palavras-chave: Verapamil. Fibroblastos. Colágeno. Matriz extracelular.
A ocorrência de uma lesão cutânea desencadeia uma cascata organizada e complexa de eventos celulares e bioquímicos, que resultam em uma ferida cicatrizada. A cicatrização pode ser dividida em três fases distintas, porém superpostas, hemostasia e inflamação, proliferação, maturação e remodelagem1. A adequada formação e contração do tecido de granulação dependem do equilíbrio entre a biossíntese e degradação da matriz extracelular (MEC), além da reorientação das fibras colágenas. A síntese excessiva de colágeno pelos fibroblastos e a deficiente degradação da MEC pela colagenase, assim como alterações no padrão de contração do tecido em cicatrização, podem dar origem a lesões dérmicas tipo quelóides e cicatrizes hipertróficas2.
A morbidade sofrida pelos indivíduos com quelóides e cicatrizes hipertróficas vai de cosmética a sérias limitações do movimento. Muitos métodos têm sido propostos no tratamento dos quelóides e cicatrizes hipertróficas, sem, no entanto, apresentarem resultados expressivos3. Recentemente, o uso intralesional de bloqueadores do canal de cálcio, como o verapamil, tem sido sugerido no tratamento dos distúrbios fibroproliferativos dérmicos humanos4,5. No entanto, o mecanismo de atuação do verapamil no tratamento dessa afecção ainda precisa ser elucidado.
Nesse trabalho estudamos os efeitos do verapamil na morfologia e na secreção de proteases de fibroblastos dérmicos humanos em ambiente tridimensional (gel de colágeno). Os resultados obtidos nesse modelo in vitro podem explicar os efeitos do verapamil na remodelação da MEC e na contração das feridas, processos estes diretamente envolvidos na gênese dos quelóides e das cicatrizes hipertróficas.
MÉTODO
Cultura primária e polimerização do gel de colágeno povoado por fibroblastos
Foram realizadas culturas primárias de curta duração de fibroblastos dérmicos humanos (explantes)6. Posteriormente, em condições apropriadas, 400.000 fibroblastos / 400 µl PBSA 1x, foram incubados com 100 µl PBSA 10x, 100 µl NaOH 0,1M e 400 µl solução de colágeno tipo I, por 12 horas. Uma vez polimerizado o gel, acrescentou-se 1 mL de DMEM, com e sem a adição de 50 µM de verapamil, por 48 horas, criando-se dois grupos de estudo, controle e tratado7.
Avaliação macroscópica da contração do gel de colágeno
O gel de colágeno foi fotografado com uma câmera digital (Sony Cybershot P32, 7,2 Megapixels, Tokyo, Japan) 12, 24, 36 e 48 horas após a polimerização do gel de colágeno, a fim de acompanhar a evolução da contração do gel. A área do gel foi calculada utilizando-se o software de domínio público "UTHSCSA Image Tool for Windows versão 3.0".
Análise dos fibroblastos povoados em gel de colágeno por hematoxilina-eosina (HE)
Fibroblastos controles e tratados, povoados em gel de colágeno, foram desidratados em concentrações crescentes de etanol (50%, 70%, 90%, 96% e 100%), em solução de etanol/xilol (1:1) e, a seguir, diafanizados em xilol (2x), sendo, posteriormente, incluídos em parafina. Após a realização dos cortes, as amostras foram desparafinizadas com xilol e hidratadas com concentrações decrescentes de etanol, sendo, então, coradas com hematoxilina e eosina.
Avaliação tridimensional do padrão de organização dos filamentos de actina dos fibroblastos em gel de colágeno
O gel de colágeno tipo I foi utilizado para estudar a morfologia tridimensional dos fibroblastos e o padrão de organização dos filamentos de actina. Após a polimerização do gel, os fibroblastos foram incubados com 4% de Rodamina-Faloidina (Sigma, Missouri, USA), 0,5% de Triton X-100, 200 µg/mL de Rnase e 1 µM Sytox green (Invitrogen) e analisados ao microscópio confocal de varredura a laser LSM 510 (Carl Zeiss Oberkochen, Germany). Os demais elementos do citoesqueleto e os contatos focais foram avaliados em fibroblastos cultivados em monocamada por meio da incubação com anticorpos anti-tubulina, anti-vimentina (1:100 e 1:200) (Sigma) e anti-vinculina (1:50) (Sigma), primários e secundários anti-mouse conjugados aos fluocromos FITC ou TRITC (1:100) (Sigma).
"Immunoblot"
Meio sem adição de soro foi acrescentado aos fibroblastos povoados em gel de colágeno. Depois de 48 horas, o meio condicionado, contendo o produto de secreção dessas células, foi recolhido, precipitado em etanol e submetido a eletroforese pelo método SDS-PAGE. Em seguida, as proteínas foram transferidas para membranas de nitrocelulose (Amershan), as quais foram incubadas com anticorpos anti-MMP-I (policlonal de coelho, Chemicon) e anticorpos secundários anticoelho conjugados a HRP. O protocolo de quimioluminescência (ECL kit, Amersham) foi utilizado para revelar a reação em filme radiográfico.
Análise estatística
O teste t de Student foi utilizado para avaliação da diferença entre dois grupos e o de ANOVA para diferenças entre três ou mais. O software utilizado para a análise foi o Graphpad Prism (GraphPad Software, Inc., San Diego, CA, USA).
Considerações éticas
O presente estudo foi desenvolvido de acordo com a resolução Nº 196/1996 do Conselho Brasileiro de Saúde, tendo sido aprovado por comitê de ética (04/2003, protocolo Nº 437). O pré-requisito para participação no estudo está baseado no entendimento da proposta do trabalho e na assinatura de consentimento informado.
RESULTADOS
No presente estudo, o gel de colágeno povoado por fibroblastos controles apresentou contração progressiva, durante o intervalo de tempo estudado (48h), duas vezes superior à apresentada pelo gel povoado por fibroblastos tratados com 50 µM de verapamil. Os valores relativos à área dos géis e o perfil da contração podem ser observados nas Figuras 1 e 2.

Figura 1 - Perfil da contração progressiva de géis de colágeno I povoados por fibroblastos controles e fibroblastos tratados com verapamil. Nota-se a contração mais importante dos géis povoados por fibroblastos controles, resultando em um gel, ao final das 48 horas de observação, com uma área cerca de 50% menor do que a do gel povoado por fibroblastos tratados.
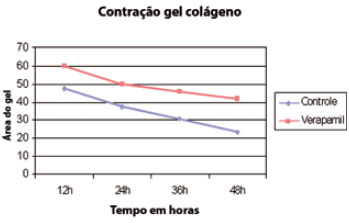
Figura 2 - Gráfico representando a contração do gel de colágeno povoado por fibroblastos controles e tratados durante 48 horas (p < 0,0001).
Fibroblastos cultivados em monocamadas apresentam-se como células alongadas, fusiformes e com numerosas expansões citoplasmáticas, tendo os filamentos de actina dispostos paralelamente ao longo do maior eixo da célula, como fibras de estresse5. Ao serem corados por HE e analisados ao microscópio (AxioVision Zeiss), os fibroblastos povoados em gel de colágeno do grupo controle apresentaram morfologia variando entre alongada e arredondada (Figuras 3A, 3B, 3C e 3D), ao passo que os fibroblastos do grupo tratado mostraram-se, predominantemente, arredondados (Figuras 3E, 3F, 3G e 3H). Quando os fibroblastos tiveram os filamentos de actina marcados por rodamina-faloidina, as células do grupo controle mostraram fluorescência regularmente distribuída, enquanto que as células do grupo tratado apresentaram um reforço da coloração na periferia, junto ao córtex celular, com a região perinuclear da célula mais fracamente corada (Figura 4).
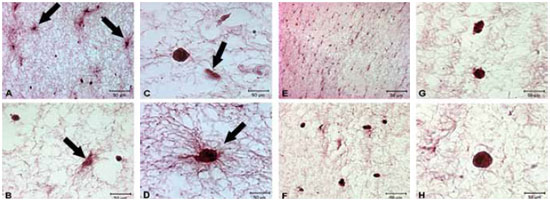
Figura 3 - Fotomicrografias obtidas ao microscópio de luz (AxioVision Zeiss) mostrando fibroblastos controles e tratados, povoados em gel de colágeno, corados por HE. Nota-se no grupo controle a presença de células de morfologia fusiforme e arredondadas (A, B, C e D), enquanto que, as células do grupo tratado apresentam morfologia predominantemente arredondada. (E, F, G e H). Nota-se, ainda, no grupo controle, aumento proximal na densidade de fibrilas colágenas, imediatamente ao redor dos fibroblastos (setas).
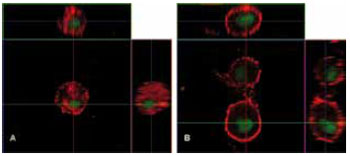
Figura 4 - Imagem obtida ao microscópio confocal de varredura a laser, em corte ortogonal, mostrando a morfologia de fibroblastos dérmicos humanos povoados em gel de colágeno tipo I. Observa-se que os fibroblastos controle e tratados apresentam morfologia arredondada e que o fibroblasto controle apresenta marcação para actina mais homogeneamente distribuída (A), enquanto que, nos fibroblastos tratados, nota-se um reforço periférico, com a região perinuclear pouco corada (B).
Após ter sido realizada a análise da influência do verapamil sobre a contração do gel de colágeno, a morfologia dos fibroblastos e organização do citoesqueleto, foi avaliada a ação da referida droga sobre a síntese e secreção da colagenase I ou metaproteinase-I (MMP-I). O "immunoblot" para MMP-I do meio condicionado das culturas de fibroblastos em gel de colágeno foi mais reativo para o grupo de células tratado com o verapamil (Figura 5).
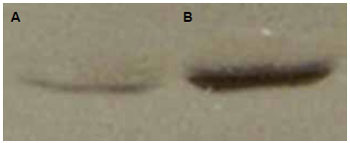
Figura 5 - "Immunoblot" do meio condicionado de células evidenciando a presença de banda mais reativa no grupo de células tratadas com o verapamil (B), em comparação ao grupo controle (A).
DISCUSSÃO
A cicatrização das feridas é um processo de reparo tecidual que envolve uma série de eventos biológicos, estando sujeito a inúmeras falhas em sua evolução. Apesar dos aprimoramentos no diagnóstico e na terapia das feridas, os insucessos na condução do processo cicatricial ainda têm sido grandes, fazendo das afecções cicatriciais um problema de saúde pública, com grande impacto sobre os custos de assistência à saúde.
Culturas em monocamada são comumente utilizadas em estudos científicos por sua simplicidade e praticidade. Várias tentativas têm sido feitas no sentido de estabelecer um sistema de cultura in vitro que mimetize as interações entre células e MEC, como ocorre in vivo8. Há mais de 50 anos, Weiss9 mostrou que fibroblastos cultivados sobre substratos à base de plasma sanguíneo apresentavam variações morfológicas entre bipolar e estrelada, estando estas intimamente relacionadas com o padrão de organização da rede de fibras presente no substrato, enfatizando, assim, a dinâmica das interações entre as células e o ambiente físico10. Bell et al.7 descreveram in vitro um modelo de gel de colágeno que diminuía de diâmetro quando povoado por fibroblastos humanos. Os filamentos de actina, através dos contatos focais (Figura 6), são estruturas envolvidas na adesão entre células e substrato, transmitindo informações de maneira bidirecional entre moléculas extracelulares e o citoplasma11. O verapamil, ao alterar o padrão de organização do citoesqueleto, acaba por exercer influência sobre estas interações, causando mudanças nas propriedades da matriz e nas atividades celulares, estimuladas, normalmente, por alterações locais e globais, como o aumento proximal na densidade de fibrilas colágenas, imediatamente ao redor dos fibroblastos, e o aumento na densidade da matriz, resultando em uma correspondente diminuição do volume da mesma, frequentemente referida como contração. Faude et al.12, em 2000, relataram que a proteína quinase C, uma enzima ativada a partir da hidrólise do fosfatidil inositol, está relacionada à transmissão de uma série de informações enviadas por meio da membrana citoplasmática, dependentes de processos regulados pelo cálcio. A ativação da proteína quinase C estimularia os fibroblastos a contraírem o gel de colágeno. A proteína quinase C, provavelmente, atua também de maneira indireta no controle da síntese de fatores de crescimento como o TGF-β, os quais estimulariam a contração do gel. Goto et al.13, em 1998, demonstraram que reduções na concentração citoplasmática de cálcio podem inibir a endotelina-I, um modulador endógeno da contração de miofibroblastos ou de fibroblast- like cells.
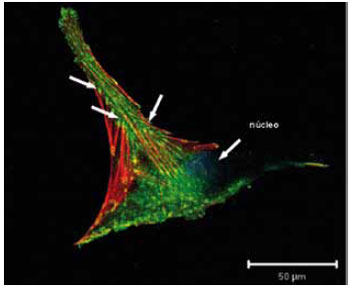
Figura 6 - Imagem obtida ao microscópio confocal de varredura a laser de fibroblasto dérmico humano em cultura, evidenciando os contatos focais (vinculina-verde), os filamentos de actina (vermelho). As setas apontam as regiões de associação entre os dois elementos, junto à membrana plasmática.
As MMPs podem ser expressas e reguladas por numerosos fatores estimuladores ou supressores derivados de integrinas, MEC, estresse celular e mudança na forma da célula14. Aggeler et al.15, em 1984, sugeriram que os bloqueadores do canal de cálcio, ao induzirem alterações morfológicas em fibroblastos em cultura, promoveriam alterações na expressão gênica, estimulando um aumento na síntese de colagenase e reduzindo, concomitantemente, a produção de proteínas da MEC, como a fibronectina e o colágeno.
CONCLUSÃO
O verapamil, ao bloquear o influxo de cálcio nos fibroblastos, altera o padrão de organização dos filamentos de actina e, consequentemente, a morfologia dos fibroblastos, exercendo, assim, importante influência sobre as relações das células com o substrato e sobre a síntese de MMP-I. O verapamil, ao controlar a biossíntese e a contração da MEC, demonstra grande potencial na prevenção e no tratamento dos quelóides e das cicatrizes hipertróficas.
REFERÊNCIAS
1. Witte MB, Barbul A. General principles of wound healing. Surg Clin North Am. 1997;77(3):509-28.
2. Chodorowska G, Rogus'-Skorupska D. Cutaneous wound healing. Ann Univ Mariae Curie Sklodowska. 2004;59(2):403-7.
3. Tredget EE, Nedelec B, Scott PG, Ghahary A. Hypertrophic scars, keloids, and contractures. The cellular and molecular basis for therapy. Surg Clin North Am. 1997;77(3):701-30.
4. Lee RC, Doong H, Jellema AF. The response of burn scars to intralesional verapamil. Report of five cases. Arch Surg. 1994;129(1):107-11.
5. Doong H, Dissanayake S, Gowrishankar TR, LaBarbera MC, Lee RC. The 1996 Lindberg Award. Calcium antagonists alter cell shape and induce procollagenase synthesis in keloid and normal human dermal fibroblasts. J Burn Care Rehabil. 1996;17(6 Pt 1):497-514.
6. Carrel A, Burrows MT. Cultivation of tissues in vitro and its technique. J Exp Med. 1911;13:387-96.
7. Bell E, Ivarsson B, Merrill C. Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potencial in vitro. Proc Natl Acad Sci USA. 1979;76(3):1274-8.
8. Mauch C, Hatamochi A, Scharffetter K, Krieg T. Regulation of collagen synthesis in fibroblasts within a three-dimensional collagen gel. Exp Cell Res. 1988;178(2):493-503.
9. Weiss P. Cellular dynamics. Rev Mod Phys. 1959;31:11-20.
10. Grinnell F. Fibroblast biology in three-dimensional collagen matrices. Trends Cell Biol. 2003;13(5):264-9.
11. Cukierman E, Pankov R, Stevens DR, Yamada KM. Taking cell-matrix adhesions to the third dimension. Science. 2001;294(5547):1708-12.
12. Faude F, Enzmann V, Pöschmann E, Hoffmann S, Wiedemann P. R-(+)-verapamil, S-(-)-verapamil, and racemic verapamil inhibit human retinal pigment epithelial cell contraction. Graefes Arch Clin Exp Ophthalmol. 2000;238(6):537-41.
13. Goto T, Yanaga F, Ohtsuki I. Studies on the endothelin-1-induced contraction of rat granulation tissue pouch mediated by miofibroblasts. Biochim Biophys Acta. 1998;1405(1-3):55-66.
14. Steinleitner A, Lambert H, Kazensky C, Sanchez I, Sueldo C. Reduction of primary postoperative adhesion formation under calcium channel blockade in the rabbit. J Surg Res. 1990;48(1):42-5.
15. Aggeler J, Frisch SM, Werb Z. Changes in cell shape correlate with collagenase gene expression in rabbit synovial fibroblast. J Cell Biol. 1984;98(5):1662-71.
I. Departamento de Biologia Celular e do Desenvolvimento, Instituto de Ciências Biomédicas, Universidade de São Paulo, São Paulo, Brasil.
II. Instituto Brasileiro de Pesquisa e Ensino-IBRAPE, São Paulo, Brasil.
III. Disciplina de Cirurgia Plástica, Faculdade de Medicina, Universidade de São Paulo, São Paulo, Brasil.
Correspondência para:
Ricardo Frota Boggio
Instituto de Ciências Biomédicas, Universidade de São Paulo
Departamento de Biologia Celular e do Desenvolvimento
Av. Prof. Lineu Prestes, 1524, ICB I, sala 306/307
Butantan, São Paulo, SP - Brasil
CEP: 05508-900
Trabalho realizado no Instituto de Ciências Biomédicas, Universidade de São Paulo, Departamento de Biologia Celular e do Desenvolvimento.
Trabalho recebeu menção honrosa no Prêmio Evaldo D'Assumpção/2008.
Artigo recebido: 15/10/2008
Artigo aceito: 12/1/2009


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter