

Original Article - Year 2008 - Volume 23 -
Platelet-rich plasma, platelet-poor plasma and fat grafts use in face liftings: case reports
Utilização de plasma rico em plaquetas, plasma pobre em plaquetas e enxerto de gordura em ritidoplastias: análise de casos clínicos
ABSTRACT
Introduction: Facial rejuvenating surgeries had developed in the last 100 years due to great contribution of some professionals in the whole world. Recently, the use of platelet rich plasma (PRP) and platelet poor plasma (PPP) as adjuvants in rhytidoplasty became an advance in the conduction of these cases. Methods and Results: We present qualitative analysis of clinical cases that evidence a better integration of the fat graft in the face fulfillings with the use of the PRP and better adaptation of the remnants of rhytidoplasty with the concomitant use of the PPP. Conclusion: Clinical findings are concordant with international literature and stimulate us to continue in the development of more refined and safe techniques for the patient's treatment.
Keywords: Rhytidoplasty. Graft survival. Platelet-rich plasma.
RESUMO
Introdução: As cirurgias de rejuvenescimento facial desenvolveram-se nos últimos 100 anos devido à grande colaboração de vários profissionais em todo o mundo. Recentemente, o uso do plasma rico em plaquetas (PRP) e do plasma pobre em plaquetas (PPP) como adjuvantes nas ritidoplastias tornou-se um avanço na condução destes casos. Método e Resultados: Apresentamos análise qualitativa de casos clínicos que evidenciam uma melhor integração da enxertia adiposa nos preenchimentos faciais quando do uso do PRP e melhor adaptação dos retalhos de ritidoplastia com o uso concomitante do PPP. Conclusão: Os achados clínicos são concordantes com a literatura internacional e nos incentivam a prosseguir no desenvolvimento de técnicas cada vez mais apuradas e seguras no tratamento dos pacientes.
Palavras-chave: Ritidoplastia. Sobrevivência de enxerto. Plasma rico em plaquetas.
As primeiras cirurgias de rejuvenescimento facial foram realizadas na transição dos séculos XIX e XX, com as ressecções de fusos cutâneos faciais, seguidas de suturas. A primeira publicação ocorreu em 1907 por Charles Conrad Miller, em seu livro "Cosmetic surgery: the correction of featural imperfections"1. Os descolamentos de pele tornaram-se cada vez mais amplos, propiciando melhores resultados. A partir dos anos 60, as ritidoplastias, enquanto cirurgias para rejuvenescimento facial, passaram a ser amplamente utilizadas. Em 1974, Guerrero-Santos et al.2 divulgaram a técnica de correção das deformidades do pescoço. Em 1976, Mitz e Peyronie3 descreveram o complexo anatômico denominado sistema músculo aponeurótico superficial da face (SMAS). Em 1977, Owsley publicou o primeiro artigo demonstrando o papel do SMAS nas ritidoplastias4,5.
Atualmente, em cirurgia plástica a lipoenxertia é amplamente utilizada. Vários mecanismos para melhorar a integração adiposa estão sendo desenvolvidos e utilizados, tais como técnicas de infiltração, de coleta, manuseios e uso de fatores de crescimento6.
A cola de fibrina foi originalmente descrita em 1970 e é formada por fibrinogênio polimerizado com trombina e cálcio7. Apresentava o inconveniente do alto custo e de necessitar de plasma doador. A cola de fibrina autóloga e o plasma rico em plaquetas (PRP) eliminam esses inconvenientes. O PRP é uma concentração autóloga de plaquetas em um pequeno volume de plasma, com a conseqüente presença de fatores de crescimento liberados por estas plaquetas, que também servem como matriz para a migração epitelial e formação de tecido conectivo8. Em 2001, Man et al.9 descreveram que "quando usado em lipoescultura, a adição de PRP faz com que haja aumento da durabilidade dos adipócitos". O PRP é um grande mediador do processo de cicatrização9.
O PRP tem entre 1.000.000 e 1.500.000 plaquetas por microlitro9,10. É hemocomponente autógeno usado para liberar fatores de crescimento em altas concentrações no local onde se pretende reparar um defeito ou uma lesão tecidual, levando à aceleração do processo cicatricial9. Os fatores de crescimento estimulam principalmente a reepitelização, a angiogênese, a mitose celular, a síntese de colágeno, a quimiotaxia dos neutrófilos, macrófagos e fibroblastos e a produção de linfócitos com a produção de interleucina9-15.
Este estudo tem por objetivo a análise qualitativa de 33 pacientes submetidos a ritidoplastia e lipoenxertia com o uso concomitante do plasma pobre em plaquetas (PPP) e do PRP.
MÉTODO
Todos os procedimentos cirúrgicos foram realizados no Hospital Mater Dei pelo mesmo cirurgião e sua equipe, sob sedação venosa com auxílio de um anestesiologista. Os procedimentos anestesiológicos foram realizados em todas as cirurgias pelo mesmo profissional, com o uso de midazolam, sufentanila e propofol.
Preparo do Plasma Rico em Plaquetas e do Plasma Pobre em Plaquetas
Antes de se submeter ao procedimento cirúrgico, o paciente foi encaminhado ao laboratório do hospital. Procedia-se à coleta de 40mL de sangue total, por meio de punção venosa periférica com o uso de tubos de 4,5mL, carregados a vácuo, em vidro ou polipropileno siliconizado, transparentes, incolores, estéreis e resistentes à centrifugação, com 2,7mL de anticoagulante citrato de sódio a 3,2%.
Os tubos contendo o sangue do paciente foram centrifugados a 1.800 rpm, por 8 minutos. Ocorria, então, a separação dos componentes das séries vermelha, branca e plasma (Figura 1). O material obtido tinha até 6 horas para ser utilizado, mantido em ar ambiente.

Figura 1 - Tubos contendo o sangue do paciente pós-centrifugação. Observar a separação dos componentes das séries vermelha, branca e plasma
Durante o procedimento cirúrgico, o PPP foi preparado pela aspiração do plasma sobrenadante, de coloração amarelo citrina, com seringa de 20mL e cateter de punção venosa calibre 22G. Cinco minutos antes da aplicação do PPP no paciente, procedia-se à ativação pela adição de gluconato de cálcio a 10% na proporção de 1:10 (Figura 2). Este tubo era mantido imerso por 4 minutos em soro fisiológico à temperatura de 40º C e, então, aplicado na área de descolamento dos retalhos, na face do paciente10,16.
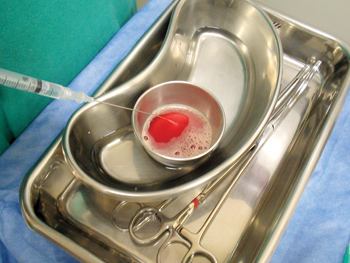
Figura 2 - Preparo do PPP por meio da aspiração do plasma sobrenadante, de coloração amarelo citrina e ativação pela adição de gluconato de cálcio a 10% na proporção de 1:10
Também durante a cirurgia, o PRP foi preparado seguindo-se à aspiração da camada intermediária, entre o concentrado de hemácias e o plasma sobrenadante, com seringa de 5mL e cateter de punção venosa calibre 22G. Cinco minutos antes da aplicação do PRP no paciente, procedia-se à ativação do mesmo com a adição de gluconato de cálcio a 10%, na proporção de 1:10.
Apesar do preparo do PRP e do PPP ser relativamente simples, o processo apresenta detalhes que são de fundamental importância para obtenção de seus efeitos. O processo de centrifugação deve ser totalmente estéril e preciso, para obter altas concentrações de plaquetas viáveis e não lesionadas, a fim de evitar a secreção dos fatores de crescimento antes da implantação do preparado na ferida cirúrgica.
Técnica Cirúrgica
A cirurgia de ritidoplastia foi realizada após a infiltração da pele e subcutâneo da face com solução composta de 120mL de ringer lactato, 40mL de lidocaína a 2% sem vasoconstritor e 4mL de adrenalina a 1:400.000. A pele foi incisada nas regiões pré-tragal e retroauricular. O descolamento do plano anatômico foi realizado inicialmente com cânulas de lipoaspiração número 2, com pontas ogivais e planas, seguido por dissecção com tesoura de Íris. Foi realizada nova incisão nas linhas naturais pré-auriculares, desde 2cm acima da linha de inserção auricular até a região do implante capilar retroauricular. O descolamento foi completado pela tesoura, avançando-se 2cm a 3cm de uma linha que vai da proeminência malar ao ângulo da mandíbula. Hemostasia rigorosa foi realizada, com a cauterização de pequenos vasos e ligadura dos maiores se necessário.
Na linha que vai da proeminência malar ao ângulo da mandíbula foi realizada plicatura do SMAS segundo a técnica descrita por Baker e Stuzin17, com pontos simples, invertidos e fios absorvíveis 5.0 de poliglecaprone 25 (Monocryl®). Após tração no sentido cranial, o excesso de tecido dermogorduroso foi ressecado e o retalho reposicionado com o mínimo de tensão na linha de sutura.
A região submentoniana foi tratada por lipoaspiração segundo a técnica tumescente, através de incisão horizontal a 1 cm da borda mentual e dissecção até a região cervical. Por esta incisão, o tratamento da diástase das bandas musculares platismais foi realizado, quando indicado. As bordas musculares foram identificadas e o excesso de tecido ressecado. A plicatura foi feita por pontos simples invertidos com fios absorvíveis 5.0 de poliglecaprone 25 (Monocryl®).
Neste tempo cirúrgico, o PRP foi coletado nas camadas intermediárias dos tubos de ensaio com o uso de pipetas com ponteiras estéreis. O restante do plasma, encontrado na região superior do tubo (PPP), foi acondicionado em outro tubo de ensaio esterilizado, onde foi aquecido e ativado pela adição de gluconato de cálcio.
Momentos antes da conclusão da sutura da pele, o preparado ativo de PPP foi espalhado sobre toda a área cruenta com seringa e cateter plástico de calibre 22G (Figura 3). As regiões interessadas incluíam o terço médio da face, as regiões retroauriculares e cervical, inclusive a parede dos retalhos, e foram pressionadas por um período de 3 minutos.
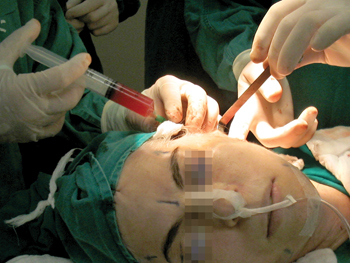
Figura 3 - Preparado ativo de PPP espalhado sobre toda a área cruenta com seringa e cateter plástico de calibre 22G
O PRP não foi utilizado na área descolada devido ao aparecimento de equimoses após sua aplicação. Isto se devia à presença de hemácias pipetadas em conjunto com o plasma, denominadas névoa.
A lipoenxertia foi realizada com gordura coletada por lipoaspiração da face interna de joelhos, segundo a técnica tumescente. A área doadora foi preparada com infiltração de ringer lactato associado à lidocaína a 0,5% e adrenalina na proporção de 1:500.000. A gordura coletada foi lavada com solução de ringer lactato para eliminar sangue e restos celulares. Após suaves movimentos na lavagem do tecido coletado, este foi decantado. Ocorria a separação dos vários elementos da suspensão, que passava a apresentar três camadas. A camada superior apresentava adipócitos rotos, a inferior foi composta por solução de lavagem e elementos sanguíneos, e a camada intermediária foi formada por células adiposas íntegras.
As células adiposas íntegras foram adicionadas ao PRP, ativado com o uso de gluconato de cálcio e aquecido por imersão em soro fisiológico a 40ºC, por 4 minutos. O preparado foi então enxertado no sulco nasogeniano com seringas de 1mL e cânulas de ponta romba com 1 mm de diâmetro, segundo a técnica da retroinjeção.
RESULTADOS
Os pacientes foram avaliados clinicamente antes e após o procedimento cirúrgico. Os dados pré-operatórios incluíam idade, gênero, presença de sobrepeso, tabagismo, uso de terapia de reposição hormonal e co-morbidades preexistentes, tais como hipertensão arterial e diabetes melito. O uso de medicamentos também foi anotado (Tabelas 1 a 3).
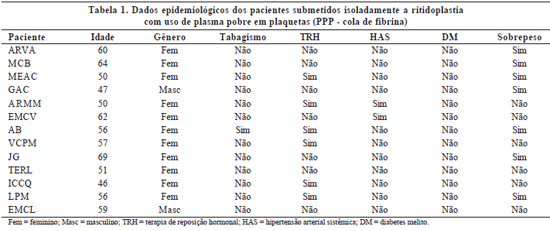
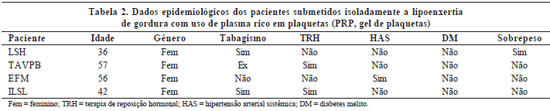
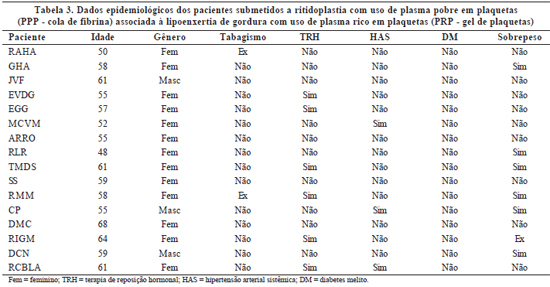
A avaliação dos resultados pós-operatórios incluía a ocorrência de deiscência de ferida cirúrgica, epiteliose tecidual, hematoma, equimose, grau de edema e formação de aderências. O edema foi classificado em:
- 0 - quando ausente;
- + - quando localizado apenas em uma área facial;
- ++ - quando localizado em duas áreas faciais;
- +++ - quando localizado em três áreas faciais (Tabelas 4 a 6).
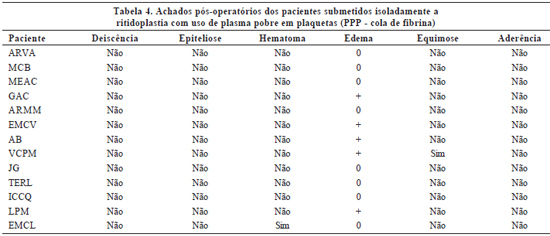
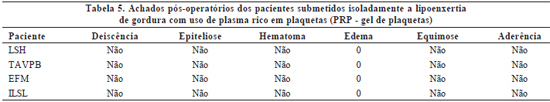
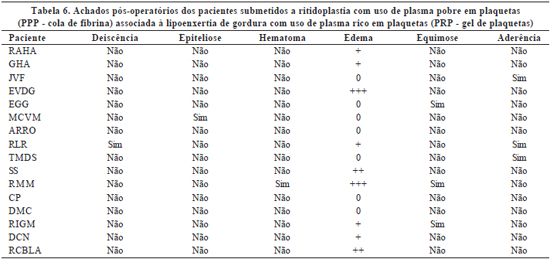
A ocorrência de eventos adversos pós-operatórios nos pacientes submetidos apenas a ritidoplastia com o uso de PPP foi mínima, sendo mais freqüente o edema leve em apenas uma região facial. Os pacientes submetidos a ritidoplastia com uso de PPP associada à lipoenxertia com uso do PRP apresentaram incidência pequena de intercorrências, mas superior à ritidoplastia com uso de PPP isolada. A realização isolada de lipoenxertia associada ao PRP não levou a nenhum evento adverso no pós-operatório.
É relevante ressaltar que a grande maioria dos eventos adversos pós-operatórios foi de grau leve e com boa resolutibilidade com tratamento conservador. Apenas dois pacientes necessitaram intervenção invasiva, sendo um submetido a punção para drenagem de coleção de seroma e outro, a debridamento superficial em pequena área de sofrimento retroauricular à esquerda, de cerca de 1cm. Outro paciente evoluiu com deiscência de pequena área de sutura, com subseqüente aderência.
DISCUSSÃO
As plaquetas atuam no processo de hemostasia, cicatrização de feridas e reepitelização. Elas liberam diversos fatores de crescimento que estimulam a angiogênese, promovendo crescimento vascular e proliferação de fibroblastos, que, por sua vez, proporcionam aumento na síntese de colágeno.
O PRP é fonte autóloga de fatores de crescimento9-15. Foram identificados pelo menos sete diferentes fatores secretados ativamente pelas plaquetas e que atuam na fase inicial da cicatrização. São eles os três isômeros do fator de crescimento plaquetário (PDGFaa, PDGFbb e PDGFab), dois fatores de crescimento transformadores (TGFb1 e TGFb2), o fator de crescimento endotelial vascular (VEGF) e o fator de crescimento epitelial (EGF)9-15.
Os TGFs ativam os fibroblastos para a formação de protocolágeno, que resulta na deposição de colágeno e cicatrização da ferida. Os PDGFs, associados ou não aos TGFs, aumentam a vascularização tissular, promovem a proliferação de fibroblastos, aumentam a quantidade de colágeno, estimulam a produção de tecido de granulação e melhoram a osteogênese. O VEGF estimula a angiogênese, a mitogênese e a permeabilidade vascular, enquanto o EGF induz o crescimento de tecido epitelial e promove também a angiogênese9-15.
Estas substâncias tornam a cicatrização mais rápida e eficiente, favorecendo a integração de enxertos, sejam eles ósseos, cutâneos, cartilaginosos ou de células de gordura9-15.
Man et al.9, em estudo focalizado em cirurgias cosméticas, evidenciaram que o sangramento capilar após as dissecções cessou três minutos após a aplicação do gel de plaquetas e da cola de fibrina. Concluíram, ainda, que o uso do gel de plaquetas acelerou a cicatrização, reduziu o tempo de cirurgia, eliminou a necessidade do uso de drenos, reduziu o uso de curativos de pressão e diminuiu a dor no pós-operatório9.
Estas propriedades tornam o PRP e o PPP produtos com grande potencial para o uso em ritidoplastia. Nossos resultados corroboram os dados da literatura e ressaltam o benefício do uso do PPP em cirurgias com descolamento de retalhos. Este uso nos proporcionou resultados livres de intercorrências graves no pós-operatório. Os achados com o uso do PRP na lipoenxertia em face também comprovam os resultados internacionais, proporcionando bom índice de integração do enxerto gorduroso, com intercorrências pós-operatórias mínimas6.
CONCLUSÃO
O uso do PPP ou cola de fibrina autóloga em ritidoplastia com descolamento de retalho proporciona resultados pós-operatórios satisfatórios, com bom retorno às atividades diárias, menos edema, poucas equimoses e livre de intercorrências importantes.
O uso do PRP associado à lipoenxertia de face proporciona melhor integração do enxerto com intercorrências pós-operatórias mínimas, compatíveis com o esperado para o procedimento.
REFERÊNCIAS
1. Miller CC, Miller F. Folds, bags and wrinkles of the skin about the eyes and their eradication by simple surgical methods. By Charles C. Miller and Florence Miller, 1907. Aesthetic Plast Surg. 1988;12(3):157-8.
2. Guerrero-Santos J, Espaillat L, Morales F. Muscular lift in cervical rhytidoplasty. Plast Reconstr Surg. 1974;54(2):127-30.
3. Mitz V, Peyronie M. The superficial musculo-aponeurotic system (SMAS) in the parotid and cheek area. Plast Reconstr Surg. 1976;58(1):80-8.
4. Owsley JQ Jr. Platysma-fascial rhytidectomy: a preliminary report. Plast Reconstr Surg. 1977;60(6):843-50.
5. Baker DC. Lateral SMASectomy. Plast Reconstr Surg. 1997;100(2):509-13.
6. Brown SA, Appelt EA, Lipschitz A, Sorokin ES, Rohrich RJ. Platelet gel sealant use in rhytidectomy. Plast Reconstr Surg. 2006;118(4):1019-25.
7. Kovács AB, Somogyvári K, Gerendás M, Gráf Z. Experimental study of a fibrin containing wound powder. Acta Vet Acad Sci Hung. 1970;20(2):195-206.
8. Marx RE, Carlson ER, Eichstaedt RM, Schimmele SR, Strauss JE, Georgeff KR. Platelet-rich plasma: growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;85(6):638-46.
9. Man D, Plosker H, Winland-Brown JE. The use of autologous platelet-rich plasma (platelet gel) and autologous platelet-poor plasma (fibrin glue) in cosmetic surgery. Plast Reconstr Surg. 2001;107(1):229-39.
10. Vendramin FS, Franco D, Nogueira CM, Pereira MS, Franco TR. Plasma rico em plaquetas e fatores de crescimento: técnica de preparo e utilização em cirurgia plástica. Rev Col Bras Cir. 2006;33(1):24-8.
11. Dugrillon A, Eichler H, Kern S, Kluter H. Autologous concentrated platelet-rich plasma (cPRP) for local application in bone regeneration. Int Oral Maxillofac Surg. 2002;31(6):615-9.
12. Thorn JJ, Sorensen H, Weis-Fogh U, Andersen M. Autologous fibrin glue with growth factors in reconstructive maxillofacial surgery. Int J Oral Maxillofac Surg. 2004;33(1):95-100.
13. Robson MC, Phillips LG, Thomason A, Altrock BW, Pence PC, Heggers JP, et al. Recombinant human platelet-derived growth factor-BB for the treatment of chronic pressure ulcers. Ann Plast Surg. 1992;29(3):193-201.
14. Herndon DN, Nguyen TT, Gilpin DA. Growth factors: local and systemic. Arch Surg. 1993;128(11):1227-33.
15. Pierce GF, Vande Berg J, Rudolph R, Tarpley J, Mustoe TA. Platelet-derived growth factor-BB and transforming growth factor Beta 1 selectively modulate glycosaminoglycans, collagen and myofibroblasts in excisional wounds. Am J Pathol. 1991;138(3):629-46.
16. Ho CH, Chan IH. The influence of time of storage, temperature of storage, platelet number in platelet-rich plasma, packed cell, mean platelet volume, hemoglobin concentration, age, and sex on platelet aggregation test. Ann Hematol. 1995;71(3):129-33.
17. Baker TJ, Stuzin JM. Personal technique of face lifting. Plast Reconstr Surg. 1997;100(2):502-8.
1. Membro Titular da Sociedade Brasileira de Cirurgia Plástica. Preceptor de Cirurgia Plástica do Centro de Formação e Treinamento em Cirurgia Plástica do Hospital Mater Dei. Membro do corpo clínico do Hospital Mater Dei.
2. Membro Especialista da Sociedade Brasileira de Cirurgia Plástica. Mestre em Cirurgia pela Faculdade de Medicina da Universidade Federal de Minas Gerais. Membro do corpo clínico do Hospital Mater Dei.
3. Membro Associado da Sociedade Brasileira de Cirurgia Plástica. Médico Residente de Terceiro ano do Centro de Formação e Treinamento em Cirurgia Plástica do Hospital Mater Dei. Membro do corpo clínico do Hospital Mater Dei.
Trabalho realizado no Centro de Formação e Treinamento em Cirurgia Plástica do Hospital Mater Dei, Belo Horizonte, MG.
Artigo recebido: 01/04/2008
Artigo aceito: 13/05/2008


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter