

Original Article - Year 2011 - Volume 26 -
Surgical treatment of giant melanocytic nevi
Tratamento cirúrgico do nevo melanocítico gigante
ABSTRACT
Congenital melanocytic nevi are present in approximately 1% of newborns. The lesions classified as small and medium are relatively common, and have low risk of malignant degeneration, however, lesions called giants are rare and have a higher risk of malignancy. This work describes the author's experience in the surgical treatment of giant pigmented nevi.
Keywords: Nevus. Melanoma. Tissue Expansion Devices.
RESUMO
O nevo melanocítico congênito está presente em aproximadamente 1% dos recém nascidos. As lesões classificadas como pequenas e médias são relativamente comuns, e possuem risco de degeneração maligna baixo. Por outro lado, as lesões chamadas de gigantes são raras e possuem maior risco de malignização. Neste trabalho é relatada a experiência do autor, no tratamento cirúrgico dos nevos melanocíticos gigantes.
Palavras-chave: Nevo. Melanoma. Dispositivos para Expansão de Tecidos.
O nevo melanocítico congênito é uma proliferação de ninhos de melanócitos da pele, presente ao nascimento, com incidência de aproximadamente 1% dos recém nascidos1.
Existem vários tipos de classificação, e a mais comumente utilizada se baseia no tamanho do nevo na infância, dividindose em pequeno, médio e gigante. Sendo estabelecido que: pequeno (< 1,5 cm de diâmetro), médio (1,5 cm - 20 cm no maior diâmetro) e gigante (> 20 cm de diâmetro). Podem ainda ser lisos ou elevados, com coloração variando entre o castanho claro e o escuro, uniformes e com bordas definidas, com ou sem pelos (os com pelos são denominados nevos pilosos gigantes)2.
As lesões classificadas como pequenas e médias são relativamente comuns, representam cerca de 1% dos nascimentos1, ao passo que o nevo gigante é uma condição rara, cuja incidência está estimada em 1 para cada 20 mil nascimentos. Está é a classificação adotada neste trabalho, por ser utilizada em trabalhos que estudam o risco de surgimento de melanoma2,3.
A possibilidade de malignização foi inicialmente reconhecida, em 1879, por Jablokoff e Klein4 em grandes lesões melanocíticas. O risco de malignização dos nevos gigantes tem epidemiologia controversa, variando de 2,6% a 8%1, 5% a 12% ou 0% a 42%3,5-10. O fato é que o risco de ocorrência de melanoma é maior do que a população que não apresenta o nevo gigante. Além disso, o melanoma decorrente é grave e ocorre na infância. Um dos autores refere que metade dos casos ocorrem antes dos 3 anos de idade e tem evolução quase sempre letal. O diagnóstico precoce de um melanoma sobre um nevo gigante é mais difícil devido à cor enegrecida das duas lesões. Os sinais de transformação maligna, como o desenvolvimento de um tumor ou ulceração, são tardios e geralmente acompanhados de metástases8,11.
Em 1939, Conway publicou 40 casos, Russel e Reyes, em 1959, fizeram a revisão de 53 casos documentados na literatura mundial e, em 1965, Greenley et al. relataram 56 casos de seu próprio serviço durante os últimos 25 anos4. Cento e cinquenta e um pacientes foram registrados no sistema de saúde da Dinamarca5 e, em 1993, Pitanguy et al.6 publicaram uma série de 150 pacientes.
Muitos tratamentos cirúrgicos e não cirúrgicos foram propostos, dentre os não cirúrgicos encontramos o tratamento expectante, irradiação, crioterapia e laserterapia. Os tratamentos cirúrgicos incluem a ressecção seriada, excisão e cobertura com enxertos, retalhos, expansão tecidual, curetagem, dermoabrasão, excisão tangencial com ou sem enxertia de pele e eletrocoagulação4.
Ainda não existe consenso quanto ao tratamento desta lesão, que pode evoluir e ser letal. As possibilidades de tratamento são de cirurgias repetidas de longo prazo e que podem deixar sequelas se não forem bem planejadas e executadas.
O objetivo deste estudo é relatar a experiência do autor no tratamento do nevo melanocítico gigante (NMG), descrever e analisar o planejamento das técnicas cirúrgicas mais comumente utilizadas.
MÉTODO
Foi realizado um estudo retrospectivo de uma série de casos. Analisaram-se os prontuários de 11 pacientes portadores de nevo melanocítico gigante (NMG), os quais foram submetidos a tratamento cirúrgico pelo autor, no período entre fevereiro de 1997 e julho de 2007. Os pacientes e os familiares assinaram o termo de consentimento informado autorizando o uso do prontuário para a pesquisa científica.
Foram analisados neste estudo: idade, localização do NMG, tipo de procedimento cirúrgico realizado, complicações e resultado de exame anatomopatológico das lesões.
Não existiu nenhum conflito de interesses na escolha do tratamento proposto ou dos materiais utilizados.
Na escolha e planejamento da técnica cirúrgica levou-se em consideração: aspecto do nevo, extensão e localização da lesão, tratamento que evitasse disfunção estético-funcional, idade, possibilidade de emprego de técnica combinada.
Os tratamentos cirúrgicos empregados foram: ressecção parcial intralesional; ressecção com enxertia de pele; ressecção e cobertura com retalho de pele expandido (expansores cutâneos) ou associação das técnicas cirúrgicas citadas anteriormente.
As cirurgias, avaliações e observações pré e pós-operatórias foram realizadas pelo autor.
As cirurgias foram realizadas no mesmo serviço, em centro cirúrgico, com monitorização e sob anestesia geral conduzida pela mesma equipe de anestesiologistas em todos os casos. A técnica operatória seguiu sempre a mesmo preparo: degermação e antissepsia com Clorhexidine® degermante e alcoólico, respectivamente, colocação de campos estéreis, marcação cirúrgica da incisão e realização da cirurgia proposta, em plano cirúrgico previamente estabelecido.
Ressecção parcial intralesional
Foi indicada nos casos de alterações do aspecto clínico dos nevos. Quando o nevo apresentava relevos, nodulações, diferenças de coloração ou qualquer sinal de degeneração que precisasse de estudo histopatológico imediato, a ressecção era realizada. Marcava-se com azul de metileno a maior área passível de ressecção que englobasse as áreas com as nodulações, tendo pelo menos 2 cm de margem de segurança de cada lado. A ressecção foi realizada incluindo derme e tecido subcutâneo profundo até aponeurose. Realizado descolamento amplo, hemostasia e sutura. Foi utilizado dreno aspirativo em todos os casos de ressecção parcial, com exteriorização por contra abertura, no nevo ou em cicatriz próxima. O dreno foi removido em 48 horas. A sutura das feridas foi realizada com polivycril® 3.0 e 4.0., nos planos profundos, e na pele com pontos tipo "simples" com fios de mononylon® 3.0, 4.0 e 5.0.
Ressecção com enxertia de pele
No planejamento e desenvolvimento da técnica cirúrgica em que houve a utilização de enxertos, foi avaliada a necessidade de cobertura cutânea nas áreas que a ressecção intralesional ou a utilização dos expansores poderiam gerar deformação funcional, como pálpebras ou áreas flexoras. Em um caso foi utilizado enxerto em dorso, pela necessidade de avaliação histopatológica de alterações sugestivas de malignização em área maior que a ressecção intralesional pudesse ser eficiente e impossibilidade de uso de expansores no paciente. Foi realizada uma estimativa da extensão da área a ser enxertada e estudadas as possibilidades de área doadora, utilizando a pele mais próxima e semelhante do local de recepção, evitando que a região doadora sofresse grande deformação. Após a retirada da lesão e hemostasia rigorosa, a área cruenta foi desenhada em molde de tecido estéril, para determinar as dimensões de pele necessárias para enxertia. O enxerto de pele foi retirado em sua espessura total, quando utilizado nas pálpebras e nas áreas flexoras. Após ser retirado da área doadora, o enxerto foi preparado com a retirada do tecido subcutâneo ("desengordurado") e colocado em recipiente com solução salina a 0,9%. O enxerto foi posicionado sobre a área cruenta e fixado nos pontos cardinais com fio de mononylon® 4.0, e com sutura contínua com fio mononylon® 6.0 ao seu redor. As extremidades do fio suturado nos pontos cardinais foram atadas entre si, fixando o curativo de gaze estéril e algodão sobre o enxerto, com o intuito de diminuir o espaço morto entre a área receptora e o tecido enxertado. Esse curativo foi retirado no 5º dia de pós-operatório, com o cuidado para o algodão soltar facilmente sem mover o enxerto.
Ressecção e cobertura com retalho de pele expandido
No planejamento e desenvolvimento da técnica cirúrgica que utilizou expansores, foram avaliadas: idade do paciente e sua colaboração, forma e quantidade dos expansores, local de sua colocação e posicionamento das válvulas, prevendo a posterior rotação dos retalhos de acordo com a demanda tecidual de cada caso. Tentamos utilizar o maior número de expansores possível em cada caso. É fundamental o estudo de alterações funcionais causadas pelo expansor, evitando-as.
Foram realizadas marcações das incisões com azul de metileno nas bordas do nevo, o comprimento foi o menor para colocação do expansor escolhido. A área a ser descolada em pele sadia para abrigar o expansor foi infiltrada com solução de lidocaína 1% com adrenalina diluída na proporção 1:200.000. Após incisão, a área infiltrada foi descolada no plano subcutâneo até a perfeita adaptação da base do expansor escolhido; a hemostasia foi rigorosa para evitar hematomas. O expansor foi inflado para teste dele e de sua válvula; em seguida, esvaziado para implantação. O expansor foi posicionado com sua base bem adaptada à área descolada em pele sadia a ser expandida. Em seguida, foi preparada uma loja para a válvula remota, sendo preferencialmente escolhida na área do nevo. A sutura das feridas foi realizada com mononylon® 3.0 e 4.0., nos planos profundos, e na pele com pontos tipo "simples" com fios de mononylon® 3.0, 4.0 e 5.0. Após a sutura, infiltrou-se 10% do volume do expansor. Os outros expansores foram implantados seguindo esta descrição.
As sessões de infiltração dos expansores foram realizadas ambulatorialmente, seguindo os cuidados de degermação com Clorhexidine® degermante, antissepsia com Clorhexidine® alcoólico, gorro, máscara, luvas estéreis e campo cirúrgico fenestrado estéril. O processo de expansão foi semanal, por um período total de 45 dias, abordou-se cada expansor individualmente e em cada sessão foi utilizada solução salina a 0,9%, seringas de 10 ml e agulhas (0,7 x 0,25). O processo de expansão tinha como limites: 10% do volume de cada expansor por sessão, alteração de sensibilidade (dor) ou sinal de má perfusão tecidual. Os pacientes foram orientados a retornarem se houvesse dúvida ou se a dor pós expansão não cedesse com dipirona ou paracetamol. Caso houvesse sinal de deficiência de circulação, o volume do expansor era diminuído.
A cirurgia de remoção do expansor foi marcada logo que se atingesse o volume desejado e a pele expandida se encontrasse preparada. Foi utilizada a mesma via de acesso de implantação de expansor para sua remoção e de sua válvula. O retalho expandido foi tracionado e marcado com azul de metileno na área do nevo que podia ser coberta com o avançamento do retalho expandido de pele sadia para poder ser ressecado com segurança. O nevo foi ressecado na área demarcada e em sua profundidade total, incluindo o subcutâneo, em seguida, executa-se a hemostasia rigorosa e avança-se o retalho expandido, fixando-o com pontos "simples" de mononylon® 3.0. A sutura das feridas foi realizada com polivycril® 3.0 e 4.0., nos planos profundos, e na pele com pontos tipo "simples" com fios de mononylon® 3.0, 4.0 e 5.0. Foi utilizado dreno aspirativo com vácuo em todos os casos, que foi retirado em 48 horas.
Após o término de todos os procedimentos cirúrgicos mencionados, foi utilizado curativo padrão, realizado com gaze e micropore estéril, e recobertos com ataduras de crepom, estes curativos foram trocados rotineiramente 24 h após a cirurgia, sendo reavaliados e trocados em média a cada 3 dias.
Associação de técnicas de ressecção e cobertura da área cruenta
Os pacientes foram submetidos à combinação dos três métodos descritos acima, tendo um intervalo mínimo de seis meses entre cada cirurgia e uma avaliação clínica e risco cirúrgico entre cada procedimento. Seguindo as indicações e metodologias já descritas.
RESULTADOS
Foram analisados 11 pacientes, com idade variando entre 4 meses e 30 anos.
Os resultados são demonstrados nas Figuras 1 e 2.
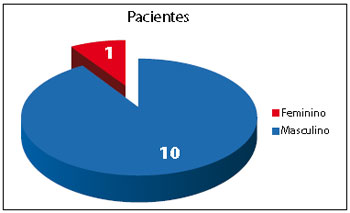
Figura 1 - Gráfico do número total de pacientes divididos por gênero.
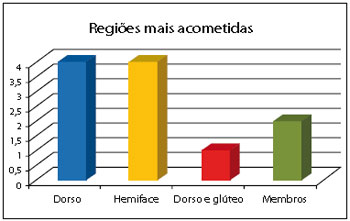
Figura 2 - Gráfico com as regiões mais frequentemente acometidas.
Os tratamentos cirúrgicos foram:
ressecção parcial intralesional em 4 casos (36,36%); ressecção com enxertia de pele em 2 casos (18,19%); expansores em 1 caso (9,09%); combinados em 4 casos (36,36%).
As Figuras 3 a 8 ilustram os principais resultados obtidos neste trabalho.
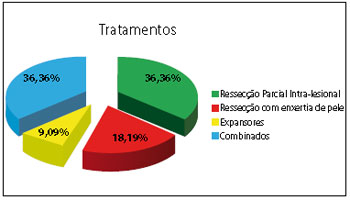
Figura 3 - Gráfico com os tratamentos cirúrgicos.
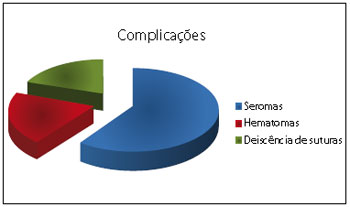
Figura 4 - Gráfico com as complicações mais frequentes.
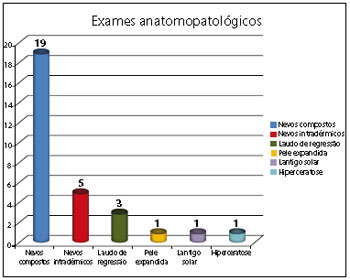
Figura 5 - Os resultados mais frequentes de exames anatomopatológicos.
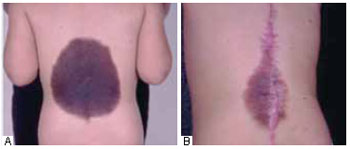
Figura 6 - A: Pré-operatório com 5 anos de idade. B: Pós-operatório de ressecção intralesional aos 7 anos de idade, 2 anos de evolução.
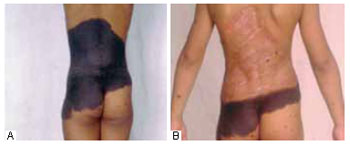
Figura 7 - A: Pré-operatório com 6 anos de idade. B: Pós-operatório de enxertia de pele com 7 anos de idade.
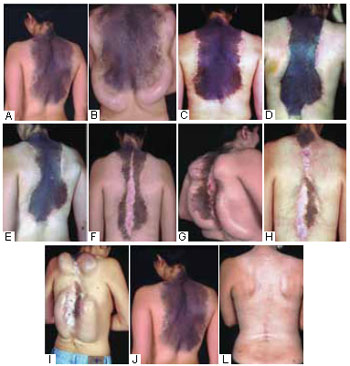
Figura 8 - A: Pré-operatório com 30 anos. B: Implante de 4 expansores. C: Pós-operatório com 31 anos. D: Pós-operatório com 32 anos. E: Pós-operatório com 34 anos todos com expansores. F: Pós-operatório de ressecção intralesional com 35 anos. G: Colocação de expansores com 36 anos. H: Pós-operatório com 36 anos. I: Colocação de expansores com 36 anos. J: Pré-operatório com 30 anos. L: Pós-operatório final com 37 anos.
DISCUSSÃO
O nevo melanocítico gigante (NMG) é uma rara malformação congênita, e o seu tratamento é desafiador, tanto do ponto de vista cosmético como do funcional, havendo grande discordância em relação às indicações do tratamento 12-14. A principal razão da discordância das indicações dos tratamentos é a possibilidade de malignização das lesões maiores. Os problemas relacionados com os NMC gigantes são: possibilidade de transformação maligna, acometimento neurológico e aspecto estético. O autor considera que os riscos de malignização em idade infantil, com evolução letal e de difícil diagnóstico diferencial são as indicações da abordagem cirúrgica precoce dos nevos melanocíticos gigantes, evidentemente que os transtornos decorrentes do aspecto estéticos não podem ser negligenciados4.
A incidência de melanomas desenvolvidos a partir do NMG está entre 2% e 15%. Aproximadamente 60% destes melanomas aparecem na primeira década de vida. O risco para melanocitose neurocutânea está aumentado para lesões axiais grandes associadas com muitas lesões satélites. Praticamente 50% dos pacientes com melanose neurocutânea desenvolvem melanoma leptomeningeal. A metade dos tumores malignos aparece antes dos 3 anos e é geralmente mortal. Mesmo assim, a ocorrência do melanoma de uma forma geral (não apenas relacionado ao nevo congênito) antes da puberdade é rara, correspondendo a 0,4% do total dos casos. O diagnóstico precoce de um melanoma sobre um nevo gigante é difícil, muitas vezes impossível, devido à cor enegrecida das duas lesões.
Os nevos melanocíticos estão normalmente divididos em pequenos (com menos de 1,5 cm de maior diâmetro), médios (entre 1,5cm e 20 cm), e gigantes (maiores que 20 cm). Os nevos médios normalmente atingem o tecido subcutâneo e a maioria destes tem risco para melanoma muito baixo, sendo que quando ocorrem é depois da puberdade. A excisão é recomendada para lesões que estão alterando seu aspecto, têm dificuldade de serem observadas ou que causam preocupações cosméticas.
Entretanto, o mais correto seria estabelecer a proporção da superfície cutânea acometida pelos nevos, ou seja, em um recém nato pode ter um nevo gigante com 10 cm e uma criança de 10 anos o nevo seria gigante com 15 cm. Acredita-se que o risco de desenvolvimento de um melanoma seria diretamente proporcional ao tamanho do nevo em relação à superfície do corpo. Também foi muito comum a classificação em gigante como sendo o nevo que não poderia ser ressecado em um único tempo cirúrgico7.
Histologicamente, os NMG estendem-se para a derme profunda e podem envolver o tecido subcutâneo, fáscia, músculo e outras estruturas subjacentes. Receptores de estrogênio e progesterona são encontrados nos NMG e são raros nos nevos adquiridos.
As lesões que ocorrem sobre a coluna vertebral podem estar associadas a espinha bífida ou mielomeningocele. Portanto, os pacientes com nevos nessa localização devem ter a tomografia computadorizada de crânio entre os exames pré-operatórios, bem como acompanhamento de um neurologista.
O tratamento de pacientes com NMG deve ser individualizado, pois metade destes possui acometimento do tecido subcutâneo e, nestes casos, a extensa cirurgia deve ser preconizada, porém se deve levar em conta a dificuldade de se eliminar totalmente o risco de melanoma, pois nos pacientes acometidos com melanose leptomeningeal o risco de desenvolvimento de melanoma permanece apesar do tratamento cirúrgico15.
Devido ao risco de transformação maligna nos NMG, a excisão profilática é recomendada6. Dentre as técnicas cirúrgicas de remoção e reconstrução, a exérese parcelada do nevo, reconstruções com expansores teciduais e enxerto seriam suficientes para tratar a grande maioria dos casos. Deve-se destacar, entretanto, que estes procedimentos necessitam de múltiplas intervenções no portador do nevo, podendo acarretar alterações funcionais e deformidades secundárias, se não forem bem planejados.
Os casos deste estudo ilustram as formas de tratamento de NMG mais frequentes.
A excisão parcial intralesional ou seriada é o método de escolha inicial de modo geral, porém nas regiões de cabeça e pescoço a expansão tecidual com o uso de retalhos e enxertos mostrou-se uma alternativa bastante eficaz para preservarmos a função, como por exemplo, na região periorbitária, os enxertos de pele total podem ser mais indicados.
A ressecção e sutura pode ser indicada em qualquer idade, sendo empregada principalmente nos casos com ulcerações, irregularidades ou áreas suspeitas de melanoma que necessitem avaliação histopatológica de uma porção específica do nevus, não sendo recomendável o uso desta técnica próximo à região labial, palpebral ou qualquer outra área em que possa ocorrer alteração funcional causada por um descolamento amplo e tração dos tecidos. Esta técnica pode ser associada com outras em posteriores tempos operatórios. Foi a cirurgia empregada em 36,36% dos casos desse estudo, porque com frequência os pacientes são encaminhados pelos dermatologistas e pediatras para avaliarmos uma região específica para ressecção imediata e por ser adequado para qualquer idade torna-se o mais comumente empregado como técnica isoladamente. Apesar de ressecarmos a maior área possível e não apenas a região mais suspeita, é incapaz de resolução completa do nevus, mesmo com tempos repetidos de ressecção parcial.
As ressecções com enxerto de pele podem ser indicadas em qualquer idade, sendo principalmente indicadas em áreas de dobras, região palpebral e região perioral, nas quais poderia ocorrer alteração funcional causada pelo uso de outras técnicas (como os expansores ou ressecções intralesionais). Os enxertos de pele total mantêm a integridade funcional destas áreas, pois não geram distorção causada pela contração secundária, que poderia ser maior nos enxertos de pele fina. Em nossa casuística, tivemos que usar enxertos em um caso que necessitava estudo histopatológico de alterações do nevus, mas que não seria possível cobertura apenas com ressecção e sutura. Existem relatos na literatura sobre a utilização de cultura de queratinócitos com grande vantagem pelo fato da área doadora ser menor que o do enxerto, porém possuem a desvantagem do alto preço e pobre qualidade estética12. Este método parece ser o caminho para o tratamento dos nevos que acometem a maior parte do corpo, não restando área doadora de enxertos ou que possa ser expandida.
Nos casos dos pacientes indicados para tratamento com expansões, salienta-se que esta técnica não pode ser indicada para qualquer idade, pois depende da colaboração do paciente para suportar a cirurgia de colocação de expansores, o processo de expansão e a cirurgia de retirada dos expansores e avançamento dos retalhos, sendo empregada no serviço em crianças acima dos 6 anos de idade.
Quando mencionamos o uso de expansores em face, excluímos região palpebral e perioral, devido à possibilidade de distorção funcional. Os retalhos expandidos podem ser associados às outras modalidades de tratamento. Nos pacientes em idade precoce e que não possuem muito tempo para recuperação, pode-se iniciar o tratamento com ressecção intralesional e depois empregar o expansor tecidual.
Os expansores foram usados isoladamente em um caso (9,09%), mas são uma ferramenta muito útil e foram empregados em todos os casos de combinação de técnicas, sendo usados em cinco pacientes ao todo.
A combinação das cirurgias é o caminho para a resolução mais eficiente e rápida destas lesões. Conseguimos que 4 (36,36%) pacientes aceitassem esta abordagem. Dois pacientes foram submetidos a expansões e ressecção intralesionais, os outros dois foram submetidas a ressecções intralesionais, expansores e enxertos de pele. É a forma que permite remoção de maior parte ou todo nevo. Um paciente que inicie o tratamento com áreas suspeitas pode ser submetido à ressecção parcial e depois seguir com uso de expansores; em áreas específicas de flexão, podemos usar enxertos, desta forma, evitamos distorções funcionais. Assim, podemos fazer análise histopatológica de áreas de risco e mais rapidamente ressecar a lesão. A ressecção completa do nevo só pode ser obtida, até o momento, com combinação de métodos cirúrgicos. Porém, os pacientes têm que ter uma boa aderência ao tratamento, que é longo e desgastante; entretanto alguns pacientes se dão por satisfeitos com remoção parcial das lesões e não dão continuidade ao tratamento. Em nosso estudo, apenas conseguimos remoção completa do nevo no caso de técnicas combinadas. Aguardamos a evolução da biotecnologia para podermos usar tecido que nos ofereça melhor aspecto estético e oportunidade para uso mais amplo.
As complicações mais comumente descritas na literatura nos tratamentos relatados são seroma, hematoma e deiscência de sutura1,3,8. Na nossa casuística, foram encontrados 3 casos de seroma (tratamento utilizado com expansor), 1 caso de hematoma (tratamento com ressecção e enxertia) e 1 caso de deiscência de sutura (nos pacientes tratados com ressecção intralesional).
Existem outros métodos de tratamento superficial, como as dermoabrasões, curetagens, laser de CO2 e outros que podem diminuir teoricamente o risco de melanoma, porém se deve atentar que os melanomas se desenvolvem na derme e não na junção dermo-epidérmica, sendo estes tratamentos ineficazes em longo prazo. Até o momento, a ressecção cirúrgica traz o melhor prognóstico na prevenção do melanoma nos casos de NMG. Independente do tratamento proposto, está formalmente indicado o acompanhamento periódico deste paciente por toda sua vida.
CONCLUSÃO
O tratamento do nevo melanocítico gigante é cirúrgico, deve ser realizado o mais precocemente possível, dando-se atenção especial às áreas com alterações sugestivas de malignização. O planejamento cirúrgico deve ser cuidadoso, para evitarmos distorções funcionais. A abordagem mais eficiente para remoção completa e mais rápida é a combinação de técnicas. Ressecção intralesional e sutura, ressecção e cobertura com retalhos expandidos e, em áreas específicas, enxertia de pele são os métodos que foram empregados no decorrer dos tempos operatórios para remoção das lesões.
REFERÊNCIAS
1. Mélega JM. Cirurgia Plástica. Fundamentos e Arte. Princípios Gerais. 2ª ed. Rio de Janeiro:Medsi;2003. p.309-19.
2. Paschoal FM. Nevo melanocítico congênito. An Bras Dermatol. 2002;77(6):649-58.
3. Weinberg MJ, Al-Qattan M, Zuker RM. Congenital giant pigmented nevi: clinical features and risk of malignancy. Can J Plast Surg. 1996;4(2):94-8.
4. Hopkins JD, Smith AW, Jackson IT. Adjunctive treatment of congenital pigmented nevi with phenol chemical peel. Plast Reconstr Surg. 2000;105(1):1-11.
5. Pitanguy I. Nevus piloso gigante. Rev Bras Cir. 1978;68(5-6):163-79.
6. Pitanguy I. Giant Hairy nevus. Rev Bras Cir. 1993;83(5):217-26.
7. Pitanguy I, Alexandrino A, Torres ET, Marques LAC, Thuin RR. Nevus piloso gigante: considerações clínico-cirúrgicas e potencial de degeneraçäo maligna. Rev Bras Cir. 1985;75(5):360-74.
8. Gosain AK, Santoro TD, Larson DL, Gingrass RP. Giant congenital nevi: a 20-year experience and an algorithm for their management. Plast Reconstr Surg. 2001;108(3):622-36.
9. Watt AJ, Kotsis SV, Chung KC. Risk of melanoma arising in large congenital melanocytic nevi: a systematic review. Plast Reconstr Surg. 2004;113(7):1968-74.
10. Casson P, Colen S. Dysplastic and congenital nevi. Clin Plast Surg. 1993;20(1):105-11.
11. Rhodes AR, Slifman NR, Korf BR. Familial aggregation of small congenital nevomelanocytic nevi. Am J Med Genet. 1985;22(2):315-26.
12. Siwy BK, Compton CC. Cultured epidermis: Indiana University Medical Center's experience. J Burn Care Rehabil. 1992;13(1):130-7.
13. Margulis A, Bauer BS, Fine NA. Large and giant congenital pigmented nevi of the upper extremity: an algorithm to surgical management. Ann Plast Surg. 2004;52(2):158-67.
14. Bauer BS, Margulis A. The expanded transposition flap: shifting paradigms based on experience gained from two decades of pediatric tissue expansion. Plast Reconstr Surg. 2004;114(1):98-106.
15. Arneja JS, Gosian AK. Giant congenital melanocytic nevi of the trunk and an algorithm for treatment. J Craniofac Surg. 2005;16(5):886-93.
1. Professor assistente de Cirurgia Plástica da PUC/RJ - Serviço Prof Ivo Pitanguy, Ex-cirurgião assistente da Clínica Ivo Pitanguy; Membro titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), membro titular do Colégio Brasileiro de Cirurgiões; Fellow of the International College of Surgeons, Rio de Janeiro, RJ, Brasil.
2. Ex-presidente da Clínica Ivo Pitanguy, Professor assistente da FURB, Membro associado da SBCP, membro da AexPi, Rio de Janeiro, RJ, Brasil.
3. Patrono da SBCP, Membro da Academia Nacional de Medicina e Academia Brasileira de Letras, Professor Titular do Curso de Pós-graduação em Cirurgia Plástica da Pontifícia Universidade Católica do Rio de Janeiro e do Instituto Carlos Chagas, Rio de Janeiro, RJ, Brasil.
Correspondência para:
Luiz Victor de Fortuna Carneiro Junior
Rua Visconde de Pirajá, 547 - apto 413 - Ipanema
Rio de Janeiro, RJ, Brasil - CEP 22410-030
E-mail: luizvictorjr@yahoo.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 28/10/2010
Artigo aceito: 15/3/2011
Trabalho realizado na Clínica Ivo Pitanguy, Rio de Janeiro, RJ, Brasil.
Trabalho apresentado para ascenção a membro titular da SBCP.


 Read in Portuguese
Read in Portuguese
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter