

Original Article - Year 2012 - Volume 27 -
Reconstrução mamária com retalho do músculo grande dorsal e materiais aloplásticos: análise de resultados e proposta de nova tática para cobertura do implante
Breast reconstruction with the latissimus dorsi muscle flap and alloplastic materials: analysis of results and proposal of a new technique to cover the implant
RESUMO
INTRODUÇÃO: A reconstrução mamária ocupa lugar de destaque na cirurgia plástica e exige maior doação, entrosamento e confiança entre as especialidades médicas envolvidas e a paciente. O objetivo deste trabalho é analisar os resultados das reconstruções mamárias com o músculo grande dorsal e propor uma tática para melhor cobertura e posicionamento do implante.
MÉTODO: Dezenove pacientes, 2 delas submetidas a cirurgia bilateral, totalizando 21 reconstruções, foram operadas entre junho de 2006 e junho de 2009. As pacientes foram analisadas por meio de questionário sobre aspectos estéticos e funcionais da reconstrução. Foram estudadas intercorrências, complicações e melhora estética com uso do implante sob dupla camada muscular.
RESULTADOS: O índice de complicações foi pequeno, e em apenas um caso houve necessidade de reabordagem cirúrgica para reposicionar o implante em relação ao sulco submamário. Após o procedimento, 94% das pacientes afirmaram que tiveram suas expectativas atingidas, 64% não referiram limitações funcionais e 18% referiram limitações leves. O fato de colocar os implantes (próteses ou expansores) sob o músculo peitoral maior e cobrir o conjunto com o retalho do músculo dorsal melhora o contorno, pois abole ou suaviza as dobras e a aparência dos implantes nos quadrantes superiores e mediais das neomamas.
CONCLUSÕES: As reconstruções mamárias com retalho do músculo grande dorsal associado a implantes de silicone podem oferecer excelentes resultados, com baixos índices de complicações. A colocação do implante sob dupla camada muscular proporciona a obtenção de mais harmonia nos quadrantes superiores das neomamas.
Palavras-chave: Mamoplastia. Mama/cirurgia. Neoplasias da mama. Retalhos cirúrgicos.
ABSTRACT
BACKGROUND: Breast reconstruction is distinct among plastic surgery techniques in that it requires the integration of several medical specialties as well as coordination with the patient. The aim of the present study was to analyze the results of breast reconstruction with the latissimus dorsi myocutaneous flap, and propose a strategy for better coverage and positioning of the implant.
METHODS: The study included 19 patients who underwent surgery between June 2006 and June 2009. Bilateral surgery was performed in 2 patients, and a total of 21 reconstructions were analyzed. The patients filled out a questionnaire on the aesthetic and functional aspects of the reconstruction. The complications, problems, and aesthetic improvement associated with the use of implants placed under a double layer of muscle were assessed.
RESULTS: A low rate of complications was reported, and only one case required a new surgical intervention to reposition the implant in relation to the inframammary crease. After the procedure, 94% of the patients reported that their expectations had been met, 64% reported no functional limitations, and 18% reported mild limitations. The placement of implants (prostheses or expanders) under the pectoralis major muscle, using the latissimus dorsi muscle flap to cover the implant improved the breast contour by softening the inframammary crease and positioning the implants in the upper and medial quadrants of the new breasts.
CONCLUSIONS: Breast reconstruction using silicone implants and the latissimus dorsi muscle flap can have excellent outcomes, with low rates of complications. Placing the implant under a double layer of muscle improves the harmony of the upper quadrants during breast reconstruction.
Keywords: Mammaplasty. Breast/surgery. Breast neoplasms. Surgical flaps.
A luta contra o câncer de mama remonta a 1889, época em que Halsted1 executava mastectomias radicais com o objetivo de obter a cura sem a preocupação de reconstruir. Por vários anos houve uma legião de pacientes mutiladas com extensos defeitos estéticos, funcionais e psicológicos.
O câncer de mama representa na atualidade a principal causa de mortalidade feminina por neoplasia. Os registros de sua incidência demonstraram aumento progressivo nas décadas de 1950 a 1990, em decorrência de campanhas de prevenção e popularização dos meios diagnósticos, já que muitos casos não eram diagnosticados até então. As estimativas previam 50,71 casos novos por 100 mil habitantes no Brasil por ano, segundo o Instituto Nacional do Câncer (INCA), em 2008.
Estudos recentes demonstram que a sobrevida aumenta significativamente com a mastectomia, podendo ser associada a radioterapia, quimioterapia e endocrinoterapia2,3.
A reconstrução mamária até poucos anos atrás era colocada em segundo plano pela classe médica. Foram os cirurgiões plásticos que lutaram por sua adoção. Com a maior conscientização de que a reconstrução mamária é hoje parte do tratamento do câncer de mama, e com o aumento da demanda de pacientes nas esferas tanto pública como privada, o cirurgião plástico adepto e conhecedor dessas técnicas tem agora um novo grupo de pacientes que necessita de seu trabalho e dedicação.
A reconstrução mamária tem papel fundamental na melhora da qualidade de vida das pacientes acometidas pelo câncer de mama. Os avanços dos métodos de diagnóstico precoce e dos tratamentos coadjuvantes e a melhor compreensão da doença pelos mastologistas os fez buscar na cirurgia plástica um apoio para o tratamento integral das pacientes4. Todos esses fatores evoluíram de forma que hoje há o entendimento de que é necessário ofertar a reconstrução imediata da mama, haja vista os bons resultados que se pode obter com as mais variadas técnicas. Paralelamente, a indústria de produtos médico-hospitalares desenvolveu material aloplástico (próteses e expansores) mais adequado e de melhor qualidade, que deixa o cirurgião plástico seguro quanto a sua tolerabilidade5.
As reconstruções mamárias são usadas na reparação dos pequenos defeitos (tumorectomias, segmentectomias e quadrantectomias) e também nas mastectomias. Nos casos de quadrantectomias ampliadas ou mastectomias, material aloplástico pode ser associado a várias alternativas de retalhos cirúrgicos.
Dentre os retalhos à distância de relevância destacam-se: o retalho miocutâneo do reto abdominal (TRAM), descrito por Drever6, em 1977, e modificado por Hartrampf et al.7 e Gandolfo8, em 1982, e o retalho do músculo grande dorsal (RGD), descrito por Tansini9 e modificado por Bostwick et al.10, em 1978. O RGD frequentemente é associado a próteses ou expansores de silicone, com o objetivo de aumentar o volume e dar forma ao cone mamário. O emprego de expansores permanentes bicompartimentais é mais recente.
Após programação da reconstrução mamária imediata, com base em critérios de estadiamento pré-operatórios, é importante a previsão da necessidade de radioterapia no pós-operatório. Em tumores avançados, é grande a perspectiva do uso de radioterapia. Nesses casos, é desejável a indicação de reconstrução com tecidos autólogos, caso estejam disponíveis. Todavia, quando há necessidade de associação de material aloplástico, a literatura nos respalda mesmo diante dos altos índices de contratura capsular vigentes11. As reconstruções com RGD e materiais aloplásticos apresentam melhores resultados que aquelas realizadas somente com expansores subpeitorais, em decorrência da agregação de maior quantidade de tecido12.
O objetivo deste trabalho é demonstrar os resultados, sob o ponto de vista técnico e da avaliação subjetiva das pacientes com doença localizada, das reconstruções mamárias com RGD pediculado e implantes de silicone, bem como reportar intercorrências e complicações observadas nesta série de casos. Paralelamente, apresentamos uma nova tática cirúrgica da dupla camada muscular em reconstrução mamária com RGD e implantes.
MÉTODO
De um total de 80 reconstruções mamárias realizadas entre junho de 2006 e junho de 2009, 19 pacientes foram submetidas a reconstrução mamária com RGD pediculado associado a prótese de silicone ou expansor permanente, totalizando 21 reconstruções (2 casos com reconstrução bilateral) (Figura 1).
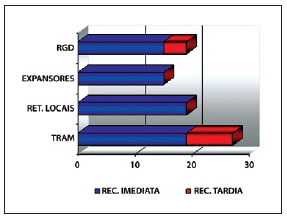
Figura 1 - Representatividade da amostra estudada quanto ao tipo de reconstrução. REC. = reconstrução; RET. = retalho; RGD = retalho do músculo grande dorsal; TRAM = retalho miocutâneo do reto abdominal.
Foram considerados critérios de indicação para utilização do RGD: ausência de área doadora abdominal, presença de fatores de risco que contraindicassem o TRAM (classicamente definidos por Hartrampf et al.7 como tabagismo, hipertensão, diabetes, obesidade e depressão), impossibilidade de reconstruções com retalhos locais e aceitação por parte das pacientes.
As pacientes foram informadas quanto a detalhes técnicos, limitações e outras possibilidades de reconstrução, caso houvesse, incluindo reconstrução mamária tardia.
Todas as pacientes foram operadas sob anestesia geral pelo autor sênior.
A disposição da ilha de pele e suas dimensões, definidas com as pacientes em posição supina, na maioria das vezes foi horizontal (Figura 2).
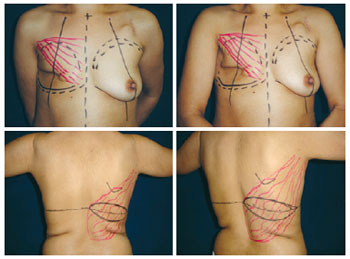
Figura 2 - Planejamento da reconstrução com retalho do músculo grande dorsal e prótese com ilha de pele horizontal em paciente submetida a mastectomia.
Ilha de pele numa disposição oblíqua foi empregada em apenas 2 pacientes, por se tratar de reconstruções tardias, com necessidade de maiores dimensões, que não seriam alcançadas com a ilha horizontal. Em 2 casos, usou-se apenas o retalho muscular, pois na mastectomia houve preservação de pele e do complexo areolopapilar (CAP).
Durante a cirurgia, o pedículo do RGD foi identificado ainda com a paciente em decúbito dorsal, após a remoção da peça pelo mastologista ou a dissecção do sítio da neomama nos casos de reconstrução tardia, momento em que se delineava um túnel para dorso. Em seguida, a paciente foi colocada em decúbito lateral, contralateral à mastectomia unilateral, ou em decúbito ventral, quando a reconstrução foi bilateral.
A dissecção dos retalhos foi feita em todos os casos com eletrocautério, levantando-se a totalidade do ventre muscular disponível. Após a identificação da inserção do RGD e da constatação do pedículo vascular (anteriormente delineado), a dissecção foi interrompida e o retalho transposto para o sítio da neomama. O fechamento do dorso foi realizado primariamente em todos os casos com pontos de adesão de Vicryl 2.0, entre os retalhos descolados e a parede torácica. Em todas as pacientes usou-se dreno a vácuo no dorso e no local da neomama por 8 dias a 10 dias, em média. A síntese da pele foi feita com suturas subdérmicas e intradérmicas com Monocryl 4.0.
Após sutura e curativo do dorso, as pacientes foram colocadas em decúbito dorsal e realizada nova antissepsia, procedendo-se à confecção da neomama com o uso de prótese ou expansor permanente, de acordo com a indicação de cada caso. A fixação do RGD na parede torácica em volta da prótese foi feita na maioria dos casos, com pontos entre o músculo grande dorsal e as estruturas da parede torácica anterior sobre a qual repousava o implante.
Em 8 das 21 reconstruções, houve inovação na colocação e na cobertura do implante. O músculo peitoral maior foi dissecado e suas porções inferomediais liberadas do gradil costal e da borda esternal, para alojar-se nesse espaço uma prótese de silicone ou expansor definitivo (Figura 3). O RGD foi suturado com pontos de Vicryl 2.0 por sobre o músculo peitoral maior, garantindo maior espessura à cobertura nos quadrantes superiores e mediais.
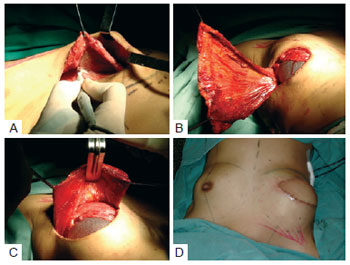
Figura 3 - Tática empregada neste estudo para cobertura do implante por dupla camada muscular. Em A, dissecção da loja subpeitoral. Em B, colocação do implante subpeitoral. Em C, fixação do retalho do músculo grande dorsal sobre o músculo peitoral e implante. Em D, bom contorno dos quadrantes superiores e mediais.
Em 18 reconstruções foram utilizadas próteses de silicone redondas perfil alto (9 de poliuretano e 9 texturizadas) e em 3, expansores Becker 50. A escolha do tipo de prótese (poliuretano ou texturizada) foi aleatória.
A análise subjetiva dos resultados das reconstruções foi feita por meio de questionário distribuído às pacientes (Figura 4).

Figura 4 - Questionário de avaliação subjetiva dos resultados de reconstrução mamária com grande dorsal e prótese ou expansor.
RESULTADOS
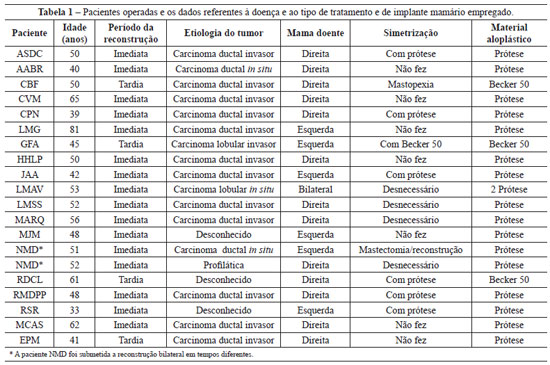
Entre junho de 2006 e junho de 2009, foram operadas 19 pacientes, 2 delas submetidas a cirurgia bilateral, totalizando 21 reconstruções, com período de acompanhamento médio de 14,23 meses. As características das pacientes operadas e do procedimento a que foram submetidas estão apresentadas na Tabela 1.
Uma das pacientes apresentava doença bilateral e foi submetida a reconstrução imediata bilateral. Em outra paciente submetida a reconstrução com RGD e prótese bilateral, a reconstrução foi realizada em momentos diferentes, a primeira cirurgia em decorrência do câncer e a segunda, após adenomastectomia profilática.
O tempo de internação foi de um e dois dias, respectivamente, para 14 e 5 pacientes. Quatro pacientes apresentaram seromas no dorso, que foram resolvidos com aspirações no consultório. Uma paciente submetida a reconstrução tardia, com histórico de radioterapia prévia, apresentou deiscência da sutura do retalho na pele irradiada e evoluiu com celulite local, com resolução após duas semanas de tratamento antimicrobiano. Outra paciente teve reação aos fios de suturas usados no dorso e na neomama (Figura 5).
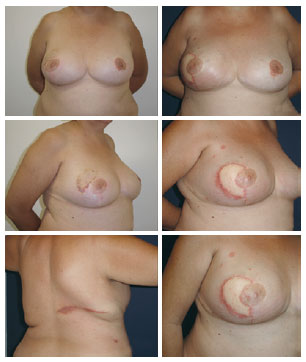
Figura 5 - Retalho do músculo grande dorsal e prótese sob dupla camada muscular: observam-se reações de corpo estranho em todas as cicatrizes.
Não houve complicações maiores com os retalhos e tampouco complicações sistêmicas relevantes. Em um caso de reconstrução tardia com RGD e expansor Becker 50, foi necessário novo procedimento para reposicionar o implante, que ficou baixo em relação à mama contralateral.
Após adequado estadiamento (TNM) das pacientes submetidas a reconstruções imediatas, 14 casos foram classificados como T1 ou T2 e apenas 2 casos como T3. Nenhuma das pacientes apresentava doença diagnosticada à distância. A pesquisa do linfonodo sentinela mostrou-se positiva pela biópsia de congelação em 2 pacientes, que foram prontamente submetidas a esvaziamento axilar; em uma terceira paciente, o esvaziamento axilar foi feito num segundo tempo, após o resultado do histopatológico, que demonstrou linfonodos positivos que não foram vistos na congelação.
Dentre as 15 pacientes submetidas a reconstrução imediata, apenas uma apresentava indicação prévia para radioterapia; entretanto, após adequado estadiamento pós-operatório, 5 outras doentes receberam indicação de radioterapia. A única paciente que sabidamente já no pré-operatório tinha indicação de radioterapia não quis adiar a reconstrução, não se dispunha a fazer o TRAM e tampouco tinha possibilidade para reconstrução com expansor pela quantidade de pele que seria ressacada junto com os dois tumores muito próximos da pele. Dentre as 4 pacientes de reconstrução tardia, 3 haviam feito radioterapia pós-operatória e apresentavam sequelas típicas de tórax irradiado.
Das 5 pacientes submetidas a radioterapia no pós-operatório das reconstruções imediatas, 4 delas apresentaram contratura capsular (2 com Baker II e 2 com Baker III). Apenas uma paciente com Baker III solicitou correção da contratura capsular, que foi realizada com capsulotomia e troca da prótese por outra de maior volume para melhor simetria.
Nas pacientes em que se usou a prótese ou o expansor sob dupla camada muscular (subgrupo de 7 pacientes e 8 reconstruções), as dobras nos quadrantes superiores e mediais não foram notadas e houve melhor dissimulação dos rebordos do implante com maior naturalidade dos resultados, comparativamente àquelas em que a cobertura foi feita apenas pelo RGD (Figura 6).
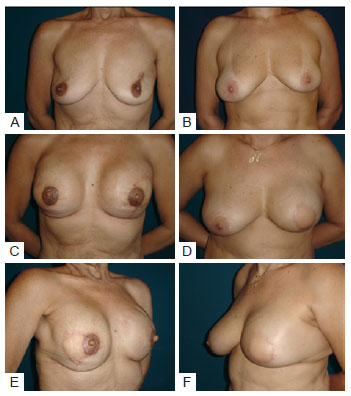
Figura 6 - Em A, C e E, paciente submetida a reconstrução bilateral, sendo possível observar dobras nos quadrantes superiores. Em B, D e F, um caso de reconstrução em que a prótese foi colocada sob dupla camada muscular e o implante ficou mais camuflado, não sendo observadas dobras.
Das 19 pacientes, 8 foram submetidas a simetrização e 6, a reconstrução do CAP. A simetrização foi realizada com próteses de constituição semelhantes à das usadas na reconstrução em 6 casos, com expansor em 1 caso, e apenas mastopexia em 1 caso. As reconstruções do CAP foram realizadas com retalhos locais tipo skate e dermopigmentação (Figura 7)13.
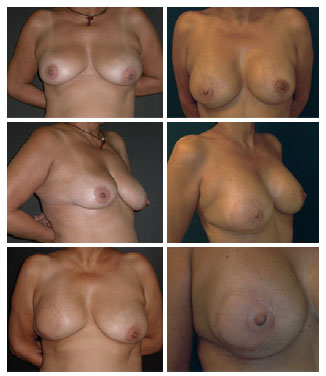
Figura 7 - Paciente de 50 anos submetida a mastectomia e reconstrução da mama direita com retalho do músculo grande dorsal e prótese. A simetrização foi realizada com mastopexia e prótese e o complexo areolopapilar reconstruído ainda aguarda dermopigmentação.
As respostas das pacientes ao questionário demonstram alto grau de satisfação, com baixos índices de repercussão funcional (Figura 8).
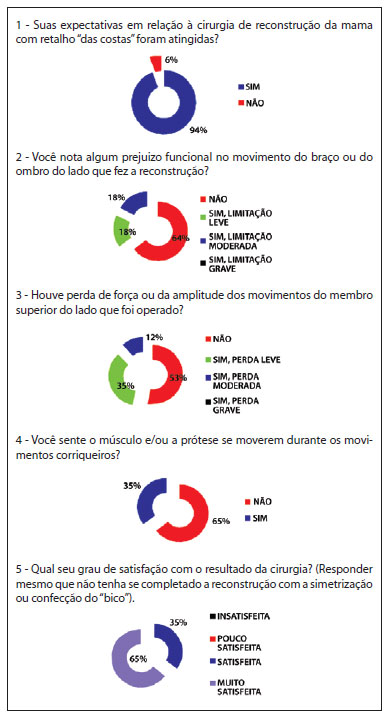
Figura 8 - Estudo das respostas às 5 perguntas do questionário.
DISCUSSÃO
Os benefícios da reconstrução imediata da mama após extirpação de um tumor são incontestáveis nos dias atuais. A biologia do câncer de mama não é alterada pela reconstrução e esta não compromete o adequado tratamento da doença. Embasado em trabalhos como os de Bostwick et al.10 e Dinner & Peters14, o cirurgião plástico passou a integrar o time que trata o câncer de mama numa etapa de importância singular. O trabalho do cirurgião plástico é de substancial importância na recuperação da autoestima das pacientes, à medida que se agrega volume, forma e naturalidade a um tórax que do contrário estaria para sempre estigmatizado e marcado por uma cicatriz de mastectomia.
Desde as reconstruções mamárias idealizadas por Bostwick et al.10 até as atualmente realizadas com RGD propriamente dito, surgiu uma geração aprimorada de próteses de silicone e de expansores, que ampliou o leque de possibilidades de escolha do cirurgião diante do defeito apresentado.
O diagnóstico precoce do câncer de mama refletiu no aumento das indicações de reconstruções mamárias com retalhos locais, com expansores e com o RGD em detrimento do TRAM, que encerra maior morbidade local e sistêmica15. É dessa forma que o RGD associado a prótese ou expansor figura como uma excelente opção para reconstruir mamas após mastectomias poupadoras de pele em pacientes portadoras de câncer de mama em estágio inicial.
É muito comum que as pacientes que se apresentam para reconstrução mamária imediata ou tardia possuam contraindicação absoluta ou relativa para reconstruções com o TRAM. Ao mesmo tempo, as tentativas de utilização apenas do RGD nesses casos, sem próteses, podem ser infrutíferas e, às vezes, frustrantes, haja vista a atrofia sofrida pelo músculo, com consequente perda de volume e forma.
Apesar de haver consenso quanto ao uso das técnicas de reconstrução mamária com tecidos autólogos nas pacientes em que se sabe ou se suspeita de que irão necessitar de radioterapia no pós-operatório, há inúmeras situações inerentes às próprias pacientes que nos fazem indicar o uso de implantes associados ou não a retalhos16.
Neste estudo, o expansor permanente Becker 50 foi usado em duas pacientes submetidas a reconstrução tardia, as quais previamente fizeram radioterapia e cuja ilha de pele do RGD não era suficiente para cobrir uma prótese e possibilitar a reconstrução mamária de forma consistente. Essas mesmas pacientes não eram candidatas ao TRAM, pois uma delas havia sido submetida a abdominoplastia e outra não tinha volume de tecido suficiente na região infraumbilical. Em uma terceira paciente utilizou-se Becker 50 para recuperar o polo medial de uma neomama reconstruída com TRAM e que sofrera liponecrose e radiodermite.
No presente estudo, somente uma paciente já apresentava critérios que a definissem como eleita para radioterapia pós-operatória. Por se tratar de paciente muito jovem com abdome não doador e que não abria mão da reconstrução imediata, associado ao fato de seus tumores serem próximos à pele que também seria removida, a indicação cirúrgica recaiu sobre o RGD com prótese. Com menos de um ano pós-radioterapia, essa paciente apresentou contratura capsular Baker III e foi reoperada com capsulotomia, ampliação da loja e troca da prótese de poliuretano de 345 ml por outra de 485 ml.
Seguindo os critérios adotados pela literatura mundial, contraindicar a reconstrução imediata é hoje cientificamente intolerável e contraria o conceito já pré-concebido das pacientes de que sempre é possível reconstruir de imediato. Logo, o cirurgião assume os altos índices de contratura capsular quando indica a reconstrução imediata, que podem chegar a 68%, segundo dados de McCarthy et al.17. Um alento ao cirurgião é que esse mesmo estudo demonstra que o índice de contratura capsular em reconstruções mamárias com aloplásticos, mesmo sem radioterapia pós-operatória, pode chegar a 40%. Os índices de sucesso final das reconstruções foram de 90% com radioterapia e de 99% sem radioterapia.
As dimensões do músculo grande dorsal são de até 16,3 cm de largura por 29,2 cm de comprimento e toda a gordura sob a fáscia de Scarpa pode ser mobilizada junto com o músculo, com o intuito de melhorar a cobertura dos implantes ou até mesmo agregar volume18. Tanto suas dimensões quanto sua espessura em pacientes magras e/ou sedentárias podem ser limitadas, de modo que incluir uma camada extra de cobertura usando o músculo peitoral maior é factível e louvável, pois o uso deste último na confecção de uma bolsa para o implante não traz maiores danos.
A ideia de usar essa tática surgiu após uma paciente consentir com a tentativa de reconstrução imediata com expansor permanente ou com RGD e prótese, caso o expansor não se aplicasse em seu caso. Após dissecção da loja para o suposto expansor definitivo, verificou-se que o coxim adiposo somado ao peitoral delgado propiciavam reconstrução ruim, em decorrência da escassez de tecido subcutâneo. Quando o RGD foi dissecado, da mesma forma, constatou-se que o mesmo também era muito delgado para ser usado isoladamente, procedendo-se então ao emprego do RGD sobreposto ao peitoral maior, para cobrir a prótese. O resultado dessa reconstrução foi satisfatório no que tange a cobertura do implante, forma da neomama e ausência das dobras da prótese palpáveis nos quadrantes superiores das mamas (Figura 9). A partir de então, sempre que a mastectomia poupadora de pele deixava um retalho delgado, esse procedimento era executado. Outro fator bastante positivo nessa tática é que o implante fica enclausurado na loja subpeitoral e em boa posição em relação ao sulco submamário da mama contralateral, com menor risco de migração.
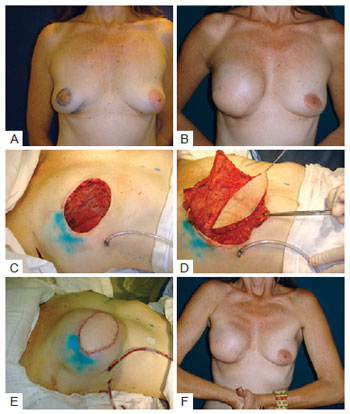
Figura 9 - Em A, paciente com carcinoma ductal in situ, multifocal, evidenciando as duas áreas biopsiadas que foram ressecadas em bloco. Em B, resultado tardio pós-reconstrução com retalho do músculo grande dorsal. Em C, mastectomia com ressecção ampla de pele. Em D, transposição do retalho. Em E, pós-operatório imediato. Em F, prótese sob o peitoral e retalho do músculo grande dorsal.
Nas reconstruções imediatas em que existia ptose mamária considerável, o envelope de pele foi reajustado sobre o volume criado, com decorticação da epiderme e montagem das mamas, com as adaptações necessárias a cada caso (Figura 10).
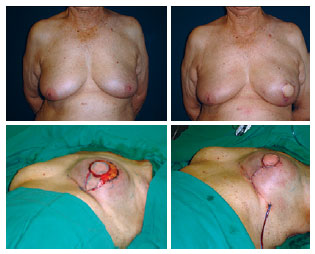
Figura 10 - Reconstrução da mama esquerda com retalho do músculo grande dorsal e prótese: ressecção do excesso de pele e fechamento em T invertido.
Há trabalhos na literatura que reportam o uso de implante sob o músculo peitoral, porém sem a preocupação de camuflar os polos superiores do implante sob dupla camada muscular19. A maior preocupação desses autores que advogam o uso do músculo peitoral em adição ao RGD "em bolsa" é dar mais proteção aos implantes maiores e salvaguardá-los das necroses de pele e demais complicações inerentes às mastectomias poupadoras de pele. Com essa finalidade, o músculo grande dorsal é suturado na borda inferior do músculo, buscando cobrir totalmente as próteses em seu polo inferior.
Nos 8 casos em que se usou dupla camada de cobertura para o implante, notou-se melhora dos resultados estéticos sob a avaliação das pacientes e do cirurgião, comparativamente aos demais casos em que o implante foi colocado sobre o músculo peitoral.
CONCLUSÃO
A cirurgia plástica tem papel importantíssimo no tratamento das pacientes portadoras de câncer de mama.
A reconstrução mamária com RGD tem enorme aplicabilidade, contemplando a correção de quase todos os defeitos pós-mastectomia. Neste trabalho, foi verificado alto grau de satisfação por parte das pacientes operadas e bons resultados obtidos com poucas repercussões funcionais.
A proposta de uma dupla camada muscular, para cobrir melhor o implante e para delimitar sua loja, mostrou-se benéfica na melhora dos resultados estéticos dos quadrantes superiores das mamas reconstruídas. Constitui-se em um procedimento tático inovador a se somar à técnica das reconstruções mamárias com RGD e implantes.
REFERÊNCIAS
1. Halsted WS. I. The result of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June, 1889 to January, 1894. Ann Surg. 1984;20(5):497-555.
2. Ragaz J, Jackson SM, Le N, Plenderleith IH, Spinelli JJ, Basco VE, et al. Adjuvant radiotherapy and chemotherapy in node-positive premenopausal women with breast cancer. N Engl J Med. 1997;337(14):956-62.
3. Overgaard M, Jensen MB, Overgaard J, Hansen PS, Rose C, Andersson M, et al. Postoperative radiotherapy in high-risk postmenopausal breast cancer patients given adjuvant tamoxifen: Danish Breast Cancer Cooperative Group DBCG 82c randomised trial. Lancet. 1999; 353(9165):1641-8.
4. Peto R, Boreham J, Clarke M, Davies C, Beral V. UK and USA breast cancer deaths down 25% in year 2000 at ages 20-69 years. Lancet. 2000;355(9217):1822.
5. Petit JY, Lê MG, Mouriesse H, Rietjens M, Gill P, Contesso G, et al. Can breast reconstruction with gel-filled silicone implants increase the risk of death and second primary cancer in patients treated by mastectomy for breast cancer? Plast Reconstr Surg. 1994;94(1):115-9.
6. Drever JM. Total breast reconstruction with either of two abdominal flaps. Plast Reconstr Surg. 1977;59(2):185-90.
7. Hartrampf CR, Scheflan M, Black PW. Breast reconstruction with a transverse abdominal island flap. Plast Reconstr Surg. 1982;69(2):216-25.
8. Gandolfo EA. Breast reconstruction with a lower abdominal myocutaneous flap. Br J Plast Surg. 1982;35(4):452-7.
9. Tansini I. Sopra il mio nuovo processor di amputazione della mammella. (coverage of the anterior chest wall following mastectomy). Guz Mal Ital. 1906;57:141.
10. Bostwick J 3rd, Vasconez LO, Jurkiewicz MJ. Breast reconstruction after a radical mastectomy. Plast Reconstr Surg. 1978;61(5):682-93.
11. Alderman AK, Wilkins EG, Kim HM, Lowery JC. Complications in postmastectomy breast reconstruction: two-year results of the Michigan Breast Reconstruction Outcome Study. Plast Reconstr Surg. 2002;109(7):2265-74.
12. de la Torre JI, Fix RJ, Gardner PM, Vasconez LO. Reconstruction with the latissimus dorsi flap after skin-sparing mastectomy. Ann Plast Surg. 2001;46(3):229-33.
13. Shestak KC, Nguyen TD. The double opposing periareola flap: a novel concept for nipple-areola reconstruction. Plast Reconstr Surg. 2007;119(2):473-80.
14. Dinner MI, Peters CR. Breast reconstruction following mastectomy. Surg Clin North Am. 1978;58(4):851-68.
15. Cammarota MC. Reconstrução de mama com retalho de grande dorsal: estudo das pacientes operadas no período de junho de 2003 a junho de 2005 [tese para concurso de professor titular]. In: XLIII Congresso Brasileiro de Cirurgia Plástica; 2006 Nov 11-14; Recife, Brasil.
16. Zimmerman RP, Mark RJ, Kim AI, Walton T, Sayah D, Juillard GF, et al. Radiation tolerance of transverse rectus abdominis myocutaneous-free flaps used in immediate breast reconstruction. Am J Clin Oncol. 1998;21(4):381-5.
17. McCarthy CM, Pusic AL, Disa JJ, McCormick BL, Montgomery LL, Cordeiro PG. Unilateral postoperative chest wall radiotherapy in bilateral tissue expander/implant reconstruction patients: a prospective outcomes analysis. Plast Reconstr Surg. 2005;116(6):1642-7.
18. Hazan ASB, Nahas FX, Barbosa MVJ, Piñeda E, Juliano Y, Ferreira LM. Análise anátomo-histológica das subunidades musculares do músculo grande dorsal. Rev Soc Bras Cir Plást. 2006;21(4):203-10.
19. Munhoz AM, Montag E, Fels KW, Arruda EG, Sturtz GP, Aldrighi C, et al. Outcome analysis of breast-conservation surgery and immediate latissimus dorsi flap reconstruction in patients with T1 to T2 breast cancer. Plast Reconstr Surg. 2005;116(3):741-52.
1. Membro titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), preceptor do Serviço de Cirurgia Plástica do Hospital Daher Lago Sul, Brasília, DF, Brasil.
2. Membro associado da SBCP, cirurgião plástico, Brasília, DF, Brasil.
3. Membro titular da SBCP, chefe do Serviço de Cirurgia Plástica do Hospital Daher Lago Sul, Brasília, DF, Brasil.
4. Médico residente do Serviço de Cirurgia Plástica do Hospital Daher Lago Sul, Brasília, DF, Brasil.
Jefferson Di Lamartine
SCN Quadra 2 - Torre A - Salas 1121/1123 - 11º andar - Shopping Liberty Mall
Brasília, DF, Brasil
CEP 70712-903 - E-mail: jdilamartine@dilamartine.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 21/9/2011
Artigo aceito: 31/1/2012
Trabalho realizado no Instituto de Cirurgia Plástica Di Lamartine, Brasília, DF, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter