

Special Article - Year 2012 - Volume 27 -
Rotina de treinamento laboratorial em microcirurgia do Instituto Nacional do Câncer
Laboratory training program in microsurgery at the National Cancer Institute
RESUMO
A microcirurgia é uma técnica na qual se realiza cirurgia sob magnificação óptica em vasos de diâmetro < 3 mm. Jacobson e Suarez, em 1960, foram os primeiros a utilizar o termo microcirurgia para descrever anastomoses experimentais de vasos com calibre entre 1 mm e 2 mm, sendo a origem da moderna prática microvascular creditada a eles. Desde então, foram desenvolvidos e publicados diversos tipos de transferência microvascular de tecidos para reparo de grandes defeitos corporais e ocorreu intensa modernização do poder óptico e do design dos instrumentos. Apesar dessa evolução, a prática laboratorial é indispensável e permite ao cirurgião alcançar a habilidade necessária à realização da técnica de microanastomoses. Nesse contexto, este artigo apresenta a rotina de treinamento em microcirurgia realizada no Laboratório de Microcirurgia Experimental do Instituto Nacional do Câncer (Rio de Janeiro, RJ, Brasil).
Palavras-chave: Microcirurgia. Procedimentos cirúrgicos reconstrutivos. Capacitação. Cirurgia plástica.
ABSTRACT
Microsurgery is a technique in which the surgery is performed under optical magnification in vessels with a diameter of less than 3 mm. In 1960, Jacobson and Suarez first used the term "microsurgery" to describe the experimental anastomosis of vessels with a caliber between 1 and 2 mm, which is considered as the origin of the modern microvascular practice. Since then, several types of microvascular tissue transfer techniques for the repair of large body defects have been developed and published, accompanied by significant advances in optical imaging technologies and instrument design. Despite this technical progress, laboratory practice is essential and enables the surgeon to acquire the ability to master the microanastomosis technique. The present study describes the microsurgery training program of the Laboratory of Experimental Microsurgery of the National Cancer Institute (Rio de Janeiro, RJ, Brazil).
Keywords: Microsurgery. Reconstructive surgical procedures. Training. Plastic surgery.
A microcirurgia é, por definição, uma cirurgia realizada sob magnificação óptica, mais comumente sob o microscópio cirúrgico. Um século se passou desde que Carrel, em 1902, introduziu as técnicas de triangulação para reparação de vaso. Nylen, em 1921, operou o labirinto de coelhos, que foi seguido pelo uso clínico em otologia, oftalmologia e neurocirurgia, procedimentos que necessitavam de magnificação para prover dissecção mais cuidadosa1.
A origem da moderna prática microvascular é creditada a Jacobson e Suarez, que usaram o microscópio cirúrgico de seus colegas de otorrinolaringologia, na década de 1960, e promoveram anastomoses em vasos de diâmetro < 2 mm. Em 1963, Chen realizou o primeiro reimplante de braço, publicado somente na literatura chinesa, e Tamai e Komatsu relataram na literatura inglesa, em 1968, o primeiro reimplante de polegar bem-sucedido. Cobbet, em 1969, na Inglaterra, realizou a primeira transferência de dedo do pé para reconstrução do polegar2-4.
No Brasil, Ferreira et al.5 relizaram, em 1972, o primeiro reimplante de mão com sucesso em humanos6. Posteriormente, outros tipos de transferência de tecido microvascular mais elaborados foram desenvolvidos e publicados até os dias de hoje. A pesquisa atual em microcirurgia busca estudar novos retalhos e refinar os já existentes, permitindo a extensa aplicação dessa técnica em diversas reconstruções7-11. Entretanto, além dos avanços tecnológicos, o sucesso clínico final em microcirurgia também depende da boa habilidade manual na execução da anastomose microvascular.
A aderência às regras básicas durante a preparação do vaso e a sutura será para sempre a pedra angular para o bom trabalho em microcirurgia11. Com o passar do tempo, o diâmetro dos vasos anastomosados tornou-se menor e atingir taxas de permeabilidade de 98% na anastomose de vasos de 1 mm de diâmetro agora é comum. Isso se deve ao excelente poder óptico dos microscópios atuais, à melhora do design dos instrumentos de microcirurgia e ao treinamento em laboratório realizado por pioneiros, como Acland e Buncke.
Exemplos comuns de uso da microcirurgia são implante de membros ou dedos pós-amputação traumática, retalhos livres vascularizados em cirurgia plástica reconstrutiva, recanalização de ducto deferente e tuba uterina e em diversas cirurgias em neurocirurgia, oftalmologia, ortopedia e otorrinolaringologia12. No Brasil, na maioria dos estados não há centros de treinamento ou curso regular de microcirurgia. Nesse contexto, um dos principais obstáculos é o custo do treinamento, o que não diminui a importância particular de existirem centros regionais de microcirurgia, pois, por exemplo, em casos de emergência, tais como amputação traumática, o tempo de transferência para um centro de referência em reimplante é curto e não praticável7.
O treinamento exige alto grau de dedicação e o domínio da técnica deve ser obtido primeiro em laboratório, gradualmente, antes de ser empregada na prática clínica, pois a prática inicial em materiais e animais vivos é essencial para o desenvolvimento de habilidade cirúrgica. Existem vários modelos de treinamento que envolvem diferentes materiais e animais6. Também foram definidas algumas rotinas de treinamento para que se obtenha permeabilidade vascular adequada e, por consequência, êxito na prática diária6,7,13-16.
O objetivo deste artigo é descrever a rotina de treinamento prático em microcirurgia realizado pelos médicos em treinamento do Serviço de Cirurgia Plástica e Microcirurgia Reconstrutora no Laboratório de Microcirurgia Experimental do Instituto Nacional do Câncer (INCA - Rio de Janeiro, RJ, Brasil).
A ESTRUTURA DO LABORATÓRIO DE MICROCIRURGIA
O Laboratório de Microcirurgia Experimental do INCA existe desde 1981, quando foi criado o primeiro Serviço de Microcirurgia Reparadora no Brasil, no INCA, para funcionar independente das outras especialidades, por meio da cogestão INAMPS-Ministério da Saúde na gestão do Dr. Ary Frauzino4. Atualmente dispõe de microscópios binoculares e biotério com ratos da raça Wistar, além do instrumental necessário ao treinamento básico para cada treinando (porta-agulhas curvo e sem trava, uma pinça reta e outra curva de dissecção, uma tesoura curva e outra reta, pinça dilatadora de vaso e pinças microvasculares), e é autorizado pelo Comitê de Ética e Pesquisa (Figuras 1 a 3).

Figura 1 - Laboratório de Microcirurgia Experimental do Instituto Nacional do Câncer (Rio de Janeiro, RJ, Brasil).

Figura 2 - Bancada com microscópios.

Figura 3 - Biotério: prateleira com animais.
ROTINA DE TREINAMENTO EM MICROCIRURGIA
A rotina de treinamento apresenta várias fases, executadas em níveis crescentes de dificuldade, duas vezes por semana, durante 4 horas por dia. Inicialmente, aprende-se a manipular o instrumental microcirúrgico e a manejar o microscópio com, no mínimo, 16X de aumento. O cirurgião é orientado quanto a seu posicionamento e postura, devendo manter o apoio dos cotovelos a 90 graus e apoiar antebraços e punhos, a fim de obter adequada visualização bidimensional do campo operatório e evitar fadiga e tremores.
A seguir, é realizado o primeiro passo do treinamento em si, quando são utilizadas placas de silicone para realização de suturas diversas com fios mononáilon 8-0 e 9-0, durante 20 horas. As placas são cortadas e posicionadas em várias orientações durante o treino, com o intuito de aumentar o grau de dificuldade gradativamente e simular situações reais (Figura 4). O primeiro plano de sutura treinado é o chuleio contínuo e, em seguida, são treinados pontos simples (Figura 5). Com a habilidade adquirida, são realizados dois cortes paralelos na placa, permitindo o treino de confecção de tubos, os quais são usados para simulação de anastomose terminoterminal (Figura 6).
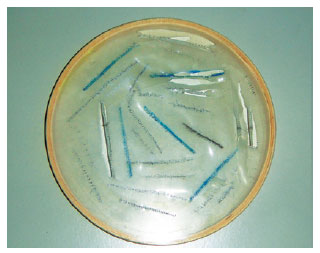
Figura 4 - Placa de silicone: treino de suturas em várias direções.
Figura 5 - Placa de silicone: sutura simples.

Figura 6 - Placa de silicone: confecção de tubos para simulação de anastomose.
A próxima fase envolve o treino com segmentos animais, durante 20 horas, utilizando-se pés de galinha, que possuem uma veia dorsomedial com cerca de 1 mm a 2 mm de diâmetro. É realizado o treino com dissecção e preparo do vaso e realização de anastomose terminoterminal entre pinças (clamps) microvasculares (Figura 7).
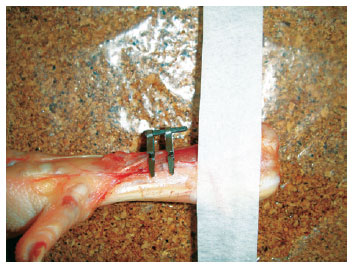
Figura 7 - Pé de galinha: treino de dissecção e sutura terminoterminal.
A última etapa, com duração de 60 horas, envolve o treino com animais vivos. O animal utilizado é o rato da raça Wistar. Antes dessa fase, o treinando aprende a lidar com o animal e a anestesiá-lo para o procedimento. Para a pega no dorso do animal utiliza-se para proteção luva de raspa de couro, a fim de expor o abdome para a aplicação da solução anestésica via intraperitoneal. A solução anestésica empregada é clorpromazina (1,7 mg/kg/dose) e ketamina 120 mg/kg/dose. Antes do procedimento, é preparada solução heparinizada, sendo um frasco de 5 ml (5.000 UI/ml) diluído em 100 ml de ringer lactato, a fim de irrigar o lúmen dos vasos trabalhados para remover impurezas e coágulos. Também são empregados solução de lidocaína 2% para aplicação sobre os vasos, a fim de diminuir o vasoespasmo, e soro fisiológico 0,9% morno para irrigação das alças intestinais e limpeza do campo operatório. Na execução das anastomoses, são empregados fios de náilon monofilamentar 8, 9 e 10-0, e o abdome é suturado ao final com categute 4-0, no plano peritoneomuscular, e com Vicryl 4.0, para pele. Paracetamol via oral é usado para analgesia pós-operatória.
O material e as soluções a serem utilizados são preparados e posicionados previamente ao procedimento e mantidos próximos ao campo operatório (Figura 8).

Figura 8 - Campo operatório preparado.
Nos procedimentos iniciais, o abdome é abordado por incisão mediana, rebatendo-se o peritônio e as alças intestinais para a esquerda, deixando-os envolvidos em gaze, constantemente umedecida com solução fisiológica 0,9% morna. O afastador autostático Weitlaner é empregado para afastar a parede abdominal (Figura 9) e os vasos são preparados por meio de microdissecção. O primeiro vaso trabalhado é a aorta abdominal, que é dissecada e preparada em seu segmento infra ou suprarrenal, para posicionamento das pinças. Para realçar o campo visual, lança-se mão de pedaço de luva estéril verde ou do envelope do fio de sutura abaixo dos vasos e tecidos subjacentes, para facilitar a visualização do campo operatório. Inicialmente, o treino é realizado com sua secção parcial em 50% da circunferência anterior e sutura com pontos simples entre as pinças (Figura 10). A agulha entra perpendicularmente ao vaso, a uma distância da borda que seja o dobro da espessura do vaso, incluindo toda a íntima. A sutura deve everter os bordos e o nó executado sem excesso de tensão. Após adquirir tal habilidade, o treino ocorre com secção total do vaso (Figura 11) e anastomose terminoterminal com pontos simples. O primeiro ponto é dado onde seja mais fácil na parede anterior, de forma que o segundo ponto seja realizado a um terço de distância ou a 120 graus do primeiro17. Vira-se a pinça (clamp) em 180 graus e realiza-se outro ponto a 120 graus dos demais4,17. Pela técnica de triangulação, realiza-se a sutura da parede posterior, para ambos os lados, até os dois primeiros pontos (Figura 12). Assim, a parede anterior é fechada por último, após voltar-se a pinça (clamp) para a posição inicial (Figura 13). Ao final, procede-se ao teste da patência vascular com duas pinças fechadas, que delicadamente se afastam liberando o fluxo no interior do vaso (Figura 14). A seguir, a pinça proximal, no caso da artéria, ou distal, no caso da veia, é liberada, sendo o fluxo verificado nesse momento (Figura 15). O treino de anastomose venosa é realizado por sutura terminoterminal, em que são utilizadas as veias cava (Figuras 16 e 17) e renal (Figuras 18 e 19), procedendo-se da mesma maneira que para a artéria descrita anteriormente. A partir dessa fase, se for considerado capaz, o treinando passa à prática clínica supervisionada para treinamento de microanastomoses. No laboratório continua o treinamento de técnicas com nível de dificuldade maior, como anastomose terminolateral entre as artérias renal e aorta, interposição de enxerto venoso e microneurorrafia do nervo ciático.

Figura 9 - Abordagem por incisão mediana no abdome do rato.
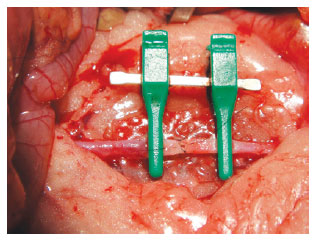
Figura 10 - Secção parcial de aorta e sutura.
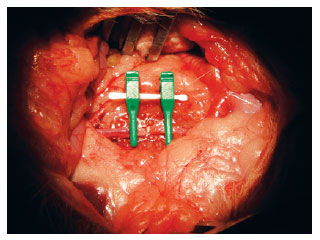
Figura 11 - Secção total de aorta.
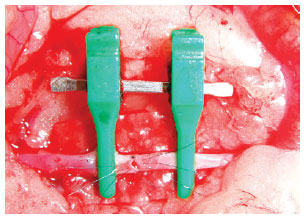
Figura 12 - Secção total de aorta: após suturar a parede posterior, sutura-se a anterior.
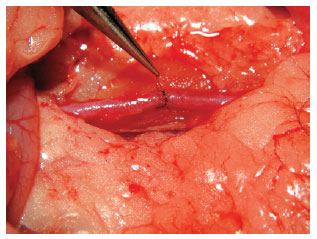
Figura 13 - Secção total de aorta: anastomose finalizada.

Figura 14 - Teste de patência: pinças se afastam uma da outra.
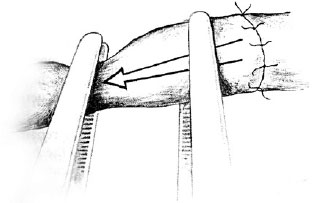
Figura 15 - Teste de patência: verifica-se o fluxo ao se soltar a pinça proximal na artéria, como demonstrado, e a pinça distal, quando for veia.
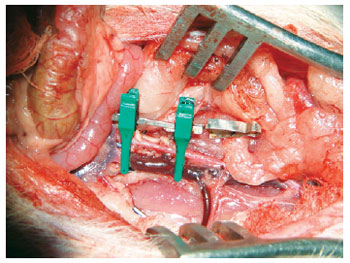
Figura 16 - Veia cava suprarrenal: pinça posicionada antes da secção total.
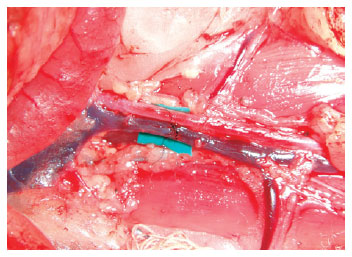
Figura 17 - Veia cava suprarrenal: observa-se a sutura terminoterminal finalizada acima do fragmento de luva verde usado para contraste.
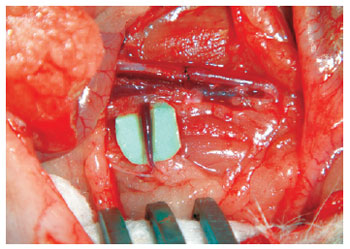
Figura 18 - Veia renal direita (com calibre de 1 mm): contrastada dos tecidos subjacentes com fragmento do envelope verde do fio de sutura.
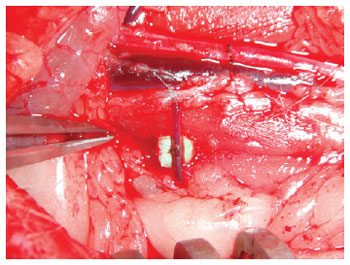
Figura 19 - Veia renal direita: após secção total, anastomose terminoterminal finalizada.
Simultaneamente ao treinamento em laboratório ocorre o aprendizado em centro cirúrgico, onde o treinando participa de cirurgias que envolvem a utilização de retalhos livres para correção dos mais diversos defeitos decorrentes de ressecções oncológicas e sequelas traumáticas, entre outros.
DESEMPENHO DOS RESIDENTES
Os índices de patência vascular alcançados pelos residentes, avaliados pelo teste de enchimento do vaso de Acland, variam. Todos esses índices estão entre os valores aproximados encontrados na literatura (85% a 95%)14 e exigidos para iniciação da prática clínica na instituição.
Por meio da rotina exercida em níveis crescentes de dificuldade, os treinandos atingem o objetivo de se tornarem aptos a realizar microanastomoses e dissecção de retalhos livres em pacientes de forma segura e supervisionada no hospital de ensino. Dessa forma, tornam-se capazes de resolver as mais diversas situações encontradas em seu dia a dia em cirurgia plástica reparadora, em situações em que a transferência microvascular de tecidos seja necessária.
DISCUSSÃO
O treinamento inicial em microcirurgia pode ser longo e tedioso caso não se elabore um planejamento para realizá-lo. O treino deve ser obtido primeiro em um ambiente que não envolva pacientes, em decorrência da complexidade que representa18. Observa-se que, a cada fase, o treino se torna mais estimulante, em decorrência da percepção da evolução prática manual que o próprio treinando tem de si mesmo. Assim, por meio da rotina estabelecida em nossa instituição, gradualmente o residente se familiariza com as táticas e técnicas que envolvem o ato de realizar microanastomoses, tornando-o apto a executar a prática clínica.
Pessoa & Pessoa18 relatam que, no início do treinamento, é importante aprender algumas noções teóricas sobre como lidar com os instrumentais e com o microscópio, e sobre técnicas de dissecção, sutura e anestesia de ratos. O nível de dificuldade dos exercícios deve ser progressivo, para assegurar melhor adaptação ao microscópio e aos instrumentais, sendo desaconselhado o uso precocemente de animais vivos no treinamento13. Na fase inicial, não é importante trabalhar em uma situação que simule o "real" com animais vivos, sendo até uma atitude ética e econômica, uma vez que muitos animais podem ser poupados.
O uso de material sintético, como silicone, é bastante prático para o treino inicial, embora tenha a desvantagem de não oferecer estruturas de consistência similar à dos tecidos biológicos e de não permitir treino de técnicas de dissecção. São executadas suturas em variadas direções, como demonstrado na Figura 4. Assim, o treinando aproveita essa etapa para treinar a habilidade de se posicionar e executar o ponto em diferentes direções, ângulos e inclinações, começando a evitar posições viciosas, o que na prática clínica, muitas vezes, é exigido quando o local da microanastomose não é favorável.
É muito útil o uso de peças animais, que podem ser armazenadas por dias no refrigerador sem perder sua consistência tecidual19. Vários segmentos animais inertes podem ser utilizados para treino20-24, como o pé de galinha, de fácil obtenção em locais onde são ofertados para o consumo, baixo custo e fácil armazenamento. Atribuímos a essa etapa a importância de aprender a manipular e sentir a delicadeza das estruturas microvasculares ao se fazer a dissecção e a microssutura sem a presenca do fator estresse, que poderia ocorrer inicialmente no trabalho com animais vivos. Estes são sensíveis a vários fatores, como pequena perda volêmica, tempo cirúrgico prolongado e lesão inadvertida pelo treinando sem experiência suficiente ainda, acarretando a morte dos animais com mais facilidade, o que poderia aumentar os custos do treinamento.
Trabalhar com animais vivos e manter um biotério envolve elevados custos. Observamos que, no Brasil, várias intituições de renome realizam treinamento em microcirurgia, porém infelizmente encontram algumas barreiras econômicas para tal fim6,7. Em alguns países da Europa e na América do Norte, o entrave maior decorre de discussões de ordem ética relacionadas à proibição de práticas cirúrgicas em animais. A execução do treinamento nas fases iniciais com material inerte e segmentos animais minimiza o uso de animais para a fase final do treinamento, diminuindo os custos. Apesar das dificuldades, a experiência com animais vivos é essencial para o melhor aprendizado da técnica e mesmo seu custo elevado se justifica diante dos benefícios que traz, pois tal treino leva o residente a se familiarizar com uma situação mais próxima da prática clínica, pois aprende in vivo a fazer a correta exposição, dissecção e preparação dos vasos, assim como empregar técnicas de microssutura vascular corretamente.
É importante lembrar que, durante o trabalho com animais, deve haver atenção especial a alguns itens antes do procedimento, como separar todo o material cirúrgico e as soluções necessários. Além disso, a realização da anestesia merece atenção especial, a fim de evitar sofrimento e perda do animal. Isso economiza tempo e materiais e evita acidentes. Para maior aproveitamento, os animais são operados duas vezes; se houver um terceiro procedimento, o animal é sacrificado.
A aorta e a veia cava do animal possuem calibres que variam de 1 mm a 2,5 mm, dependendo da idade do rato. Utilizamos inicialmente a aorta, por ser um vaso que apresenta maior espessura da parede e maior calibre, sendo, portanto, mais fácil de ser suturado. Entretanto, em decorrência da forte retração elástica, quando se faz a secção total, os cotos vasculares tendem a se distanciar um do outro, o que torna a sutura pouco mais difícil para o principiante. Assim, nos primeiros animais operados é realizada secção parcial do vaso, que apresenta nível de dificuldade menor. Após o aluno estar familiarizado com o procedimento, parte-se para a secção total do vaso, em que haverá também a realização de sutura primeiramente da parede posterior, que é tecnicamente mais difícil para o principiante. A seguir, procede-se da mesma maneira para treinar na veia do animal, a qual, embora apresente maiores dimensões, possui uma parede muito fina e frágil, sendo facilmente danificada pelo simples transpassar da agulha, o que gera maior grau de dificuldade e estresse na realização de anastomose terminoterminal ou interposição venosa. A microneurorrafia é treinada no nervo ciático, por estar localizado na raiz da coxa do animal, facilmente acessível, sendo realizada sutura epiperineural terminoterminal25,26.
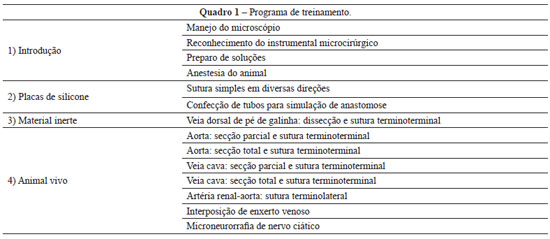
Observamos que a evolução no aprendizado da técnica ocorre naturalmente, conforme o treinando vai conquistando índices de patência vascular adequados, avaliados pelo teste de enchimento do vaso descrito por Acland (Figuras 14 e 15) e também pela sobrevivência do animal em cada fase do programa de treinamento (Quadro 1).
É extremamente recomendado que o treinando somente execute microanastomoses na prática clínica após a obtenção de taxas de sucesso na patência vascular, usando vasos de calibre similar no laboratório, superior a 80%13. Assim, conforme evolui no aprendizado, atingindo níveis de patência que corroboram os da literatura, o treinando começa a fazer o preparo dos vasos receptores e execução da microanastomose vascular na prática clínica, sob supervisão do médico responsável. Existem alguns cursos nos Estados Unidos, com duração de 7 horas diárias, durante dois dias, o que os torna desvantajososos, uma vez que o tempo é demasiadamente curto e extenuante. Para o iniciante, depois das primeiras horas no microscópio, é comum a ocorrência de dores de cabeça, dor muscular, tremores e perda de concentração, além de a microcirurgia ser cheia de detalhes e truques e de a quantidade de informação ser grande para ser aprendida em apenas dois dias27. Seguindo uma rotina de treinamento por um período adequado e confortável, foi possível observar, com segurança, a evolução da habilidade manual do treinando até que estivesse capacitado para a prática clínica supervisionada.
CONCLUSÃO
No aprendizado da microcirugia, a transição entre a prática experimental e a clínica não é fácil e automática28. Estabelecer uma rotina, na qual o treinando se oriente e treine em níveis crescentes de dificuldade, maximiza o aprendizado da técnica de microanastomoses e o torna estimulante. Todas as etapas do treinamento são importantes, especialmente a fase final com animais, pois permite ao treinando simular uma situação "real", vivenciando todo o estresse que pode ocorrer durante a realização de uma microanastomose, antes de empregá-la na prática clínica. Apesar de ter o custo elevado, o uso de animais se justifica, pois ao treinar e adquirir habilidade nas primeiras fases do treinamento sua utilização é reduzida nas etapas seguintes, até se alcançar a patência vascular aceitável para realização da prática clínica.
Deve haver estímulo à implantação de novos laboratórios com biotérios nas instituições de ensino no Brasil e melhora das condições dos já existentes, visto que existem excelentes cirurgiões plásticos interessados, que, seguindo uma rotina básica de treino sob supervisão, poderiam aprender a dominar a técnica de microanastomoses e proporcionar aos usuários de saúde, no que tange à cirurgia plástica reconstrutiva, a realização de retalhos microvascularizados para reparação de defeitos específicos que comumente só são realizados em grandes centros.
Por fim, o domínio da técnica de microanastomoses é apenas um cofator importante no sucesso de cirurgias de transferência de tecidos. Apenas anos de experiência cirúrgica e enfrentamento de situações clínicas diversas permitirão ao cirurgião alcançar maiores índices de sucesso nessas cirurgias de alta complexidade.
REFERÊNCIAS
1. Ferreira MC. Microcirurgia reconstrutiva: a história da microcirurgia no Brasil. In: Bijos P, Zumiotti AV, Rocha JR, Ferreira MC, eds. Microcirurgia reconstrutiva. São Paulo: Atheneu; 2005. 516 p.
2. Galvão MSL, Braga ACCR, Souza JRW. A contribuição da microcirurgia reparadora no tratamento do paciente oncológico. Rev Bras Cancerol. 1984;30(4):24-34.
3. Galvão MSL. The role of reconstructive microsurgery in cancer surgery. In: Fifth Congress of the European Section of the International Confederation for Plastic and Reconstructive Surgery. Stockholm, Sweden, 1985.
4. Galvão MSL, Cardoso MM, Köbig RN. Microcirurgia. In: Saad Jr R, Salles RARV, Carvalho WR, Maia AM, eds. Tratado de cirurgia do Colégio Brasileiro de Cirurgia. São Paulo: Atheneu; 2009. p. 1483-92.
5. Ferreira MC, Marques E, Tedesco-Marchese AJ. Microcirurgia vascular: técnica para sutura de vasos com diâmetro externo inferior a 2 mm. Rev Paul Med. 1974;38(1):67-8.
6. Dias IS, Pessoa SGP, Benevides AN, Macedo JE. Treinamento inicial em microcirurgia. Rev Bras Cir Plást. 2010;25(4):595-9.
7. Webster R, Bins-Ely P. Treinamento em microcirurgia vascular: é economicamente viável? Acta Cir Bras. 2002;17(3):194-7.
8. Cunha MS, Torre ALG, Anjos Neto JC, Monteiro LL, Meneses JV. Transplantes microcirúrgicos: experiência de 5 anos do Serviço de Cirurgia Plástica da Universidade Federal da Bahia. Rev Bras Cir Plást. 2008;23(4):305-9.
9. Souza Filho MVP, Santos CC. Microcirurgia em reconstruções complexas: análise dos resultados e complicações. Rev Bras Cir Plást. 2009; 24(2):123-30.
10. Torres ALG, Milcheski DA, Nakamoto HA, Tuma Jr P, Ferreira MC. Aplicação da microcirurgia no reparo de lesões complexas. Rev Bras Cir Plást. 2009;24(2):131-7.
11. Sabapathy SR. Vessels. In: Wei FC, Mardini S, eds. Flaps and reconstructive surgery. Philadelphia: Saunders Elsevier; 2009. p. 81-92.
12. Di Cataldo A, Li Destri G, Trombatore G, Papillo B, Racalbuto A, Puleo S. Usefulness of microsurgery in the training of the general surgeon. Microsurgery. 1998;18(8):446-8.
13. Martins PN, Montero EF. Basic microsurgery training: comments and proposal. Acta Cir Bras. 2007;22(1):79-81.
14. Samaha FJ, Oliva A, Buncke GM, Buncke HJ, Siko PP. A clinical study of end-to-end versus end-to-side techniques for microvascular anastomosis. Plast Reconstr Surg. 1997;99(4):1109-11.
15. Aston SJ, Beasley RW, Thorne CHMl. Plastic surgery. Philadelphia: Lippincott-Raven Publishers; 1997.
16. Rocha JR. Manual de microcirurgia experimental. Ed. Serviço de Microcirurgia Reconstrutiva do HSE.
17. Cobbet JR. Microvascular surgery. Grabb and Smith's Plastic Surgery. Boston: Little, Brown; 1968.
18. Pessoa BBGP, Pessoa SGP. O retalho hipogástrio cutâneo no cão: modelo para o aprendizado experimental de microcirurgia. Acta Cir Bras. 2002;17(3):198-202.
19. Yasargil MG. From de microsurgical laboratory to the operation theatre. Acta Neurochir. 2005;147(5):465-8.
20. Phoon AF, Gumley GJ, Rtshiladze MA. Microsurgical training using a pulsatile membrane pump and chicken thigh: a new, realistic, practical, nonliving educational model. Plast Reconstr Surg. 2010;126(5):278e-9.
21. Schoffl H, Hager D, Hinterdorfer C, Dunst KM, Froschauer S, Steiner W, et al. Pulsatile perfused porcine coronary arteries for microvascular training. Ann Plast Surg. 2006;57(2):213-6.
22. Aboud E, Al-Mefty O, Yaşargil MG. New laboratory model for neurosurgical training that simulates live surgery. J Neurosurg. 2002;97(6):1367-72.
23. Colpan ME, Slavin KV, Amin-Hanjani S, Calderon-Arnuphi M, Charbel FT. Microvascular anastomosis training model based on a Turkey neck with perfused arteries. Neurosurgery. 2008;62(5 Suppl 2):ONS407-10.
24. Hino A. Training in microvascular surgery using a chicken wing artery. Neurosurgery. 2003;52(6):1495-7.
25. Galvão MSL. Sutura e enxerto de nervo facial. In: Freire E, ed. Trauma: a doença dos séculos. Vol. 2. São Paulo: Atheneu; 2001.
26. Galvão MSL, Sá GM, Farias T, Anlicoara R, Dias FL, Sbalchiero JC. Reconstrução tridimensional da face nos tumores avançados com invasão da fossa craniana anterior. Rev Col Bras Cir. 2004;31(2):124-31.
27. Montero EFS, Simão AFL, Chagas Neto FA, Barroso TA. Microsurgery training using a PVC rat model. In: Book of abstracts of the 8th Congress of the International Society for Experimental Microsurgery; 2006 July 16-19. Montreal, Canada.
28. Zumiotti AV, Rames Mattar Jr R, Rezende MR, Santos GB. Manual de microcirurgia. São Paulo: Atheneu; 2008.
1. Cirurgião plástico, membro especialista da Sociedade Brasileira de Cirurgia Plástica (SBCP), pós-graduando em Microcirurgia Reconstrutiva do Instituto Nacional do Câncer, Rio de Janeiro, RJ, Brasil; cirurgião plástico do Hospital Regional do Câncer e da Santa Casa de Misericórdia de Passos, Passos, MG, Brasil.
2. Fundador/titular da Seção de Microcirurgia Reconstrutiva do Instituto Nacional do Câncer, chefe da Seção de Microcirurgia Reconstrutiva do Instituto Nacional do Câncer, Rio de Janeiro, RJ, Brasil.
3. Cirurgião plástico, membro titular da SBCP, membro do Serviço de Cirurgia Plástica e Microcirurgia Reconstrutiva do Instituto Nacional do Câncer, orientador e responsável pelo Laboratório de Microcirurgia Experimental do Instituto Nacional do Câncer, Rio de Janeiro, RJ, Brasil.
4. Doutor, membro titular da SBCP, chefe do Serviço de Cirurgia Plástica e Microcirurgia Reconstrutora do Instituto Nacional do Câncer, presidente da SBCP - Regional Rio de Janeiro, Rio de Janeiro, RJ, Brasil.
Diogo Almeida Lima
Rua Barão de Passos, 128 - ap. 101
Passos, MG, Brasil - CEP 37900-048
E-mail: drdiogolima@hotmail.com
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 30/1/2012
Artigo aceito: 29/3/2012
Trabalho realizado no Instituto Nacional do Câncer, Rio de Janeiro, RJ, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter