

Original Article - Year 2012 - Volume 27 -
Avaliação histológica e de espessura das cápsulas orgânicas formadas ao redor de expansores de tecidos de superfície lisa ou texturizada em humanos
Histological and wall thickness assessment of organic capsules formed around smooth and textured tissue expanders in humans
RESUMO
INTRODUÇÃO: A busca por um produto que realize expansão tecidual com dano mínimo aos tecidos envolvidos, retalhos mais distensíveis e de menor espessura, e menos sintomas clínicos durante o processo de expansão tem levado as empresas a fabricar expansores com diferentes superfícies (lisa ou texturizada). A literatura é bastante controversa em relação às vantagens da utilização de um ou outro tipo. Esses aspectos motivaram os autores a pesquisar eventuais diferenças capsulares que pudessem justificar a escolha clínica.
MÉTODO: Foi realizado um estudo cego, prospectivo, sem critérios de exclusão, em 38 pacientes submetidos a expansão tecidual no Serviço de Cirurgia Plástica do Hospital Universitário da Universidade Federal do Rio de Janeiro (Rio de Janeiro, RJ, Brasil). Ao final do processo de expansão, foram coletados fragmentos da periferia, da base e da cúpula das cápsulas de 28 expansores de superfície lisa e de 14 de superfície texturizada, para estudo da espessura e de possíveis diferenças histológicas.
RESULTADOS: Não houve diferenças entre os dois tipos de expansor quanto aos aspectos clínicos, ao tempo efetivo de expansão e aos planos de inclusão. Na avaliação dos parâmetros histológicos, não foram observados valores significativamente diferentes segundo a superfície do expansor. Não houve correlação entre espessura e tempo de permanência, e a diferença entre as espessuras máxima e mínima foi considerada igual para os dois tipos de superfície.
CONCLUSÕES: Não há diferenças significativas do ponto de vista histológico, nem razões clínicas, que indiquem vantagens de um ou outro tipo de expansor no processo de expansão tecidual.
Palavras-chave: Expansão de tecido/métodos. Expansão de tecido/instrumentação. Dispositivos para expansão de tecidos.
ABSTRACT
BACKGROUND: The search for an expander that can achieve tissue expansion, with minimum tissue damage, more distensible and thinner flaps, and fewer clinical side effects during the expansion process, has led to the testing of expanders with different surfaces textures (e.g., smooth vs. textured). The individual advantages of smooth and rough expanders are currently not known. This question has motivated research on capsules to determine which type of expander is best.
METHODS: We conducted a double-blind, prospective study with no exclusion criteria on 38 patients already undergoing tissue expansion at Plastic Surgery Department at the Universidade Federal do Rio de Janeiro (University Hospital of the Federal University of Rio de Janeiro). At the end of the expansion process, samples were collected from the edge, base, and dome of capsules formed around 28 smooth and 14 textured expanders. Differences in capsule wall thickness and histology were examined.
RESULTS: There was no difference in the clinical appearance, expansion time, or insertion planes between the two types of expanders. Additionally, no significant differences in histological characteristics were observed between the types of expander surfaces. In statistical analyses, no correlation between capsule wall thickness and expansion time or between the maximum and minimum wall thickness were observed.
CONCLUSIONS: Therefore, we conclude that the two types of tissue expander surfaces are equivalent.
Keywords: Tissue expansion/methods. Tissue expansion/instrumentation. Tissue expansion devices.
A busca por um expansor que alcance a expansão tecidual, com dano mínimo aos tecidos envolvidos, tem levado as empresas a fabricar expansores com diferentes superfícies (lisa ou texturizada), que possam causar menores reações inflamatórias, originando retalhos mais distensíveis e de menor espessura, e menos sintomas clínicos durante o processo de expansão.
A literatura é bastante controversa em relação às vantagens da utilização de um ou outro tipo de expansor. Adams et al.1, em 2006, comentaram sobre os resultados controversos encontrados nos vários trabalhos comparativos entre as cápsulas formadas ao redor de superfícies lisa e texturizada.
Vários trabalhos referem-se às modificações da pele expandida, mas poucos abordam as alterações histológicas da cápsula que envolve o expansor, sendo a maioria dos estudos realizada em animais2-10.
Esses aspectos motivaram os autores a pesquisar eventuais diferenças capsulares entre os dois tipos de superfície dos expansores que pudessem justificar a escolha clínica. Este estudo buscou, também, observar os eventos histológicos que cercam a formação dessas cápsulas em seu estágio inicial, em humanos.
As cápsulas orgânicas formadas em torno de próteses de silicone continuam a merecer avaliações estruturais, com o objetivo de conhecer melhor sua formação e, eventualmente, intervir na prevenção de alterações patológicas. Entretanto, o estudo dessas cápsulas, em humanos, habitualmente fica restrito à ocorrência de complicações que exigem a retirada das próteses. O uso de expansores oferece a possibilidade de observar os estágios precoces da formação das cápsulas, no momento de sua retirada, em média dois meses após sua colocação.
MÉTODO
Foi realizado estudo cego, prospectivo, em pacientes submetidos a expansão tecidual por várias indicações, em vários segmentos corpóreos no Serviço de Cirurgia Plástica do Hospital Universitário da Universidade Federal do Rio de Janeiro (UFRJ - Rio de Janeiro, RJ, Brasil).
No total, 38 pacientes foram submetidos a expansão tecidual, com expansores de silicone de superfície lisa em 24 casos e texturizada em 14, fornecidos pela Silimed (Rio de Janeiro, RJ, Brasil).
Dentre os pacientes que receberam expansores de superfície lisa, 16 eram do sexo feminino e 8 eram do sexo masculino, com idades entre 10 anos e 49 anos. Dentre os pacientes que receberam expansores de superfície texturizada, 13 eram do sexo feminino e 1 era do sexo masculino, com idades entre 10 anos e 39 anos.
Os expansores foram posicionados no plano subcutâneo em 28 casos, no plano subfascial em 7, e no plano retromuscular em 3. Os segmentos corpóreos que receberam os expansores foram couro cabeludo (4 casos), face (1 caso), região cervical (1 caso), ombro (3 casos), braço (3 casos), antebraço (3 casos), tórax (4 casos), abdome (7 casos), coxa (10 casos) e perna (2 casos).
As causas básicas para expansão tecidual foram: cicatrizes após queimaduras (23 casos), cicatrizes após trauma (8 casos), sequela de esclerodermia (1 caso), retirada de hemangioma (2 casos), retirada de nevus (1 caso) e pós-mastectomia (3 casos).
Expansão primária foi realizada em 29 pacientes, em 16 deles com expansor liso e em 13, com expansor texturizado. A reexpansão foi realizada em 9 pacientes, sendo 7 em primeira reexpansão e 2 em segunda.
O tempo de expansão variou de 9 semanas a 34 semanas nos pacientes que receberam expansores lisos, e de 9 semanas a 25 semanas naqueles que receberam expansores texturizados.
O processo de expansão ocorreu conforme a sistematização adotada pelo Serviço de Cirurgia Plástica da UFRJ11-13.
Após o término do processo de expansão, o expansor foi retirado e, nesse momento, foram colhidos, com bisturi de lâmina fria, fragmentos das cápsulas orgânicas formadas ao redor de expansores de superfícies lisa e texturizada com 1 cm x 3 cm em 3 áreas: borda periférica da cápsula, centro da base e centro da cúpula (Figura 1).
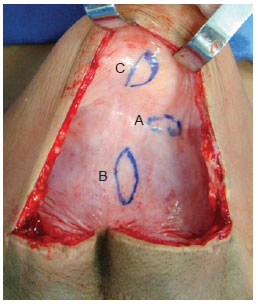
Figura 1 - Cápsula com os locais de retirada das amostras: periferia (A), base (B) e cúpula (C).
Os fragmentos foram posicionados em papel de filtro esterilizado, com a margem profunda da peça em contato com o papel, e imersos em solução de formol a 10%.
A partir dos blocos de parafina foram obtidos cortes histológicos de 4 µ, corados pela hematoxilina-eosina.
A análise das preparações histológicas e a medida da espessura da cápsula foram realizadas em estudo cego, por único observador, anatomopatologista do Serviço de Anatomia Patológica do Hospital Universitário da UFRJ, sem ter conhecimento do tipo de superfície do expansor, do tempo de expansão, do plano de inclusão e se era decorrente de expansão primária ou de reexpansão.
A análise microscópica de 114 preparações, a partir de 38 cápsulas, forneceu a caracterização histológica dos fragmentos da cápsula dos expansores da base da área de expansão, da periferia da cápsula, e da cúpula da cápsula do retalho expandido, com o enfoque na resposta inflamatória.
As amostras correspondentes à área do retalho expandido, que denominamos cúpula da cápsula, foram também avaliadas para registro da menor e da maior medidas da espessura, com emprego de ocular milimetrada, objetiva de 4x (Figuras 2 e 3), considerando os segmentos bem orientados no campo histológico, evitando artefatos de técnica, como dobras de tecidos. As medidas foram aferidas da parte mais interna do material à mais externa. Os resultados foram expressos em milímetros, correspondendo cada ponto da ocular a 0,09 mm.
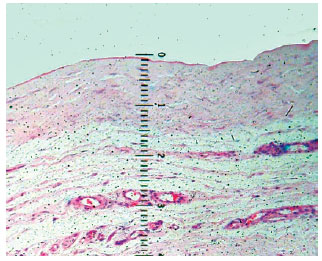
Figura 2 - Fotomicrografia com detalhe da mensuração com objetiva milimetrada. O tecido conjuntivo frouxo não foi considerado na mensuração.
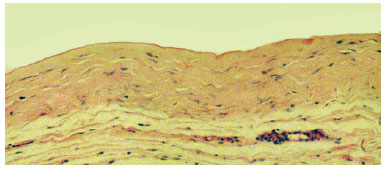
Figura 3 - Fotomicrografia de corte histológico representando parede da cápsula, demonstrando tecido conjuntivo denso, com discreta reação inflamatória e fibras colágenas dispostas paralelamente à superfície interna. Observa-se delicado material amorfo e eosinofílico depositado na borda interna (fibrina) (objetiva x10).
Para avaliar a correlação entre a espessura da cápsula e o tempo de permanência, foi utilizado o teste de correlação de Pearson. Para efetuar comparações da espessura média entre os 3 planos de inclusão, foi utilizada a análise de variância (ANOVA), para amostras com distribuição paramétrica.
O teste t de Student não-pareado foi utilizado para comparar: espessura média da cápsula entre os expansores de superfícies lisa e texturizada, nos planos de inclusão subcutâneo e subfascial; na expansão primária e na reexpansão; sobre anteparos, flexíveis e rígidos; e finalmente, no tempo de permanência dos expansores em relação ao tipo de anteparo anatômico.
RESULTADOS
Resultados das Observações Histológicas na Avaliação de 114 Amostras de Periferia (A), Base (B) e Cúpula (C) das Cápsulas de Expansores de Superfícies Lisa e Texturizada
A análise histopatológica considerou os aspectos do tecido conjuntivo que constituía a cápsula dos expansores e a resposta inflamatória associada.
A maior parte da espessura das cápsulas era representada por tecido conjuntivo denso, hialinizado, com fibras colágenas fortemente eosinofílicas.
O tecido conjuntivo frouxo, com vasos dilatados e filetes nervosos, observado na margem mais profunda do material, foi considerado acompanhante, não fazendo, portanto, parte da parede da cápsula.
O tecido conjuntivo da parede da cápsula apresentava densidade relativamente homogênea. Em alguns casos, a porção mais interna da parede era representada por tecido conjuntivo frouxo, aspecto que se associava à presença de macrófagos na borda interna da cápsula.
A resposta inflamatória associada foi especialmente representada por macrófagos, observando-se também linfócitos e alguns eosinófilos, padrão observado em 62% dos casos. Macrófagos foram observados em disposição relativamente ordenada na borda interna da cápsula, aspecto denominado de "atapetamento". Essa disposição ordenada foi observada em 71,5% das amostras nas cápsulas dos expansores texturizados. Nos expansores lisos, esse "atapetamento" foi também observado, de maneira mais focal.
Nos casos em que o aspecto de "atapetamento" de macrófagos não foi observado, a borda interna da cápsula era representada pela deposição de material amorfo, fortemente eosinofílico (fibrina), delicadamente disposto.
Macrófagos também formaram granulomas do tipo corpo estranho, com formação de células gigantes multinucleadas, e essas estruturas estavam presentes em diversos níveis dentro da parede da cápsula. Reação granulomatosa tipo corpo estranho foi verificada em 54% dos fragmentos examinados e eventualmente estava associada à presença de material refringente (corpo estranho) observado no citoplasma das células gigantes multinucleadas (Figura 4).
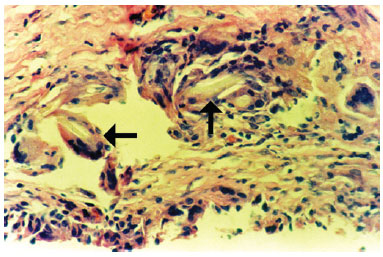
Figura 4 - Fotomicrografia de corte histológico representando a parede da cápsula, demonstrando numerosas células gigantes do tipo corpo estranho (setas), contendo material refringente em seu citoplasma (corpo estranho) (objetiva x40).
Na avaliação dos diversos parâmetros histológicos, não foram observados valores significativamente diferentes quando comparados à natureza da superfície do expansor.
Resultados em Relação à Espessura das Cápsulas dos Expansores
Na avaliação da relação entre o tempo de permanência dos expansores de superfícies lisa e texturizada e a espessura da cápsula, não foi verificada correlação significativa pelo teste de correlação de Pearson (r = 0,2624).
Na avaliação da relação entre os planos de colocação subcutâneo e subfascial dos expansores liso e texturizado e a espessura das cápsulas, não houve diferença estatisticamente significante pelo teste t de Student (P = 0,16).
Na avaliação da espessura média nos 3 diferentes planos de inclusão pelo teste de ANOVA, verificou-se diferença significativa (P = 0,013), possivelmente pelo pequeno número de casos (3 casos) dispostos na posição retromuscular.
As espessuras máxima e mínima das cápsulas dos expansores liso e texturizado foram consideradas iguais para os dois tipos de superfície pelo teste de t de Student (P = 0,4825).
Não houve diferença estatística entre a espessura das cápsulas dos expansores liso e texturizado em expansão primária e em reexpansão pelo teste t de Student (P = 0,4212).
Na avaliação da espessura das cápsulas dos retalhos expandidos em relação aos expansores lisos e texturizados sobre anteparos rígido e flexível (ossos em oposição a músculos), não foi verificada diferença estatisticamente significante pelo teste t de Student (P = 0,8779).
DISCUSSÃO
O advento dos expansores de tecidos trouxe nova perspectiva na reparação de várias doenças congênitas e lesões adquiridas, resultando em menor trauma, menores sequelas e melhores resultados funcionais e estéticos, podendo ser utilizados em vários segmentos corpóreos e em diferentes faixas etárias. Esse procedimento tem sido relativamente pouco utilizado, comparado aos benefícios que proporciona, em decorrência do custo elevado, da pouca divulgação e do prolongado período de tratamento.
Com frequência, as empresas lançam produtos referendados por estudos científicos ou apenas para participar da concorrência do mercado, prometendo ou oferecendo novas vantagens em relação aos já utilizados, porém com maiores custos, com diferença entre os expansores lisos e texturizados que variam de 41% a 56%14.
A importância do estudo da espessura da cápsula no retalho expandido decorre das hipóteses de que os expansores de superfície texturizada produziriam cápsulas mais finas e mais distensíveis, além de ocasionarem menor dor no período de infiltração15-17. Bern et al.4 descrevem, em coelhos, que a cápsula de expansores texturizados é mais rígida. Wickman et al.18 encontraram espessura maior nas cápsulas texturizadas que nas lisas, com grande variação, em pacientes após reconstrução mamária. Adams et al.1 referiram divergência entre os resultados encontrados nos vários trabalhos comparativos entre as cápsulas de superfícies lisa e texturizada.
Neste estudo, não foi verificada diferença significativa entre a espessura média das cápsulas nos planos de colocação do expansor (subcutâneo e subfascial), porém quando comparada a espessura média entre os planos subcutâneo, subfascial e submuscular verificou-se diferença em relação ao plano submuscular. Clinicamente, não foi observada justificativa para essa diferença estatística, que talvez esteja relacionada ao pequeno número de pacientes em que os expansores foram posicionados no plano submuscular. Não foram observadas diferenças histológicas significativas entre as amostras das três áreas estudadas, tampouco em relação ao tipo de superfície do expansor.
A literatura é repleta de estudos que detectaram diferentes características em cápsulas formadas ao redor de implantes texturizados e lisos, alguns deles descrevendo cápsulas espessas e grande celularidade ao redor de implantes texturizados. Outros estudos, porém, demonstraram resultados opostos ou contraditórios, bem como achados incongruentes entre estudos animais e humanos1.
A cápsula, na maioria das vezes, é formada por uma camada mais interna, próxima ao expansor, de tecido conjuntivo denso, presença de fibroblastos, macrófagos, histiócitos, eosinófilos, com feixes de fibras colágenas dispostas paralelamente à superfície, e por uma camada mais externa, com tecido conjuntivo frouxo e vascularização abundante.
Pasyk et al.19 estudaram 17 pacientes, sem relatar o segmento corpóreo ou local da cápsula examinado, e distinguiram histologicamente quatro zonas na cápsula.
Outros autores descreveram, histologicamente, três camadas: camada interna, a que está em contato com o expansor, com presença de material fibrinoide, e macrófagos dispostos em paliçada; camada intermediária, média ou profunda, com tecido conjuntivo denso, fibras colágenas dispostas paralelamente; e camada externa, com predomínio de tecido conjuntivo frouxo e muito vascularizada2,7,20.
Os achados deste estudo são semelhantes aos da literatura em relação à descrição histológica das cápsulas, sendo descritas apenas três camadas. Na camada interna, há presença de macrófagos em disposição ordenada, aspecto qualificado como "atapetamento" ou em paliçada, disposição observada em até 71,5% dos casos, sendo mais frequente nos expansores texturizados. Nos expansores lisos, em muitos casos, esse aspecto foi observado de maneira focal. Nos casos em que esse "atapetamento" não foi observado, a borda interna era representada pela deposição de material amorfo, fortemente eosinofílico, a fibrina. Na camada média, a maior parte foi representada por tecido conjuntivo denso, hialinizado, com fibras colágenas fortemente eosinofílicas. Em alguns casos, essa camada foi representada por tecido conjuntivo frouxo. A terceira camada ou camada mais externa, o tecido conjuntivo frouxo, foi considerada como acompanhante não formadora da parede da cápsula e presença de rica vascularização.
A presença de granuloma de corpo estranho foi percebida em ambas as cápsulas de expansores lisos e texturizados, com maior predominância nos lisos. Granulomas de corpo estranho estavam ora na camada mais superficial ora na profunda, achados variáveis semelhantes aos de outros autores15,17,19,20.
Assim como neste estudo, Kostakoglu et al.20 observaram a presença de material refringente no granuloma de corpo estranho.
A presença de eosinófilos foi frequente nas amostras deste estudo, sendo maior nos expansores de superfície lisa. Tais células também foram observadas na expansão primária e nos casos de reexpansão, sem parecer haver algum motivo especial para sua presença. Alguns artigos relataram a presença de eosinófilos nas cápsulas, em animais e em humanos, não oferecendo, entretanto, maiores argumentos de seu papel, porém não citam ou não fazem algum relacionamento específico4,7,19,20.
A presença de material aloplástico e a resposta imunológica individual a esses materiais podem ser as razões da presença dessas células em alguns casos, traduzindo algum grau de hipersensibilidade.
CONCLUSÕES
Não há diferenças significativas do ponto de vista histológico nem razões clínicas que indiquem vantagens de um ou outro tipo de expansor no processo de expansão tecidual.
REFERÊNCIAS
1. Adams WP Jr, Haydon MS, Raniere J Jr, Trott S, Marques M,1. Adams WP Jr, Haydon MS, Raniere J Jr, Trott S, Marques M, Feliciano M, et al. A rabbit model for capsular contracture: development and clinical implications. Plast Reconstr Surg. 2006;117(4):1214-21.
2. Horibe EK, Horibe K, Valente YS. Estudio experimental de la formación de la cápsula en piel expandida: contribución histológica. Cir Plast Iberolatinoam. 1989;15:267-75.
3. Caffee HH. Textured silicone and capsule contracture. Ann Plast Surg. 1990;24(3):197-9.
4. Bern S, Burd A, May JW. The biophysical and histologic properties of capsules formed by smooth and textured silicone implants in the rabbit. Plast Reconstr Surg. 1992;89(6):1037-44.
5. Heymans M, Lengele B, Lahlali N, Vanwijck R. A peri-implant capsule flap. Br J Plast Surg. 1993;46(6):456-9.
6. Bucky LP, Ehrlich HP, Sohoni S, May JW Jr. The capsule quality of saline-filled smooth silicone, textured silicone, and polyurethane implants in rabbits: a long-term study. Plast Reconstr Surg. 1994;93(6):1123-33.
7. Wieslander JB, Wieslander M. Prefabricated (expander) capsule-lined transposition and advancement flaps in reconstruction of lower eyelid and oral defects: an experimental study. Plast Reconstr Surg. 2000;105(4):1399-407.
8. Friedman HI, Friedman AC, Carson K. The fate of the fibrous capsule after saline implant removal. Ann Plast Surg. 2001;46(3):215-21.
9. Nahas FX, Vasconez LO, Ferreira LM. Guinea pigs as experimental model to evaluate the resistance of the tissue expander capsule. Acta Cir Bras. 2004;19(Suppl 1):96-103.
10. Gancedo M, Ruiz-Corro L, Salazar-Montes A, Rincón AR, Armendáriz-Borunda J. Pirfenidone prevents capsular contracture after mammary implantation. Aesthetic Plast Surg. 2008;32(1):32-40.
11. Tavares Filho JM. Expansores. In: Franco T, ed. Princípios de cirurgia plástica. São Paulo: Atheneu; 2002.p.275-87.
12. Tavares Filho JM, Claudio-da-Silva CS, Souza FZ. Uso de expansores de tecidos nos membros inferiores. Rev Col Bras Cir. 2005;32(6):290-6.
13. Tavares Filho JM, Belerique M, Franco D, Porchat CA, Franco T. Tissue expansion in burn sequelae repair. Burns. 2007;33(2):246-51.
14. Manders EK. Fire! Ready! Aim! Ann Plast Surg. 1994;32:232-3.
15. Barone FE, Perry L, Keller T, Maxwell P. The biomechanical and histopathologic effects of surface texturing with silicone and polyurethane in tissue implantation and expansion. Plast Reconstr Surg. 1992;90(1):77-86.
16. May JW Jr, Bucky LP, Sohoni S, Ehrlich HP. Smooth versus textured expander implants: a double-blind study of capsule quality and discomfort in simultaneous bilateral breast reconstruction patients. Ann Plast Surg. 1994;32(3):225-33.
17. Copeland M, Choi M, Bleiweiss IJ. Silicone breakdown and capsular synovial metaplasia in textured-wall saline breast prostheses. Plast Reconstr Surg. 1994;94(5):628-36.
18. Wickman M, Johansson O, Olenius M, Forslind B. A comparison of the capsules around smooth and textured silicone prostheses used for breast reconstruction. A light and electron microscopic study. Scand J Plast Reconstr Surg Hand Surg. 1993;27(1):15-22.
19. Pasyk KA, Argenta LC, Austad ED. Histopathology of human expanded tissue. Clin Plast Surg. 1987;14(3):435-45.
20. Kostakoglu N, Keçik A, Özylmaz F, Safak T, Özgur F, Gursu G. Expansion of fascial flaps: histopathologic changes and clinical benefits. Plast Reconstr Surg. 1993;91(1):72-9.
1. Doutor e mestre em Cirurgia Plástica pela Universidade Federal do Rio de Janeiro (UFRJ), membro titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), Rio de Janeiro, RJ, Brasil.
2. Doutora, professora associada de Dermatologia da UFRJ, Rio de Janeiro, RJ, Brasil.
3. Doutor, professor adjunto de Cirurgia Plástica da UFRJ, membro titular da SBCP, Rio de Janeiro, RJ, Brasil.
4. Médico residente de Cirurgia Plástica pela UFRJ, membro aspirante em treinamento da SBCP, Rio de Janeiro, RJ, Brasil.
5. Doutora, professora titular de Cirurgia Plástica da UFRJ, membro titular da SBCP, Rio de Janeiro, RJ, Brasil.
Correspondência para:
João Medeiros Tavares Filho
Rua Buenos Aires, 255 - Centro
Petrópolis, RJ, Brasil - CEP 22438-033
E-mail: jmedeiro@compuland.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 11/2/2012
Artigo aceito: 8/5/2012
Trabalho realizado na Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter