

Original Article - Year 2013 - Volume 28 -
Existe efeito protetor da oxigenação hiperbárica em retalhos cutâneos randômicos? Um estudo imuno-histoquímico de apoptose celular e fator de crescimento vascular endotelial
Does hyperbaric oxygenation have a protective effect on random skin flaps? An immunohistochemical study of cellular apoptosis and vascular endothelial growth factor
RESUMO
INTRODUÇÃO: A oxigenação hiperbárica (OHB) tem por objetivo aumentar em pelo menos 10 vezes a pressão tecidual de oxigênio, diminuindo os efeitos deletérios da isquemia. O objetivo deste estudo é investigar o papel da oxigenação hiperbárica na expressão imuno-histoquímica da caspase 3 e do fator de crescimento endotelial vascular (VEGF) em retalhos randômicos em ratos.
MÉTODO: Trinta e dois ratos Wistar machos foram divididos aleatoriamente em quatro grupos: grupo sham (GS), grupo N-acetilcisteína (GNAC), grupo OHB (GOHB) e grupo OHB + N-acetilcisteína (GHN). Um retalho de pele retangular (2 cm x 8 cm) foi dissecado a partir da camada muscular dorsal, preservando um pedículo cranial. Uma lâmina de polietileno foi colocada sobre a camada muscular e fixou-se o retalho no local original. No 8º dia, foram coletadas biópsias (2 cm x 1 cm) de espessura total das áreas proximal, média e cranial e de um local fora do retalho, que serviu como área de controle.
RESULTADOS: A expressão de VEGF nas camadas da pele e nos vasos não apresentou diferenças significativas entre os grupos. As células apoptóticas estavam significativamente aumentadas na área central do retalho em todos os grupos. O maior aumento ocorreu nos grupos GS e GNAC. A OHB diminuiu significativamente o número de células caspase 3 positivas nas camadas da pele e nos vasos das três áreas.
CONCLUSÕES: A OHB foi associada a expressão reduzida de apoptose. A expressão de VEGF em camadas da pele e vasos não demonstrou diferença significativa. Os resultados sugerem que a difusão do oxigênio através do espaço intersticial foi o fator determinante para os resultados mais favoráveis da OHB na diminuição da expressão de apoptose.
Palavras-chave: Oxigenação hiperbárica. Caspase 3. Fatores de crescimento endotelial. Retalhos cirúrgicos.
ABSTRACT
BACKGROUND: Hyperbaric oxygenation (HBO) therapy aims to increase oxygen tissue pressure by at least 10 times and decrease the adverse effects of ischemia. The aim of this study was to investigate the effect of HBO on the immunohistochemical expressions of caspase 3 and vascular endothelial growth factor (VEGF) in random flaps in rats.
METHODS: Thirty-two male Wistar rats were randomly divided into 4 groups: the sham group (GS), the N-acetylcysteine group (GNAC), the HBO group, and the HBO + N-acetylcysteine group. A rectangular skin flap (2 × 8 cm) was dissected from the dorsal muscle layer, and a cranial pedicle was preserved. A polyethylene film was placed on the muscle layer, and the flap was fixed in the original site. On the eighth day, biopsy samples (2 × 1 cm) of the entire thickness of the proximal, medial, and cranial areas as well as of the site outside the flap, which was used as a control, were collected.
RESULTS: VEGF expression in the skin layers and vessels was not significantly different between the groups. The number of apoptotic cells was significantly increased in the area of the flap in all groups. The highest increase was noted in the GS and GNAC groups. HBO significantly reduced the number of caspase 3-positive cells in the skin layers and vessels of the 3 areas.
CONCLUSIONS: HBO was associated with decreased apoptosis. VEGF expression in the skin layers and vessels did not differ significantly. The results suggest that oxygen diffusion through the interstitial space was the determining factor for the positive effect of HBO on the decrease in apoptosis.
Keywords: Hyperbaric oxygenation. Caspase 3. Endothelial growth factors. Surgical flaps.
A oxigenação hiperbárica (OHB) é uma forma de tratamento em que é fornecido oxigênio medicinal a 100% sob pressão, com o objetivo de aumentar em pelo menos 10 vezes a pressão tecidual de oxigênio, diminuindo os efeitos deletérios da isquemia. Esse tipo de terapêutica vem sendo utilizado desde 1968, quando foram definidas suas indicações clínicas. Na cirurgia plástica, a OHB está indicada no tratamento de pacientes grandes queimados e em retalhos isquêmicos, proporcionando hiperoxigenação dos tecidos, ativação de fibroblastos, modulação da resposta inflamatória e aceleração dos fatores de crescimento, além de apresentar efeito antibacteriano1-5.
McFarlane et al.6 idealizaram um modelo experimental para avaliar a viabilidade de retalhos randômicos em ratos, já plenamente consagrado em vários estudos. Os autores verificaram que as alterações bioquímicas e morfológicas guardam relação direta entre a distância da extremidade do retalho e o tamanho de sua base (pedículo)7-9.
Os retalhos randômicos ficam expostos ao dano tecidual decorrente da reperfusão pós-isquêmica, onde o oxigênio molecular retorna com níveis críticos de energia, aumentando a resposta inflamatória e causando toxicidade para as células endoteliais. AN-acetilcisteína (NAC) é uma pró-droga que suplementa o organismo de glutationa, quando esses níveis diminuem na presença de espécies reativas tóxicas de oxigênio (ERTO). A glutationa é considerada um dos mais potentes varredores de radicais livres (scavengers), cujo estoque celular é rapidamente depletado na lesão causada pelo fenômeno de isquemia-reperfusão6,10-12.
O objetivo deste estudo foi avaliar, por meio de um marcador de apoptose (caspase 3 clivada) e de um marcador de crescimento vascular endotelial (VEGF, do inglês vascular endothelial growth factor), o efeito da OHB, da NAC e de sua associação em retalhos randômicos em ratos.
MÉTODO
Aspectos Éticos
O protocolo experimental (0321/06) foi aprovado pelo Comitê de Ética da Universidade Federal de São Paulo. Todos os procedimentos seguiram estritamente os regulamentos existentes sobre experimentação animal, preconizados pelo Colégio Brasileiro de Experimentação Animal.
Amostras e Grupos
Trinta e dois ratos Wistar machos, com 280 g a 300 g, foram mantidos em gaiolas individuais acusticamente isoladas, a 25ºC, sob iluminação artificial, com comida e água ad libitum. Os animais foram divididos aleatoriamente em quatro grupos:
Procedimento AnestésicoGS - grupo sham, constituído de 8 animais; GNAC - grupo NAC, constituído de 8 animais; GOHB - grupo OHB, constituído de 8 animais; GHN - grupo OHB + NAC, constituído de 8 animais.
Após 6 horas de jejum para alimentos sólidos e 4 horas para líquidos, os animais receberam 5 mg/kg de acepromazina a 0,2% intramuscular. Dez minutos mais tarde, receberam uma associação de 50 mg/kg-1 de cloridrato de cetamina e 10 mg/kg-1 de cloridrato de xilazina intramuscular.
Procedimento Cirúrgico
Sob anestesia geral, foi realizada tricotomia das regiões dorsais, sendo então os animais fixados em posição de pronação. Após demarcação de um retalho retangular (2 cm x 8 cm) de base superior, foi realizada incisão com um bisturi (lâmina nº 15), sendo então dissecado o retalho, incluindo epiderme e derme (Figura 1). Um filme de polietileno foi interposto entre o retalho e a camada muscular, recobrindo toda a área da ferida e agindo como uma barreira entre a pele e os músculos (Figura 2). Em seguida, foi realizada síntese do retalho com fio de poliamida 3.0, fixando o retalho em sua posição original.
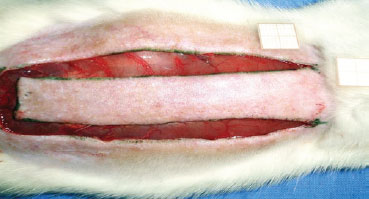
Figura 1 - Retalho cutâneo randômico (2 cm x 8 cm) padronizado de McFarlane et al.6, com base na 7ª vértebra cervical.
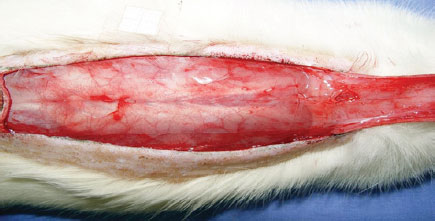
Figura 2 - Filme de polietileno colocado sobre a camada muscular, recobrindo toda a área da ferida e agindo como uma barreira entre a pele e os músculos.
Procedimentos de Administração
Nos animais dos grupos GNAC e GHN, foram injetados intraperitonealmente 300 mg/kg-1 de NAC (Fluimucil®, Zambon Laboratório Farmacêutico Ltda., São Paulo, SP, Brasil), após elevação do retalho e, consecutivamente, a cada 24 horas, durante 7 dias.
Nos grupos GS e GOHB, foi injetado intraperitonealmente 1 ml de água destilada (Isofarma, São Paulo, SP, Brasil), após elevação do retalho e, consecutivamente, a cada 24 horas, durante 7 dias.
Procedimento de OHB
Foi utilizada câmara hiperbárica multianimais. Antes da pressurização, foi realizada lavagem do interior da câmara com oxigênio medicinal a 100%, durante 5 minutos. Após lavagem, a câmara foi pressurizada até atingir a pressão de 2,4 atmosferas absolutas (ATA). A concentração de oxigênio foi monitorada com um oxímetro calibrado. Todos os animais dos grupos GOHB e GHN foram expostos a 100% de oxigênio a uma pressão de 2,4 ATA, durante 2 horas (uma vez por dia), começando 15 minutos após a cirurgia, e a cada 24 horas, durante 7 dias consecutivos.
Tratamento
Os animais foram aleatoriamente divididos nos seguintes grupos:
Amostras ColetadasGS (n = 8), que recebeu água destilada intraperitonealmente 15 minutos após elevação do retalho e durante 7 dias consecutivos; GNAC (n = 8), que recebeu 300 mg/kg-1 intraperitonealmente após elevação do retalho e durante 7 dias consecutivos; GOHB (n = 8), que recebeu oxigênio a 100% em ambiente hiperbárico por 7 dias consecutivos, durante 2 horas a 2,4 ATA; GHN (n = 8), que recebeu a associação de oxigênio em ambiente hiperbárico e NAC intraperitonealmente por 7 dias consecutivos.
No 8º dia do experimento, após os ratos serem novamente anestesiados, foram coletadas biópsias incisionais (2 cm x 1 cm), incluindo toda a espessura do retalho das zonas proximal, medial e distal do retalho. Outra biópsia foi coletada fora da área do retalho, para controle (Figura 3).
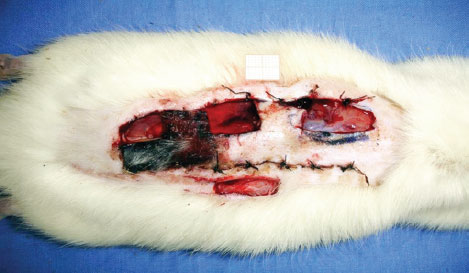
Figura 3 - Áreas onde foram coletadas as biópsias.
Eutanásia
Sob anestesia e após coleta das amostras, os animais foram submetidos a eutanásia em câmara de gás carbônico.
Procedimento Histológico
As biópsias foram fixadas em formol a 10%, embebidas em parafina e coradas para expressão de imuno-histoquímica da apoptose e determinação do VEGF.
Imuno-histoquímica - VEGF
Para detecção da expressão do VEGF foi utilizado um marcador anti-VEGF (Sigma Chemical Company, St. Louis, Estados Unidos). Todas as etapas foram realizadas de acordo com as instruções do fornecedor.
Imuno-histoquímica - Apoptose
Para detecção das células em apoptose foi utilizado um método padrão avidin-biotina, utilizando-se um kit de detecção do anticorpo primário para caspase 3 (Lexington, Estados Unidos). Após a incubação, os espécimes foram tratados com imunoglobulina de coelhos biotinilados (Dako Ltd., Ely, Reino Unido) 1:600 para 30 minutos. Todas as etapas foram realizadas de acordo com as instruções do fornecedor.
Expressão de VEGF
Para determinação da expressão de VEGF nas biópsias da epiderme, derme, vasos e área submuscular, foi utilizada ampliação média (100x e 200x), sendo classificadas conforme a intensidade da cor do citoplasma de 0 a 3:
Expressão de Apoptose0 - sem expressão (reação negativa); 1 - expressão baixa (reação fracamente amarronzada); 2 - expressão moderada (reação marrom moderada); 3 - expressão alta (forte reação marrom).
As imagens foram capturadas por meio de uma câmera de alta resolução, software de Axiomcam (MRC) (Zeiss®), e a análise foi realizada em microscópio óptico (Carl Zeiss Axilab®). O software utilizado foi o Axionvison Rel 4,2 (Zeiss®), que calculou a razão de células amarronzadas, ou seja, em apoptose, e de células não-amarronzadas, ou seja, células livres de apoptose. As células apoptóticas foram contadas em 10 campos de cada lâmina, em todas as amostras, de todos os grupos.
Análise Estatística
Todos os procedimentos de análise histológica e imuno-histoquímica foram realizados sem que o examinador tivesse conhecimento da identificação dos grupos aos quais pertenciam as amostras morfológicas.
Para análise dos resultados da imuno-histoquímica, foram aplicados testes não-paramétricos, levando-se em consideração as variáveis estudadas e o tamanho da amostra. Foram analisadas duas variáveis, uma quantitativa (caspase 3 clivada) e uma semiquantitativa (VEGF).
A caspase 3 clivada foi expressa como média e desvio padrão, sendo aplicados o teste de variância ANOVA para análise dentro dos grupos e o teste de Bonferroni para comparação entre os grupos.
O VEGF foi expresso como um escore obtendo-se a média e o desvio padrão em cada grupo. Foi utilizada a análise de variância ANOVA dentro dos grupos e o teste de Bonferroni para comparação entre os grupos.
Foi fixado em 0,05 ou 5% o nível de rejeição da hipótese de nulidade, sendo considerados estatisticamente significantes valores de P < 0,05 (intervalo de confiança de 95%).
RESULTADOS
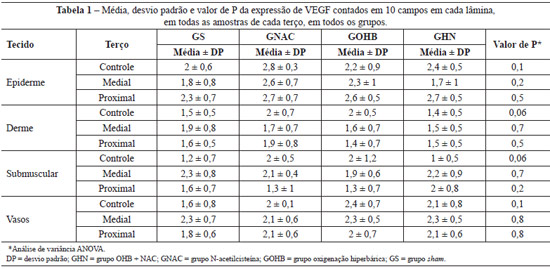
Em relação à expressão do VEGF, todas as biópsias coletadas do terço distal apresentavam necrose. Os dados referentes à expressão do VEGF em epiderme, derme, panículo carnoso e vasos demonstraram que a OHB não promoveu nenhuma alteração significante, tanto no GS como no GNAC (Tabela 1). Não houve diferença significativa também no grupo GHN. Os achados permitem supor que a OHB, a NAC ou a associação de ambas não promoveram alteração na expressão do VEGF nos tecidos.
A OHB diminuiu significativamente as células em apoptose em todas as biópsias obtidas dos terços proximal e médio em relação aos grupos em que não foi utilizada. A associação de OHB e NAC, além de não ter demonstrado efeito protetor, exerceu efeito negativo (Figuras 4 e 5).
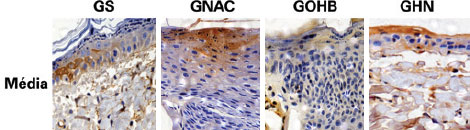
Figura 4 - Fotomicrografias dos grupos GS, GNAC, GOHB e GHN, demonstrando a expressão de caspase 3 (cor marrom) na hipoderme coletada na parte medial do retalho.
Magnitude original de 200x. GHN = grupo OHB + NAC; GNAC = grupo N-acetilcisteína; GOHB = grupo oxigenação hiperbárica; GS = grupo sham.
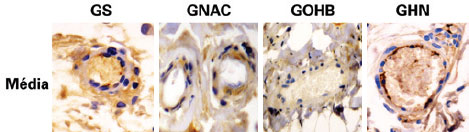
Figura 5 - Fotomicrografias dos grupos GS, GNAC, GOHB e GHN, demonstrando a expressão de caspase 3 (cor marrom) nos vasos coletados na parte medial do retalho. Magnitude original de 400x. GHN = grupo OHB + NAC; GNAC = grupo N-acetilcisteína; GOHB = grupo oxigenação hiperbárica; GS = grupo sham.
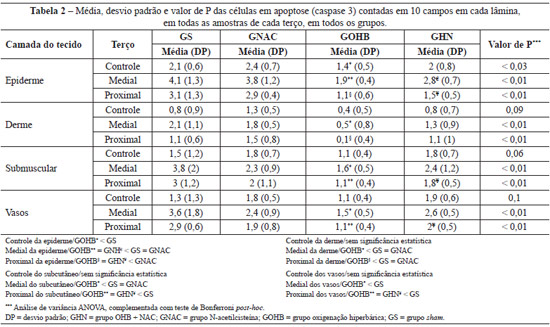
A análise estatística das biópsias obtidas dos terços proximal, médio e distal dos retalhos demonstrou que o GS apresentou o maior número de células em apoptose, seguindo-se o GNAC e o GHN; o grupo que demonstrou o menor número de células em apoptose foi o GOHB em todos os estratos epiteliais estudados (epiderme, derme, submuscular e vasos), como pode ser observado na Tabela 2.
DISCUSSÃO
A média de tensão de oxigênio em retalhos isquêmicos é de somente 30 mmHg. A hipóxia constitui-se em sinal normal de estímulo à cicatrização, porém essa situação pode se agravar se as condições locais de déficit de irrigação perdurarem, funcionando como impedimento à cicatrização e levando à necrose tecidual13.
Durante o período de isquemia, os retalhos randômicos ficam submetidos a hipóxia e hipoglicemia, condições que causam disfunção celular e que podem levar a morte celular. Quando o fluxo sanguíneo é restaurado, um segundo evento, conhecido como flow/no reflow, se desenvolve; esse fenômeno é causado por acúmulo (plug) de células polimorfonucleares aderidas ao endotélio, responsáveis pela produção de ERTO, que estão associadas à segunda onda de dano celular1,14.
As espécies reativas tóxicas de oxigênio são as responsáveis pelo dano oxidativo, que resulta em alterações mitocondriais, depleção de adenosina trifosfato, aumento do cálcio intracelular e ativação de proteases, fosfatases, lipases e nucleases, resultando na perda da integridade celular14.
O fenômeno de isquemia/reperfusão é mediado pelas ERTO, moléculas altamente instáveis e extremamente tóxicas para a maioria dos fenômenos biológicos. As ERTO causam peroxidação lipídica das membranas celulares, gerando a formação de mais radicais livres em um ciclo que se autopropaga, levando a célula à morte celular por necrose ou apoptose5.
Estudos corroboram a hipótese de que o oxigênio funcione como um sinalizador de uma série de eventos que promovam a cicatrização. Tecidos tratados com OHB reduzem o fator indutor de hipóxia (HIF-α, do inglês, hypoxia-inducible factor), um importante regulador da expressão gênica envolvida na regulação da oxigenação tecidual e que aumenta na presença da hipóxia. A proteína BNip3 (uma proteína pró-apoptótica localizada na mitocôndria) está extremamente elevada a partir do 10º dia em tecidos isquêmicos. Altos níveis de oxigênio induzidos pela OHB reduzem e atenuam a expressão da proteína BNip3, modulando a apoptose a despeito do persistente elevado nível de ácido láctico1,4,5,15.
Dessa forma, a OHB aumenta a ação antiapoptótica e reduz a ação pró-apoptótica, resultando na diminuição da liberação de moléculas pró-apoptóticas pela mitocôndria e atenuando a apoptose. Os mecanismos moleculares de proteção proporcionados pela OHB na cicatrização de feridas isquêmicas são decorrentes da modulação do fator que induz hipóxia (HIF-1α). Feridas tratadas com OHB apresentam diminuição do HIF-1α e sua consequente gene expressão, com diminuição da apoptose e redução do processo inflamatório1,4,5.
Após a isquemia, o processo de angiogênese se inicia entre 1 dia e 3 dias, sendo modulado por fatores de crescimento que se localizam nas células endoteliais e na matriz extracelular. O VEGF é considerado o mais importante estimulador da angiogênese, estando associado ao início do processo de neoformação vascular, sendo igualmente considerado um monitor confiável do processo15-18.
A caspase 3 é uma proteína executora de apoptose, convertendo a DNAse citoplasmática em uma forma ativa. Durante a programação de morte celular, a caspase 3 ativa precocemente as endonucleases, causando a fragmentação do DNA e impedindo a consecução dos processos enzimáticos vitais às células, já tendo sido utilizada em estudos anteriores com retalhos isquêmicos cutâneos5,19.
Muitos são os mecanismos envolvidos na cicatrização dos tecidos, mas a maioria dos estudos admite a necessidade da presença de fatores de crescimento associados à produção de energia derivada da glicólise e do ciclo de Krebs.
A oxigenação hiperbárica aumenta em até 10 vezes a pressão tecidual de oxigênio, pela sua capacidade de fornecer oxigênio dissolvido no plasma segundo as leis de Henry e Boyle, atuando, ainda, diretamente sobre os neutrófilos e mediadores inflamatórios responsáveis pelo dano tecidual.
Os humanos apresentam um complexo sistema antioxidante, sendo a glutationa depletada durante esse processo. A NAC é considerada uma pró-droga que suplementa os níveis de glutationa quando esses são depletados durante o fenômeno oxidativo, sendo utilizada em muitos estudos experimentais pela sua baixa toxicidade e pelos efeitos protetores sobre retalhos randômicos.
Os dados referentes à expressão do VEGF na epiderme, na derme, no panículo carnoso e nos vasos demonstraram que a OHB não promoveu nenhuma alteração significativa (Tabela 2). O mecanismo aventado para não ter sido encontrado aumento na produção de VEGF seria que a pressão parcial de oxigênio não retornaria aos níveis isquêmicos anteriores entre as sessões de hiperoxigenação e, assim, não haveria estimulação para a produção do VEGF5.
Se a expressão do VEGF é regulada para cima na presença de isquemia, nos grupos tratados com OHB (GOHB e GHN), em que foram oferecidas quantidades superiores de oxigênio, é justificável que a expressão do VEGF não fosse modulada para cima. No entanto, não haveria justificativa para não ter ocorrido aumento significativo no grupo GS. A hipótese mais provável que justifique os resultados deste estudo pode ser uma importante diminuição da atividade metabólica causada pela isquemia, com diminuição de todas as proteínas, causando inibição da expressão de VEGF20.
Outra hipótese que pode justificar os resultados encontrados neste estudo foi previamente identificada por outros autores, que verificaram importante diminuição da atividade metabólica causada pela isquemia, com diminuição da síntese de todas as proteínas, incluindo o VEGF20.
As altas concentrações de NAC utilizadas no grupo GNAC poderiam ter sido responsáveis pela inibição da produção de VEGF. Já foi observado que altas concentrações de NAC inibiriam a angiogênese e a resposta cicatricial por meio de um balanço antioxidante ainda não bem esclarecido11. No entanto, nesta pesquisa, a expressão do VEGF não se alterou em nenhum dos grupos, mantendo o mesmo perfil do GS.
O modelo utilizado pela interposição do filme de polietileno pode ser responsável pela falta de expressão do VEGF nos grupos tratados com NAC ou OHB. Como não houve alteração entre esses grupos e o grupo controle, pode-se inferir que o estímulo para a angiogênese seja dependente do leito sobre o qual o retalho foi recolocado após sua confecção. Não havendo o contato com o leito, o crescimento de novos vasos pode ter sido retardado.
Os dados referentes à média de células apoptóticas nos estratos biopsiados demonstraram que, na parte externa ao retalho randômico, e, portanto, onde não houve o fenômeno isquêmico, a OHB (0,4 ± 0,5) promoveu diminuição maior da expressão da caspase 3 em relação aos grupos GS (0,8 ± 0,9), GNAC (1,3 ± 0,5) e GHN (0,8 ± 0,7). Os achados permitem supor que a OHB teve efeito protetor no tecido normal, diminuindo a expressão da caspase 3, permitindo supor que exista uma tendência de proteção exercida pela hiperoxidação, mesmo em tecidos que não estejam expostos a isquemia, funcionando o trauma cirúrgico como uma espécie de pré-condicionamento.
A avaliação conjunta da expressão da apoptose nos variados estratos permitiu perceber os efeitos protetores da OHB nas porções média e proximal dos retalhos. A OHB apresentou efeito redutor na expressão da caspase 3 na pele externa ao retalho, demonstrando que a hiperoxigenação em tecidos sadios é semelhante àquelas que receberam o estímulo cirúrgico; já no GNAC não foi observado efeito protetor pela esperada ação antioxidante exercida pela NAC. A aplicação da NAC não apresentou efeitos diferentes em relação ao grupo controle, nem apresentou efeito sinérgico com o uso da OHB, demonstrando que não houve efeito protetor pelo uso da NAC como antioxidante.
A associação da NAC com a OHB demonstrou resultados piores aos encontrados com o uso isolado da OHB. Altas concentrações de NAC acima de 20 mmo/l podem ter efeito inverso em relação a sua capacidade de agir como antioxidante, pela inversão do pH, ativando o citocromo C e facilitando a abertura dos poros mitocondriais, levando à morte celular11.
Os resultados desta pesquisa sugerem uma clara redução no índice de apoptose no grupo tratado com OHB. A hipótese mais plausível e responsável pelo efeito protetor exercido pela OHB na apoptose celular é atribuída à abundante oferta de oxigênio aos tecidos durante a fase inicial de isquemia, o que atenuaria a resposta inflamatória e diminuiria a peroxidação lipídica4-6.
CONCLUSÕES
Considerando o efeito favorável da OHB na diminuição da expressão da apoptose celular, pode-se inferir que esse fato seja decorrente do tempo de exposição ou do número de exposições ao oxigênio hiperbárico. O racional da aplicação da OHB, os demais relatos da literatura e os achados desta pesquisa permitem inferir que aplicações diárias mais prolongadas ou maior número de sessões diárias poderão traduzir-se em expressões menores de apoptose. São perspectivas que mantêm abertas as possibilidades de investigação nesse campo.
O VEGF foi um marcador que não demonstrou variações significantes quer sobre a ação da OHB quer sobre a ação da NAC ou na associação de ambas. O fato demonstra que o retalho, em decorrência da interposição do filme de polietileno, ficou dependente exclusivamente do pedículo vascular. Tanto a OHB como a NAC não foram efetivas para promover aumento de sua expressão, o que revela, em última análise, que não houve estímulo para a neogênese vascular no período estudado.
REFERÊNCIAS
1. Zamboni WA, Roth AC, Russell RC, Smoot EC. The effect of hyperbaric oxygen on reperfusion of ischemic axial skin flaps: a laser Doppler analysis. Ann Plast Surg. 1992;28(4):339-41.
2. Buras J. Basic mechanisms of hyperbaric oxygen in the treatment of ischemic-reperfusion injury. Int Anesthesiol Clin. 2000;38(1):91-109.
3. Kranke P, Bennett M, Roeckl-Wiedmann I, Debus S. Hyperbaric oxygen therapy for chronic wounds. Cochrane Database Syst Rev. 2004; (2):CD004123.
4. Bertoletto PR, Fagundes DJ, Simões MJ, Oshima CT, Montero EFS, Simões RS, et al. Effects of hyperbaric oxygen therapy on the rat intestinal mucosa apoptosis caused by ischemia-reperfusion injury. Microsurgery. 2007;27(4):224-7.
5. Vidigal J, Fagundes DJ, Simões MJ, Oshima CT, Odashiro AN, Simões RS, et al. Effect of different periods of hyperbaric oxygen on ischemia-reperfusion injury of rat skeletal muscle. Microsurgery. 2007;27(4):252-7.
6. McFarlane RM, Deyoung G, Henry RA. The design of a pedicle flap in the rat to study necrosis and its prevention. Plast Reconstr Surg. 1965;35:177-82.
7. Zhang Q, Chang Q, Cox RA, Gong X, Gould LJ. Hyperbaric oxygen attenuates apoptosis and decreases inflammation in an ischemic wound model. J Invest Dermatol. 2008;128(8):2102-12.
8. Friedman HI, Fitzmaurice M, Lefaivre JF, Vecchiolla T, Clark D. An evidence-based appraisal of the use of hyperbaric oxygen on flaps and grafts. Plast Reconstr Surg. 2006;117(7 Suppl):175S-90S.
9. Zhang T, Gong W, Li Z, Yang S, Zhang K, Yin D, et al. Efficacy of hyperbaric oxygen on survival of random pattern skin flap in diabetic rats. Undersea Hyperb Med. 2007;34(5):335-9.
10. Rocha FP, Fagundes DJ, Rivoire HC, Rech FV, Almeida MW, Pires JA. Immunohistochemical expression of apoptosis and VEGF expression on random skin flaps in rats treated with hyperbaric oxygen and N-acetylcysteine. Undersea Hyperb Med. 2011;38(3):167-74.
11. Kunnavatana SS, Quan SY, Koch RJ. Combined effect of hyperbaric oxygen and N-acetylcysteine on fibroblast proliferation. Arch Otolaryngol Head Neck Surg. 2005;131(9):809-14.
12. Rocha FP, Fagundes DJ, Pires JA, Rocha FS. Effects of hyperbaric oxygen and N-acetylcysteine on the survival of random pattern skin flaps in rats. Indian J Plast Surg. 2012;45(3):453-8.
13. Weiss SJ. Oxygen, ischemia and inflammation. Acta Physiol Scand Suppl. 1986;548:9-37.
14. Gammper TJ, Zhang F, Mofakhami NF, Morgan RF, Amiss R, Hoard MA, et al. Beneficial effect hyperbaric oxygen on island flaps subjected to secondary venous ischemia. Microsurgery. 2002;22(2):49-52.
15. Zhang F, Oswald T, Lin S, Cai Z, Lei M, Jones M, et al. Vascular endothelial growth factor (VEGF) expression and effect of exogenous VEGF on survival of random flap in the rat. Br J Plast Surg. 2003;56(7):653-9.
16. Moreschi D Jr, Fagundes DJ, Hernandes L, Haapalainen EF. Effects of prostaglandin E(1) in the genesis of blood capillaries in the ischemic skeletal muscle of rats: ultrastructural analysis. Ann Vasc Surg. 2008;22(1):121-6.
17. Ito WD, Arras M, Scholz D, Winkeler B, Htun P, Schaper W. Angiogenesis but not collateral growth is associated with ischemia after femoral artery occlusion. Am J Physiol. 1997;273(3 Pt 2):H1255-65.
18. Zheng Y, Yi C, Xia W, Ding T, Zhou Z, Han Y, et al. Mesenchymal stem cells transduced by vascular endothelial growth factor gene for ischemic random skin flaps. Plast Reconstr Surg. 2008;121(1):59-69.
19. Korn C, Scholz SR, Gimadutdinow O, Pingoud A, Meiss G. Involvement of conserved histidine, lysine and tyrosine residues in the mechanism of DNA cleavage by the caspase-3 activated DNase CAD. Nucleic Acids Res. 2002;30(6):1325-32.
20. Erdmann D, Pippen AM, Moquin KJ, Sweis R, Niklason LE, Levin LS, et al. Immunohistochemical identification of vascular endothelial growth factor in pig latissimus dorsi musculocutaneous flaps following ischemia-reperfusion injury. Ann Plast Surg. 2004;53(4):398-403.
1. Cirurgião plástico, membro associado da Sociedade Brasileira de Cirurgia Plástica (SBCP), doutor, professor do Departamento de Cirurgia da Universidade Católica de Pelotas, Pelotas, RS, Brasil
2. Doutor, professor associado em Técnica Operatória e Cirurgia Experimental do Departamento de Cirurgia da Universidade Federal de São Paulo, São Paulo, SP, Brasil
3. Acadêmico de Medicina da Universidade Federal de Pelotas, presidente da Liga Acadêmica de Cirurgia Plástica da Universidade Federal de Pelotas, Pelotas, RS, Brasil
4. Acadêmica de Medicina da Universidade Federal de Pelotas, Pelotas, RS, Brasil
Correspondência para:
Fernando Passos da Rocha
Praça Piratinino Almeida, 13 - Centro
Pelotas, RS, Brasil - CEP 96015-290
E-mail: fprocha.sul@terra.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 24/11/2012
Artigo aceito: 19/3/2013
Trabalho realizado na Universidade Federal de São Paulo, São Paulo, SP, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter