

Original Article - Year 2013 - Volume 28 -
Seroma tardio após implantes mamários de silicone: três formas diferentes de apresentação, evolução e conduta
Late seroma after silicone breast implants: three different forms of presentation, evolution, and approach
RESUMO
INTRODUÇÃO: Os seromas tardios após mamoplastia de aumento são ocorrências pouco comuns, que podem se manifestar sem causa definida e cujo tratamento implica a retirada ou a troca das próteses. Este trabalho objetiva analisar 3 casos dessa complicação, ocorrida entre 1 ano e 10 anos de pós-operatório, tratados de formas distintas.
MÉTODO: Foram analisados os dados de 3 pacientes que apresentaram seroma no pós-operatório tardio de inclusão de próteses de mama. Neste artigo são apresentados dados relativos a indicação da inclusão, tempo de evolução sem complicações, tipo de prótese e resultado da análise do material retirado ou drenado.
RESULTADOS: Em 2 pacientes, foi realizada retirada bilateral das próteses, apesar de somente um dos lados ter sido afetado; na terceira paciente, procedeu-se à troca da prótese por outra de mesmo volume e tipo. Um dos casos foi diagnosticado como pus estéril.
CONCLUSÕES: Previamente à inclusão de próteses mamárias, a paciente deve ser alertada para o fato de que sua decisão poderá ter implicações futuras, sendo, eventualmente, necessário trocá-las ou retirá-las, o que resultará em novas cirurgias e/ou novas cicatrizes.
Palavras-chave: Implante mamário/efeitos adversos. Seroma. Mama/cirurgia. Mamoplastia.
ABSTRACT
BACKGROUND: Late seromas after augmentation mammaplasty are uncommon, can manifest without a defined cause, and can be treated by implant removal or replacement. This study aimed to analyze three cases of this complication that occurred 1-10 years postoperatively and were treated differently.
METHODS: Data of three patients who developed late seroma after breast implant placement were analyzed. In this report, we present data on the indication for implant placement, time without complications, implant type, and the analytical results of the removed or drained material.
RESULTS: Two patients underwent bilateral implant removal, although only one side was affected, and the implant was replaced with another of the same type and volume in the third patient. One case of sterile pus was diagnosed.
CONCLUSIONS: Before undergoing breast implant surgery, patients should be informed of the implications of their decisions, such as the possible need to remove or replace them, resulting in more surgical procedures and/or new scars.
Keywords: Breast implantation/adverse effects. Seroma. Breast/surgery. Mammaplasty.
Há várias décadas, a mamoplastia de aumento vem se tornando cada vez mais frequente no Brasil e no mundo, com resultados melhores e mais seguros. Não se pode esquecer, no entanto, que o procedimento envolve a utilização de um corpo estranho e está sujeito a intercorrências diferentes das de outros tipos de cirurgia. Cunningham et al.1 citam como complicações recentes mais comuns cicatrizes hipertróficas, hematomas, seromas, deiscências e infecção. Dentre as complicações tardias estão assimetrias, alterações no contorno, contratura, hiper ou hipossensibilidade, deflação (em próteses salinas) ou ruptura.
Seromas são complicações tardias pouco comuns, que podem se manifestar sem causa definida e cujo tratamento implica a retirada ou a troca das próteses. Se a etiologia é imprecisa, não há profilaxia eficaz e as pacientes devem ser advertidas sobre a possibilidade de ocorrências desfavoráveis no pós-operatório a médio e longo prazos.
Este trabalho objetiva analisar 3 casos dessa complicação, ocorrida entre 1 ano e 10 anos de pós-operatório, tratados de formas distintas.
MÉTODO
Foram analisados os dados de 3 pacientes que apresentaram seroma no pós-operatório tardio de inclusão de próteses mamárias.
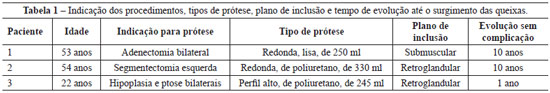
As pacientes tinham 53 anos, 54 anos e 22 anos de idade.
Nenhuma paciente apresentava doenças associadas prévias ou alergias. A indicação de inclusão de prótese foi por ressecção de parênquima mamário ou hipoplasia glandular. Os tipos de prótese, os volumes, o plano de inclusão e o tempo de evolução até o surgimento das queixas são apresentados na Tabela 1.
RESULTADOS
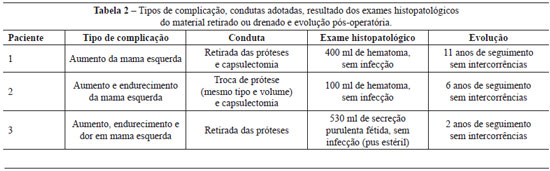
Na Tabela 2 são destacados os tipos de complicação, as condutas adotadas, o resultado dos exames histopatológicos do material retirado ou drenado e o tempo de acompanhamento pós-operatório.
Em 2 pacientes, foi realizada retirada bilateral das próteses, apesar de somente um dos lados ter sido afetado; na terceira paciente, procedeu-se à troca da prótese por outra de mesmo volume e tipo.
Não houve complicações durante o seguimento pós-operatório imediato das pacientes.
As Figuras 1 a 3 ilustram os casos relatados.
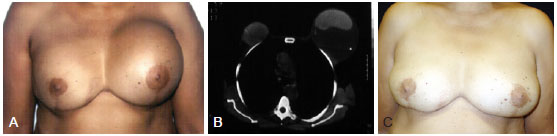
Figura 1 - Paciente de 53 anos submetida, há 10 anos, a adenectomia bilateral por doença fibrocística e inclusão de próteses de silicone lisas, redondas, de 250 ml, em plano submuscular. Em A, autoexpansão mamária à esquerda. Em B, tomografia computadorizada. Em C, aspecto pós-operatório tardio (11 anos), apenas com modelagem dos tecidos locais.
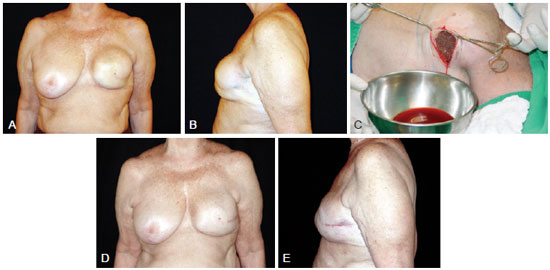
Figura 2 - Paciente de 54 anos submetida, há 10 anos, a segmentectomia esquerda por câncer mamário e inclusão de prótese redonda de poliuretano, de 330 ml, em plano retroglandular. Em A e B, autoexpansão mamária à esquerda, respectivamente, em vista frontal e perfil esquerdo. Em C, aspecto do líquido serossanguinolento drenado. Em D e E, aspecto de pós-operatório de 6 anos, feita a substituição da prótese no mesmo ato cirúrgico, respectivamente, em vista frontal e perfil esquerdo.
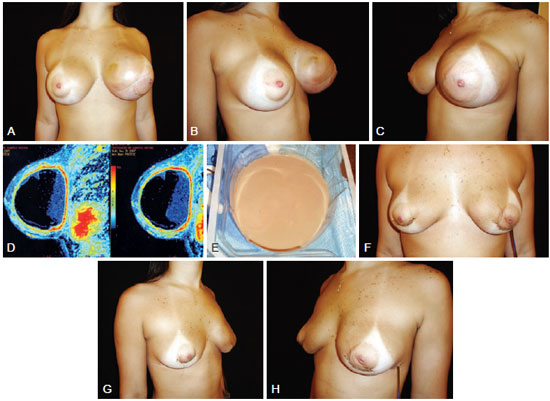
Figura 3 - Paciente de 22 anos, submetida, há 1 ano, a inclusão de próteses de poliuretano com finalidade estética, com perfil alto, de 245 ml, em plano retroglandular. Em A, B e C, autoexpansão mamária à esquerda, respectivamente, em vista frontal, perfil direito e perfil esquerdo. Em D, ressonância magnética. Em E, aspecto do líquido coletado (pus estéril). Em F, G e H, aspecto no 4º dia de pós-operatório da retirada de ambas as próteses, respectivamente, em vista frontal, perfil direito e perfil esquerdo.
DISCUSSÃO
Várias complicações precoces ou tardias podem ocorrer após implante mamário. Coleções líquidas, séricas, hemáticas ou purulentas surgem, com mais frequência, precocemente. Os hematomas e as infecções devem ser tratados imediatamente, com ou sem retirada das próteses. Coleções líquidas (seromas), quando de pequena monta, são bastante comuns e nem sempre sintomáticas. Ahn et al.2 encontraram fluido intracapsular em 21% das pacientes que fizeram troca de implante por causas variadas. Mesmo coleções mais volumosas, se não complicadas, podem ser esvaziadas por punção com orientação ultrassonográfica.
A incidência de infecção varia entre os autores e não tem ocorrido em nossa experiência. Netscher et al.3 encontraram culturas positivas em 27,3% de pacientes cujas próteses haviam sido retiradas por outros motivos, na ausência de sinais clínicos de infecção, sendo mais frequentes os estafilococos coagulase negativa e difteroides anaeróbicos. As estratégias de tratamento também são variadas, podendo ir desde antibioticoterapia simples até retirada da prótese.
Em 1999, Holmich et al.4 selecionaram ao acaso 271 mulheres com implantes mamários com pelo menos 3 anos de acompanhamento pós-operatório e as submeteram a ressonância magnética. Em 2001, repetiram o exame e encontraram 33 (12,2%) rupturas confirmadas e 23 (8,5%) supostas rupturas. Esses autores observaram que o índice de ruptura aumenta com o passar do tempo, esperando-se que, no mínimo, 15% dos implantes modernos apresentem ruptura 3 anos a 10 anos após a cirurgia.
Brandon et al.5 afirmaram que as rupturas de prótese podem ocorrer antes ou durante a inserção, durante a remoção ou in situ. Embora muito se discuta sobre a resistência natural das próteses e sua durabilidade, os autores acreditam que algumas rupturas ocorrem no manuseio pré ou peroperatório, durante a inclusão, ou quando da eventual retirada, pelo contato acidental com instrumentos cirúrgicos ou por abrasão da superfície do implante na passagem através de incisões muito pequenas. No caso das próteses de silicone coesivo, pequenas lesões podem passar despercebidas, pela própria característica desse tipo de silicone, que tem escape mínimo. Os autores produziram diferentes lesões intencionais em próteses de laboratório, e utilizaram a microscopia eletrônica para diagnosticar o tipo de ruptura que cada instrumento produziu. A melhor compreensão dos vários mecanismos que podem levar à ruptura, diferentes da degradação do elastômero, pode auxiliar na produção de próteses com melhor desenho e maior durabilidade.
Os seromas tardios após implantes mamários são raros e poderiam ser sinal de ruptura da prótese, embora o número reduzido de casos relatados não permita afirmá-lo categoricamente6. Coleção serosa ou serossanguinolenta é o achado mais frequente. Pus estéril tem sido ainda mais raramente observado e ocorreu em um dos casos reportados neste artigo.
O primeiro relato de hematoma tardio parece ter sido realizado por Georgiade et al.7, em 1979, que identificou a complicação 2 anos e meio após a inclusão de prótese de silicone lisa, de 185 ml e conteúdo salino. A exploração cirúrgica colheu 300 ml de sangue proveniente de artéria em sangramento ativo. A cultura foi estéril. Os autores atribuíram o sangramento ao uso de triancinolona durante a inclusão, para prevenção de contratura capsular.
Gorgu et al.8 afirmaram que os casos de hematomas tardios são raros (segundo os autores, 4 casos até a publicação do artigo, em 1999) e apresentaram 1 caso, 3 anos após a inclusão de prótese texturizada de conteúdo salino, em plano subpeitoral, com utilização de corticoide intracapsular, ao qual atribuíram a etiologia, implicando também o atrito entre a prótese e a cápsula fibrosa.
Brickman et al.9 relataram 1 caso de hematoma 9 anos após a inclusão de próteses de poliuretano de 385 ml. Atribuíram a patogênese dos hematomas tardios a reações inflamatórias prolongadas com aumento da permeabilidade capilar (teoria de Labardie e Glover para hematomas subdurais), que seriam mais acentuadas nos casos de revestimento com poliuretano. Esses hematomas, entretanto, também foram relatados em próteses lisas ou texturizadas8,10.
Roman & Perkins11 analisaram algumas teorias para explicar os hematomas tardios que poderiam resultar de microfraturas, provocando sangramento em cápsulas rígidas que não conseguiriam retrair para conter os vasos sangrantes. O acúmulo de líquido também poderia estar relacionado a efeito osmótico secundário a processo inflamatório. Também relataram 1 caso de hematoma ocorrido 22 anos após a inclusão de próteses mamárias.
Pinchuk & Tymofii12 relataram 6 casos de seroma tardio, ocorridos entre 2 anos e 10 anos de pós-operatório, em casuística de 568 pacientes que fizeram inclusão de próteses mamárias. Na opinião dos autores, o atrito da prótese contra a superfície interna da cápsula orgânica contribui para a metaplasia sinovial dessa superfície, a presença de infecção crônica e a consequente formação de seroma.
Robinson et al.13, utilizando próteses salinas, observaram 14 casos de expansão espontânea entre 3 mil pacientes. As culturas do líquido foram todas negativas. O exato mecanismo que provoca esse aumento de volume não é perfeitamente conhecido, inclusive porque pode ocorrer apenas de um lado. Usando eletroforese bidimensional e espectrometria de massa, esses autores encontraram nesse líquido 4 proteínas conhecidas, sendo prevalente a albumina sérica, além de outras a serem identificadas. Afirmam que a expansão espontânea deve ser mais frequente do que é relatada.
Peters14, também analisando autoexpansão em próteses salinas, discutiu a possibilidade de gradientes osmóticos entre o organismo e o líquido usado para o preenchimento das próteses, mas considerou mais provável que a causa seja decorrente de alterações mecânicas das válvulas.
Ao contrário dos casos com próteses de silicone, nas próteses salinas o aumento de volume ocorreu no interior da prótese e não em seu contorno. Não parece haver correlação entre a autoexpansão à custa do aumento intraprótese e a verificada em decorrência de seroma no contorno das próteses com gel de silicone em seu conteúdo.
Khan6 relatou 5 casos consecutivos de expansão espontânea por pus estéril, entre 2 anos e 10 anos após a colocação de prótese de silicone (3 casos) ou hidrogel (2 casos). Em todos os casos, o líquido coletado era estéril. Quatro implantes estavam rotos e o quinto implante evidenciou pequena ruptura ao microscópio. Todas as pacientes foram operadas em tempo único, as lojas foram lavadas, as cápsulas removidas e as próteses trocadas, mudando a loja para o plano submuscular. Não foram referidas complicações e a evolução foi satisfatória.
Nos 3 casos relatados neste artigo, o conteúdo foi estéril, mas de características diferentes: sangue com grumos e coágulos, na primeira paciente; serossanguinolento, na segunda paciente; e pus estéril, na terceira paciente. As próteses também foram diferentes, lisas no primeiro caso e com cobertura de poliuretano nos outros dois. Na literatura, parece não haver nexo causal do seroma tardio com tamanho da prótese, tipo de revestimento, via de acesso ou plano de inclusão. O que é notório é que os hematomas tardios, embora pouco frequentes, são muito mais comuns9,10,15 que as coleções de pus estéril, estas sim bastante raras6.
Spear et al.16 analisaram 24 pacientes, compreendendo 26 próteses afetadas por infecção ou exposição. Nos casos sem infecção ou com infecção leve, conseguiram salvar o implante em 94,7% das pacientes (18 em 19 pacientes); e nos casos de infecção grave, a porcentagem caiu para 28,5% (2 de 7 pacientes). Denominaram "salvar o implante" quando a paciente saiu da cirurgia com uma prótese, a mesma que já havia ou outra que a substituiu. Seus métodos incluíram antibioticoterapia sistêmica, curetagem, capsulectomia, e troca da loja ou da prótese. Embora sejam válidas as tentativas de salvar as próteses, consideraram que sua remoção e posterior reinserção ainda é a conduta mais segura.
A necessidade de retirar próteses, sobretudo as colocadas por motivos estéticos, é sempre uma decisão difícil para o cirurgião e um trauma emocional para a paciente. Quando decidir pela retirada de uma prótese e como lidar com pacientes que passam por tal frustração são habilidades que devem fazer parte do arsenal de qualquer cirurgião plástico. Conduta conservadora é sempre a primeira opção. Quando se opta pela intervenção, se não há sinais de infecção, alguns autores decidem trocar as próteses após retirada das cápsulas6,16. Essa foi a conduta adotada no segundo caso relatado neste artigo. No primeiro caso, a paciente optou por retirada definitiva e modelagem com o tecido remanescente15.
No terceiro caso relatado neste artigo, entretanto, a evolução foi dramática, os sintomas foram intensos e a própria paciente entendeu que a solução dependeria da retirada do implante. Essa mudança psicológica auxiliou no suporte emocional imediato. Khan6, cujos trabalhos também analisavam autoexpansão em presença de pus estéril, refere ter substituído as próteses após capsulectomia, resolvendo o problema em tempo único. Embora refira sucesso, essa conduta parece imprudente diante das características do líquido, pois o resultado das culturas não é imediato, e, ainda que não houvesse sintomas de infecção, o aspecto purulento é preocupante. Em nossa paciente, inclusive, havia odor fétido, não esclarecido. Preferimos postergar nova inclusão por ao menos 6 meses, se e quando a paciente desejasse.
Uma dúvida que sempre surge é o que fazer com o lado contralateral, em que a prótese está normal. A melhor conduta nos parece ser sua retirada, caso contrário persistirá uma assimetria difícil de disfarçar e que manterá a paciente em permanente lembrança da complicação ocorrida. Entretanto, é preciso discutir com a paciente todas as implicações dessa decisão, que vão desde a forma desfavorável resultante, nas mamas que continham próteses grandes não substituídas, até a presença de cicatrizes, caso se opte por modelar o tecido existente. No primeiro caso relatado neste artigo, a paciente não desejava novas próteses e a modelagem resultou em forma satisfatória, graças à abundância de tecido local15. No segundo caso, a coleção era de líquido claro, em pequeno volume, sem sinais de infecção, permitindo a troca imediata da prótese. No terceiro caso, talvez por se tratar de paciente jovem, a retirada das próteses de 245 ml não trouxe maior deformidade, ficando as mamas com aspecto semelhante ao de antes de sua colocação.
Seromas tardios após inclusão de próteses mamárias têm ocorrido tanto em próteses de silicone6,9,15 como em próteses salinas7,13,14. Nas próteses de silicone, a coleção se localiza no exterior da prótese. Suposições etiológicas apontam ruptura da prótese, atrito entre a prótese e a loja orgânica, processo inflamatório crônico, e metaplasia da face interna da cápsula, entre outras. Nas próteses salinas, a expansão ocorre no interior da prótese, possivelmente pela presença de gradientes osmóticos entre o organismo e o líquido usado para o preenchimento.
CONCLUSÕES
Previamente à inclusão de próteses mamárias, a paciente deve ser alertada para o fato de que sua decisão poderá ter implicações futuras, sendo, eventualmente, necessário trocá-las ou retirá-las, o que resultará em novas cirurgias e/ou novas cicatrizes. A gratificação que essa cirurgia proporciona é grande o suficiente para valer o pequeno risco, mas as informações adequadas e o termo de consentimento esclarecido serão fundamentais para o suporte emocional das pacientes em caso de complicações.
REFERÊNCIAS
1. Cunnigham BL, Lokeh A, Gutowski KA. Saline-filled breast implant safety and efficacy: a multicenter retrospective review. Plast Reconstr Surg. 2000;105(6):2143-9.
2. Ahn CY, Ko CY, Wagar EA, Wong RS, Shaw WW. Clinical significance of intracapsular fluid in patients' breast implants. Ann Plast Surg. 1995;35(5):455-7.
3. Netscher DT, Weizer G, Wigoda P, Walker LE, Thornby J, Bowen D. Clinical relevance of positive breast periprosthetic cultures without overt infection. Plast Reconstr Surg. 1995;96(5):1125-9.
4. Holmich LR, Friis S, Fryzek J, Vejborg IM, Conrad C, Sletting S, et al. Incidence of silicone breast implant rupture. Arch Surg. 2003;138(7):801-6.
5. Brandon HJ, Young VL, Jerina KL, Wolf CJ. Scanning electron microscopy characterization of surgical instrument damage to breast implants. Plast Reconstr Surg. 2001;108(1):52-61.
6. Khan UD. Breast autoinflation with sterile pus as a marker of implant rupture: single-stage treatment and outcome for five consecutive cases. Aesthetic Plast Surg. 2009;33(1):58-65.
7. Georgiade NG, Serafin D, Barwick W. Late development of hematoma around a breast implant, necessitating removal. Plast Reconstr Surg. 1979;64(5):708-10.
8. Gorgu M, Aslan G, Tuncel A, Erdogan B. Late and long-standing capsular hematoma after aesthetic breast augmentation with a saline-filled silicone prosthesis: a case report. Aesthetic Plast Surg. 1999;23(6):443-4.
9. Brickman M, Parsa NN, Parsa FD. Late hematoma after breast implantation. Aesthetic Plast Surg. 2004;28(2):80-2.
10. Veiga DF, Veiga Filho J, Schnaider CS, Archangelo I Jr. Late hematoma after aesthetic breast augmentation with textured silicone prosthesis: a case report. Aesthetic Plast Surg. 2005;29(5):431-3.
11. Roman S, Perkins D. Progressive spontaneous unilateral enlargement of the breast twenty-two years after prosthetic breast augmentation. Br J Plast Surg. 2005;58(1):88-91.
12. Pinchuk V, Tymofii O. Seroma as a late complication after breast augmentation. Aesthetic Plast Surg. 2011;35(3):303-14.
13. Robinson OG Jr, Benos DJ, Mazzochi C. Spontaneous autoinflation of saline mammary implants: further studies. Aesthet Surg J. 2005;25(6):582-6.
14. Peters W. Autoinflation of saline-filled inflatable breast implants. Can J Plast Surg. 2006;14(4):219-26.
15. Franco D, Medeiros J, Destefani V, Franco T. Hematoma tardio após reconstrução de mama com prótese de silicone. Rev Soc Bras Cir Plást. 2006;21(4):227-30.
16. Spear SL, Howard MA, Boehmler JH, Ducic I, Low M, Abbruzzesse MR. The infected or exposed implant: management and treatment strategies. Plast Reconstr Surg. 2004;113(6):1634-44.
1. Cirurgiã plástica, membro titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), membro da Academia Nacional de Medicina, mestre e doutora em Cirurgia Plástica, professora titular de Cirurgia Plástica da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil
2. Cirurgião plástico, membro titular da SBCP, mestre e doutor em Cirurgia Plástica pela UFRJ, professor adjunto da UFRJ, Rio de Janeiro, RJ, Brasil
Correspondência para:
Talita Franco
Rua Ramon Franco, 98 - Urca
Rio de Janeiro, RJ, Brasil - CEP 22250-040
E-mail: talita@openlink.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 24/10/2012
Artigo aceito: 1º/3/2013
Trabalho realizado na Universidade Federal do Rio de Janeiro, Rio de Janeiro, RJ, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter