

Original Article - Year 2014 - Volume 29 -
Avaliação do índice de infecção de implantes mamários utilizados na reconstrução de mama do Instituto do Câncer do Estado de São Paulo
Evaluation of the infection rate of implants used for breast reconstruction at the Cancer Institute of the State of São Paulo
RESUMO
INTRODUÇÃO: A utilização de implante mamário é a forma de reconstrução de mama mais comumente realizada. Apesar de suas vantagens, a infecção do implante, seja este expansor tecidual ou prótese mamária, pode ser um problema significativo, incluindo a necessidade de sua retirada. O objetivo deste trabalho é avaliar o índice de infecção de implantes mamários utilizados na reconstrução de mama de pacientes operadas no Instituto do Câncer do Estado de São Paulo (ICESP), bem como sua correlação com aspectos clínicos, oncológicos e cirúrgicos.
PACIENTES E MÉTODOS: Estudo retrospectivo de 120 pacientes submetidas à reconstrução mamária com implante mamário no ICESP, no período de fevereiro de 2009 a março de 2010.
RESULTADOS: O índice de infecção foi de 24,3% e esteve relacionado estatisticamente a reconstrução imediata (88,9%), diabetes mellitus (25%), IMC acima de 30 (52,8%), HAS (52,8%) e sofrimento de pele da mastectomia (27,8%). Nota-se que 44% dos implantes infectados foram retirados, sendo a maioria expansores colocados em reconstrução imediata.
CONCLUSÕES: A reconstrução mamária com implante é uma forma segura e eficaz de tratamento. Deve-se, entretanto, estar atento aos subgrupos de pacientes mais propensas ao desenvolvimento de infecção, para otimizar a sua prevenção e atentar ao seu tratamento precoce.
Palavras-chave: Câncer de mama; Expansor/Implante mamário; Infecção.
ABSTRACT
INTRODUCTION: Placement of breast implants is the most commonly used form of breast reconstruction. Despite its advantages, infection of the implant, either in the tissue expander or mammary prosthesis, can be a significant problem, including the need to remove it. The objective of this work is to evaluate the infection rate of breast implants used for breast reconstruction in patients submitted to surgery at the Cancer Institute of the State of São Paulo (ICESP), as well as its correlation with clinical, oncological, and surgical factors.
PATIENTS AND METHODS: This is a retrospective study on 120 patients submitted to breast reconstruction with breast implants at the ICESP from February 2009 to March 2010.
RESULTS: The infection rate (24.3%) was statistically related to immediate reconstruction (88.9%), diabetes mellitus (25%), body mass index >30 (52.8%), systemic arterial hypertension (52.8%), and skin injury due to mastectomy (27.8%). Of the infected implants, 44% were removed, most of which were expanders placed during immediate reconstruction.
CONCLUSIONS: Breast reconstruction with implants is the safest and most effective form of treatment. However, consideration should be given to patients who are prone to the development of infection, in order to optimize its prevention and attempt to perform its treatment at an early stage.
Keywords: Breast cancer; Expander/Breast implant; Infection.
A utilização de implante mamário é a forma de reconstrução de mama mais comumente realizada1,2. Tem a vantagem de ser um procedimento simples, com baixa morbidade e menor tempo cirúrgico, além de tornar a recuperação pós-operatória mais rápida e eliminar a morbidade da área doadora2,3. Entretanto, a infecção do implante pode ser um problema significativo, incluindo a necessidade de sua retirada, o aumento do número de procedimentos cirúrgicos e o atraso da terapia oncológica4,5. A identificação e a prevenção dessa complicação podem reduzir a morbidade da paciente e os custos hospitalares2.
As complicações inerentes à reconstrução de mama com material aloplástico e sua relação com as características clínicas da paciente e com aspectos cirúrgicos e oncológicos do tratamento do câncer de mama são assuntos amplamente estudados1,3,4,6-11. No entanto, poucos trabalhos fazem a análise de maneira clara e reprodutível. A definição de complicação também é de difícil correlação entre os trabalhos existentes.
Apenas três trabalhos abordam isoladamente a infecção após a colocação de implante mamário. Olsen et al.9 estratificam, de forma abrangente, a relação da infecção com várias características clínicas das pacientes, tipo do tumor, terapia oncológica empregada, aspectos cirúrgicos e antibioticoprofilaxia utilizada. Entretanto, essa relação inclui também pacientes submetidas à mastoplastia de aumento com objetivo estético. Nahadedian et al.12 não fazem diferenciação entre os casos de reconstrução mamária imediata e tardia, além de não realizarem análise estatística da infecção ou das características clínicas das pacientes. Francis et al.2, em estudo retrospectivo, não incluem em suas análises de reconstruções com prótese mamária e alguns aspectos inerentes ao procedimento cirúrgico.
Com o objetivo de avaliar a infecção de implantes utilizados na reconstrução de mama de pacientes operadas no Instituto do Câncer do Estado de São Paulo (ICESP), foi conduzido estudo de diversos aspectos relacionados às características clínicas das pacientes, aspectos técnicos cirúrgicos, métodos de tratamento oncológico e às demais complicações pós-operatórias.
MÉTODO
Pacientes
Estudo retrospectivo de 120 pacientes submetidas à reconstrução mamária com expansor e/ou implante mamário no ICESP, durante o período de fevereiro de 2009 a março de 2010, e com acompanhamento mínimo de um ano. Foram coletados dados referentes às características clínicas e aos hábitos de vida das pacientes no momento da cirurgia; aspectos técnicos cirúrgicos relacionados a ressecção e a reconstrução; tratamento oncológico clínico implementado em cada caso e eventuais complicações pós-operatórias seguidas de seus tratamentos, com o intuito de correlacioná-los ao índice de infecção dos implantes mamários, identificando os aspectos mais relevantes.
As características clínicas das pacientes e os fatores inerentes ao procedimento cirúrgico encontram-se na Tabela 1. Cento e vinte mulheres foram submetidas à colocação de 148 expansor e/ou implante mamários (99 expansores e 67 implantes mamários). A idade variou de 31 a 79 anos, com média de 51,9 e mediana de 52.

Técnica cirúrgica
A maioria das pacientes foi operada pela equipe de mastologia e recebeu o tratamento oncológico clínico no próprio ICESP. Algumas pacientes, entretanto, vieram encaminhadas de outras instituições para dar continuidade aos tratamentos clínico (quimioterapia/radioterapia) e cirúrgico (reconstrução mamária).
As reconstruções mamárias foram realizadas pela equipe de cirurgia plástica do hospital. Os expansores utilizados foram Mentor, Siltex 6200, de válvula integrada e Becker, escolhidos conforme a base da mama da paciente. Os implantes utilizados também foram da Mentor, anatômicos (CPG), e o tamanho escolhido foi baseado no volume de expansão final obtido comparativamente com a mama oposta, assim como a altura e a base desta.
A loja dos expansores e/ou implantes foi confeccionada em plano retromuscular total, através de dissecção dos músculos peitoral maior e serrátil anterior, ou de rotação de retalho miocutâneo do músculo grande dorsal (latíssimo do dorso). A colocação dos expansores e/ou implantes foi precedida de limpeza da loja com solução de antibiótico (cefazolina 1 g + gentamicina 80 mg + SF 100 mL) e limpeza da pele com solução de clorexidina alcoólica. Os expansores foram preenchidos com solução de 5 mL de azul de metileno e 35 mL de soro fisiológico. As expansões subsequentes foram realizadas de forma asséptica, em regime ambulatorial, e o volume infundido não ultrapassou 100 mL em cada sessão. O momento da troca do expansor pelo implante foi individualizado. A decisão levou em conta a expansão ideal dos tecidos e o término da terapia adjuvante, quando realizadas. Adotou-se como intervalo mínimo para troca seis meses após o término da radioterapia.
Os drenos foram posicionados nas lojas subcutânea e axilar, quando houve esvaziamento linfonodal axilar concomitante, e retirados assim que o volume de drenagem foi inferior a 30 mL/dia.
A antibioticoprofilaxia foi realizada através de infusão de 2 g de cefazolina na indução anestésica, seguida de 1 g adicional a cada três horas de cirurgia, seguido de terapia com cefalosporina de primeira geração, por mais sete dias.
Infecção
Infecção foi definida de acordo com os critérios padronizados pelo CDC/NHSN13. Foi considerado o aparecimento de sinais, como hiperemia, dor, edema, enduração, febre, secreção, coleção, deiscência e exposição do expansor e/ou implante, durante o período de um ano de acompanhamento pós-operatório.
Análise estatística
Os dados foram analisados através do programa Epi Info versão 7.0. O valor de 'p' estatístico foi definido através de mid-p exact test e Fisher exact test.
RESULTADOS
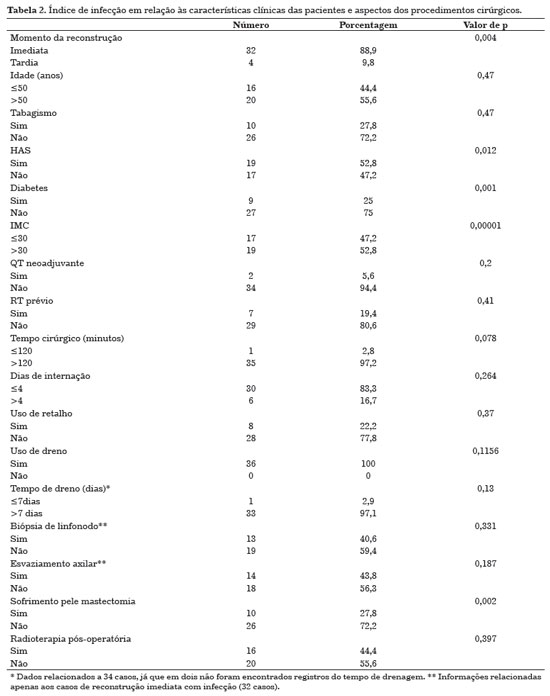
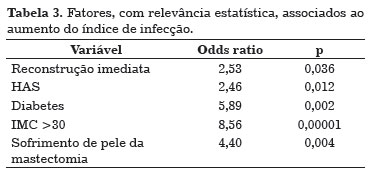
Infecção ocorreu em 24,3% (n=36) dos implantes utilizados e sua relação com as características clínicas das pacientes e os aspectos cirúrgicos pode ser observada na Tabela 2. Fatores estatisticamente relacionados à infecção estão relacionados na Tabela 3.
Dos 32 casos de infecção ocorridos em reconstrução imediata, 28 aconteceram após colocação de expansor e quatro, após implante. Em relação à reconstrução tardia (quatro casos de infecção), um ocorreu em expansor e três, em implantes.
Idade acima de 50 anos, tabagismo, hipertensão arterial, diabetes e IMC acima de 30 tiveram relação com aumento dos casos de infecção, porém apenas os três últimos fatores foram estatisticamente significativos.
Duas pacientes fizeram quimioterapia neoadjuvante, assim como oito já haviam sido irradiadas antes da cirurgia. Reconstrução imediata (85,7%) e sofrimento de pele da mastectomia (25,7%) estiveram relacionados ao aumento do índice de infecção, com valor de p significativo. A infecção do implante e/ou expansor ocorreu na maioria dos procedimentos com mais de duas horas de duração (97,2%), em 30 que necessitaram de menos de quatro dias de internação (83,3%) e em oito cirurgias em que se usou retalho para cobertura do implante e/ou expansor (22,2%). O uso de dreno foi feito em todos os procedimentos que evoluíram com infecção e, dos 34 prontuários que tinham informações sobre o tempo de drenagem, quase todos (97,1%) foram retirados com mais de sete dias. A biopsia de linfonodo foi realizada em 13 (37,1%) reconstruções imediatas que evoluíram com infecção e o esvaziamento axilar, em 12 (34,3%). Quatorze pacientes (40%) receberam radioterapia no pós-operatório. A Tabela 3 mostra os fatores associados à infecção com significância estatística.
Houve infecção em três mamas simetrizadas, sendo que duas utilizaram implante mamário e uma foi concomitante com a infecção da mama contralateral reconstruída.
Dezessete implantes e/ou expansores (11,5% do total colocado) necessitaram ser retirados, sendo 16 (10,8% do total) devido à infecção e um por extrusão secundária à deiscência de sutura. Dos 16 que evoluíram com infecção, dois também apresentaram extrusão do expansor e/ou implante: um evoluiu da mesma forma devido à necrose do retalho de grande dorsal e em outro, houve recidiva tumoral com necessidade de nova intervenção cirúrgica pela mastologia, Note-se que, em outro caso, ocorreu infecção após um ano e quatro meses da reconstrução mamária e em vigência de radioterapia adjuvante.
Quimioterapia e radioterapia adjuvantes foram realizados em todas e em 14 pacientes que evoluíram com infecção, respectivamente. O tempo médio entre a cirurgia e o início do tratamento oncológico adjuvante nas pacientes que cursaram com infecção da reconstrução foi de 3,5 meses para a quimioterapia e 8,9 meses, para a radioterapia.
Das pacientes que tiveram seus implantes retirados por causa da infecção, duas (12,5%) receberam quimioterapia neoadjuvante e uma (6,3%) recebeu radioterapia antes da cirurgia.
DISCUSSÃO
A indicação da reconstrução mamária é realizada de acordo com aspectos anatômicos, extensão tumoral e preferências tanto da paciente quanto do cirurgião. Inúmeras são as técnicas de reconstrução pósmastectomia e o uso de expansores e implantes tem tido boa aceitação nos últimos 50 anos. Entretanto, o risco de infecção relacionado ao expansor e/ou implante é bem conhecido e pode ocorrer a qualquer momento depois de sua inserção.
A idade média das pacientes (51,90) deste estudo reflete uma população cada vez mais jovem a apresentar câncer de mama, corroborando a literatura4,7. Além disso, tem se tornado cada vez mais comum a cirurgia redutora de risco em pacientes de alto risco para o desenvolvimento de câncer de mama, o que contribui para o aumento do número de reconstruções mamárias com implantes. Apesar de o índice de infecção em implantes utilizados em reconstrução mamária ser altamente variável, o valor de 24,3% encontrado nesse trabalho corrobora os dados da literatura12,14,15, principalmente devido ao número elevado de reconstruções imediatas (72,3%). Este tipo de reconstrução tem sido popularizado, uma vez que não demonstra prejuízo em relação à segurança oncológica e com a qualidade cirúrgica, além de contribuir para a autoestima da paciente.
A maioria dos trabalhos encontrados na literatura analisa os aspectos da reconstrução mamária com implante em relação às complicações gerais, não sendo a infecção analisada isoladamente. Consideram-se como complicação, além da infecção, os seguintes quadros: seroma, hematoma, contratura capsular, perda do implante, necrose de pele da mastectomia, atraso de cicatrização da ferida operatória e falha da expansão. Como há variação na inclusão desses eventos como complicações, a comparação com as análises dos estudos referidos é dificultado. Além disso, é importante ressaltar que existe diferença na seleção das pacientes e no tipo de reconstrução incluída nos trabalhos, o que também prejudica a homogeneidade dos resultados. Roostaeian et al.6 avaliam apenas as reconstruções imediatas com prótese mamária e consideram, como complicações, necrose da pele da mastectomia, infecção, hematoma, seroma e contratura capsular, e não mostram relação entre aumento do risco de complicações e os aspectos clínicos. McCarthy et al.4 analisaram todas as reconstruções mamárias com expansor e/ou implantes realizadas entre janeiro de 2003 e dezembro de 2004. Associaram o aumento do risco de complicações a pacientes de idade maior que 65 anos, hipertensas, tabagistas e com IMC maior que 30, após incluírem, como complicações, necrose da pele da mastectomia, seroma, hematoma, infecção, falha de expansão e exposição do expansor e/ou implante. Crosby et al.7 avaliam apenas as reconstruções mamárias imediatas, unilaterais e que utilizaram expansor. Consideram, como complicação, perda do expansor, infecção, seroma, hematoma, necrose da pele da mastectomia e atraso de cicatrização de ferida operatória. Encontram relação entre o aumento de risco de complicação com fatores, como tempo prolongado de drenagem, esvaziamento axilar, mastectomia radical modificada (em comparação com mastectomia simples) e grande volume de expansão intraoperatória.
Poucos são os trabalhos que analisam a infecção de implantes utilizados em reconstrução mamária como fator isolado. Além disso, esses estudos diferem primariamente no critério de inclusão das pacientes, o que dificulta a comparação dos resultados. Francis et al.2 selecionam, em seu trabalho, apenas reconstruções imediatas com expansor tecidual. Olsen et al.9 incluem todos os implantes usados em reconstruções mamárias, bem como os utilizados em mastoplastia redutora. Nahabedian et al.12 selecionam suas pacientes de forma semelhante a este estudo, considerando pacientes de reconstrução mamária imediata e tardia, com utilização de expansor e implante. No entanto, não esclarecem os critérios de definição de infecção. Em nosso estudo, consideramos, como critérios de diagnóstico de infecção, os estabelecidos no consenso publicado em 2008 pelo CDC (Center for Disease and Control and Prevention)13.
A escolha da infecção como fator de análise neste trabalho foi devido ao fato de ser a complicação mais frequente nas reconstruções mamárias com material aloplástico e por resultar em até 40% de remoção dos mesmos10.
Os fatores preditivos de aumento do risco de infecção em reconstrução mamária com material aloplástico foram: reconstrução imediata, diabetes melitus, IMC acima de 30, hipertensão arterial sistêmica e sofrimento de pele da mastectomia. Aproximadamente 44% (n=16) dos expansores/implantes infectados precisaram ser retirados, sendo que a maioria ocorreu em reconstrução imediata (n=15) e após reconstrução com expansor mamário (n=14).
Apesar de, neste trabalho, não ter sido encontrada relação estatística entre infecção e tratamento oncológico adjuvante, vale notar que todas as pacientes foram submetidas a tratamento adjuvante com quimioterapia e que a maioria (87,5%), que recebeu radioterapia após a cirurgia, evoluiu com infecção do expansor/prótese mamária. Apesar de ser controverso, vários trabalhos mostram que existe um aumento significativo do índice de complicações quando esses tratamentos são necessários6,11,12,16. É importante ressaltar, ainda, que, apesar da infecção, não houve atraso no início da radioterapia e quimioterapia adjuvantes. Isso é relevante, uma vez que a reconstrução mamária ideal não interfere no tratamento oncológico.
Vários fatores têm sido atribuídos ao aumento de complicação pós-operatória após o uso de expansor e/ou implante em reconstrução mamária. Entretanto, existem poucos trabalhos que demonstram a associação desses fatores à infecção como resultado isolado e sua metodologia interfere na comparação fidedigna de seus resultados. A detecção dos aspectos relacionados ao aumento da taxa de infecção pode ajudar na seleção das candidatas à reconstrução com uso de expansor e/ou implante mamário e, assim, evitar a retirada prematura dos mesmos e o atraso da reconstrução.
Demonstramos que as pacientes com maior risco para infecção após reconstrução mamária com material aloplástico são aquelas submetidas à reconstrução imediata, portadoras de diabetes melitus, IMC acima de 30, hipertensas e que evoluem com sofrimento de pele da mastectomia. A estes subgrupos de pacientes, deve ser dada especial atenção quanto à técnica de reconstrução mamária selecionada.
REFERÊNCIAS
1. Serletti JM, Fosnot J, Nelson JA, Disa JJ, Bucky LP. Breast reconstruction after breast cancer. Plast Reconstr Surg. 2011;127(6):124e-35e. http://dx.doi.org/10.1097/PRS.0b013e318213a2e6. PMid:21617423
2. Francis SH, Ruberg RL, Stevenson KB, Beck CE, Ruppert AS, Harper JT, et al. Independent risk factors for infection in tissue expander breast reconstruction. Plast Reconstr Surg. 2009;124(6):1790-6. http://dx.doi.org/10.1097/PRS.0b013e3181bf80aa. PMid:19952635
3. Cordeiro PG, McCarthy CM. A single surgeon's 12-year experience with tissue expander/implant breast reconstruction: part I. A prospective analysis of early complications. Plast Reconstr Surg. 2006;118(4):825-31. http://dx.doi.org/10.1097/01.prs.0000232362.82402.e8. PMid:16980842
4. McCarthy CM, Mehrara BJ, Riedel E, Davidge K, Hinson A, Disa JJ, et al. Predicting complications following expander/implant breast reconstruction: an outcomes analysis based on preoperative clinical risk. Plast Reconstr Surg. 2008;121(6):1886-92. http://dx.doi.org/10.1097/PRS.0b013e31817151c4. PMid:18520873
5. Chun JK, Schulman MR. The infected breast prosthesis after mastectomy reconstruction: successful salvage of nine implants in eight consecutive patients. Plast Reconstr Surg. 2007;120(3):581-9. http://dx.doi.org/10.1097/01.prs.0000270296.61765.28. PMid:17700107
6. Roostaeian J, Pavone L, Da Lio A, Lipa J, Festekjian J, Crisera C. Immediate placement of implants in breast reconstruction: patient selection and outcomes. Plast Reconstr Surg. 2011;127(4):1407-16. http://dx.doi.org/10.1097/PRS.0b013e318208d0ea. PMid:21460648
7. Crosby MA, Dong W, Feng L, Kronowitz SJ. Effect of intraoperative saline fill volume on perioperative outcomes in tissue expander breast reconstruction. Plast Reconstr Surg. 2011;127(3):1065-72. http://dx.doi.org/10.1097/PRS.0b013e31820436fa. PMid:21364408
8. Pinsolle V, Grinfeder C, Mathoulin-Pelissier S, Faucher A. Complications analysis of 266 immediate breast reconstructions. J Plast Reconstr Aesthet Surg. 2006;59(10):1017-24. http://dx.doi.org/10.1016/j.bjps.2006.03.057. PMid:16996422
9. Olsen MA, Lefta M, Dietz JR, Brandt KE, Aft R, Matthews R, et al. Risk factors for surgical site infection after major breast operation. J Am Coll Surg. 2008;207(3):326-35. http://dx.doi.org/10.1016/j.jamcollsurg.2008.04.021. PMid:18722936
10. Yii NW, Khoo CT. Salvage of infected expander prostheses in breast reconstruction. Plast Reconstr Surg. 2003;111(3):1087-92. http://dx.doi.org/10.1097/01.PRS.0000046490.02212.BA. PMid:12621178
11. Mitchem J, Herrmann D, Margenthaler JA, Aft RL. Impact of neoadjuvant chemotherapy on rate of tissue expander/implant loss and progression to successful breast reconstruction following mastectomy. Am J Surg. 2008;196(4):519-22. http://dx.doi.org/10.1016/j.amjsurg.2008.06.016. PMid:18809054
12. Nahabedian MY, Tsangaris T, Momen B, Manson PN. Infectious complications following breast reconstruction with expanders and implants. Plast Reconstr Surg. 2003;112(2):467-76. http://dx.doi.org/10.1097/01.PRS.0000070727.02992.54. PMid:12900604
13. Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control. 2008;36(5):309-32. http://dx.doi.org/10.1016/j.ajic.2008.03.002. PMid:18538699
14. Pittet B, Montandon D, Pittet D. Infection in breast implants. Lancet Infect Dis. 2005;5(2):94-106. http://dx.doi.org/10.1016/S1473-3099(05)01281-8. PMid:15680779
15. Hu YY, Weeks CM, In H, Dodgion CM, Golshan M, Chun YS, et al. Impact of neoadjuvant chemotherapy on breast reconstruction. Cancer. 2011;117(13):2833-41. http://dx.doi.org/10.1002/cncr.25872. PMid:21264833
16. Krueger EA, Wilkins EG, Strawderman M, Cederna P, Goldfarb S, Vicini FA, et al. Complications and patient satisfaction following expander/implant breast reconstruction with and without radiotherapy. Int J Radiat Oncol Biol Phys. 2001;49(3):713-21. http://dx.doi.org/10.1016/S0360-3016(00)01402-4. PMid:11172953
1. Membro Especialista da Sociedade Brasileira de Cirurgia Plástica (SBCP), Médica Assistente da Residência de Cirurgia Plástica do Hospital Universitário São José (HUSJ), Faculdade de Ciências Médicas de Minas Gerais, Belo Horizonte, MG, Brasil
2. Membro Associado da Sociedade Brasileira de Cirurgia Plástica (SBCP), Médico Assistente da Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP/ICESP), São Paulo, SP, Brasil
3. Membro Titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), Médico Assistente da Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP/ICESP), São Paulo, SP, Brasil
4. Membro Titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), Professor Titular da Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil
5. Membro Titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), Doutor pelo Programa da Clínica Cirúrgica da Faculdade de Medicina da Universidade de São Paulo (FMUSP), Coordenador do Grupo de Cirurgia Plástica do Instituto do Câncer do Estado de São Paulo (ICESP), Universidade de São Paulo (USP), São Paulo, SP, Brasil
Instituição: Trabalho realizado no Instituto do Câncer do Estado de São Paulo (ICESP), São Paulo, SP, Brasil.
Autor correspondente:
Patrícia Noronha de Almeida
Faculdade de Ciências Médicas de Minas Gerais (FCMMG)
Rua Patagônia 285/202 - Sion
Belo Horizonte, MG, Brasil CEP 30320-080
E-mail: patynoronha@gmail.com
Artigo submetido: 04/08/2012.
Artigo aceito: 15/10/2012.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter