

Original Article - Year 2014 - Volume 29 -
Ressecção alargada no tratamento do dermatofibrossarcoma protuberante
Extended resection for treatment of dermatofibrosarcoma protuberans
RESUMO
INTRODUÇÃO: Dermatofibrossarcoma Protuberante (DFSP) é um tumor de pele raro e de malignidade intermediária, com baixo potencial metastático, mas alta taxa de recorrência após tratamento cirúrgico. O tratamento clássico é a ressecção alargada, com margens variáveis. Muitos trabalhos descreveram os resultados da cirurgia micrográfica de Mohs no tratamento desta afecção. O objetivo deste estudo retrospectivo é verificar se a ressecção alargada constitui um método confiável no tratamento do DFSP.
MÉTODO: Entre agosto de 1968 e setembro de 2013, 31 lesões foram ressecadas em 30 pacientes com DFSP. Todos os pacientes foram submetidos à excisão cirúrgica radical, com remoção de 3 cm de tecido sadio nas margens laterais e com a margem profunda incluindo uma estrutura anatômica não infiltrada pelo tumor. Os seguintes aspectos foram estudados: gênero, idade, local da lesão, tratamento prévio e características peculiares da proservação.
RESULTADOS: Dezenove (63,3%) pacientes eram do sexo masculino e 11 (37,7%), do feminino. A média de idade da apresentação foi de 40,9 anos. As lesões estavam localizadas em tronco (61,3%), cabeça (22,6%), membros superiores (6,4%), membros inferiores (6,4%) e pescoço (3,3%). Tratamento prévio não foi observado em 58,1% dos pacientes. Um paciente (3,3%) evoluiu com recidivas e óbito, em decorrência do tratamento cirúrgico; três (10,0%) faleceram por outras causas.
CONCLUSÕES: A ressecção alargada com margens de 3 cm, com remoção de estrutura anatômica sadia, constitui método eficiente no tratamento do DFSP.
Palavras-chave: Dermatofibrossarcoma protuberante; Dermatofibrossarcoma; Neoplasias cutâneas.
ABSTRACT
INTRODUCTION: Dermatofibrosarcoma protuberans (DFSP) is a rare skin tumor with intermediate malignancy and low metastatic potential, but a high recurrence rate after surgical treatment. The classical treatment is extended resection with varying margins. Many studies have described Mohs micrographic surgery for treatment of this disease. This retrospective study was to verify if extended resection is a reliable DFSP treatment method.
METHOD: A total of 31 lesions were resected in 30 patients with DFSP between August 1968 and September 2013. All patients underwent radical surgical excision, with removal of 3 cm of healthy tissue on the lateral margins and with deep margin including an anatomical structure without tumor infiltration. Analyzed patient characteristics included sex, age, tumor site, previous treatment, and peculiar characteristics observed during the follow-up period.
RESULTS: Nineteen (63.3%) patients were male and 11 (37.7%) female. Their average age at tumor presentation was 40.9 years. The tumors were located on the trunk (61.3%), head (226%), upper limbs (6.4%), lower limbs (6.4%), and neck (3.3%). No previous treatment was reported in 58.1% of the patients. One patient (3.3%) developed recurrence and died due to the surgical treatment; three patients (10.0%) died from other causes.
CONCLUSIONS: Extended resection with 3-cm margins and removal of healthy anatomical structures is an effective treatment for DFSP.
Keywords: Dermatofibrosarcoma protuberans; Dermatofibrosarcoma; Skin tumors.
O Dermatofibrossarcoma Protuberante (DFSP) é um tumor cutâneo raro. Inicialmente descrito por Taylor1, em 1890, apresenta crescimento lento e baixa taxa de metástase, apesar de possuir comportamento local agressivo. Em 1924, esta entidade tornou-se amplamente conhecida como "Tumor de Darier-Ferrand"2, após relato do seu caráter progressivo e recorrente em função de ressecções econômicas. Em 1925, o termo foi modificado por Hoffman3 para "dermatofibrosarcoma protuberans", numa tentativa de enfatizar o aspecto protuberante da lesão.
Tipicamente, a neoplasia acomete indivíduos na terceira e na quarta décadas de vida, com discreta predominância no gênero masculino4. O diagnóstico clínico das formas precoces é difícil, devido à confusão com a má-formação vascular cutânea4. Dor pode se manifestar em 25% dos casos5. A evolução é caracterizada, inicialmente, por uma fase de placas (Figuras 1 e 2), que originam um ou mais nódulos (Figura 3), conferindo ao tumor um aspecto protuberante (Figura 4). O desenvolvimento da lesão pode ter longa duração e os nódulos possuem coloração avermelhada ou acastanhada4,6. Frequentemente, a neoplasia se assemelha a um queloide6,7. O tumor pode se manifestar como uma lesão atrófica, similar à esclerodermia circunscrita4.
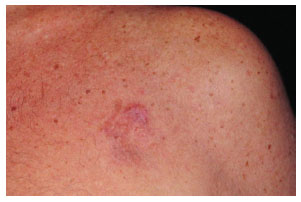
Figura 1. Caso 21, masculino, 66 anos, lesão em região peitoral esquerda em forma de placa.
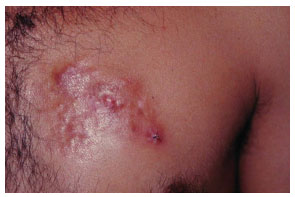
Figura 2. Caso 15, masculino, 31 anos, DFSP peitoral esquerdo em placa.
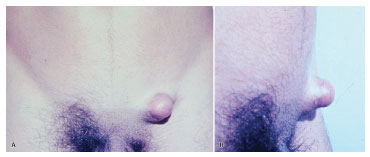
Figura 3. Caso 1, masculino, 19 anos, lesão em região inguinal esquerda, de forma nodular e aspecto protuberante, em vista frontal (A) e vista de perfil (B).
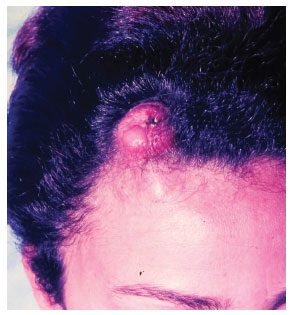
Figura 4. Caso 2, feminino, 31 anos, lesão frontal de aspecto protuberante.
O tronco é a área mais afetada, seguido das regiões proximais dos membros inferiores e da cabeça e pescoço4,6,8-10. A ocorrência em mãos e pés, assim como o envolvimento de mais de um território cutâneo, é infrequente4. História de traumatismo prévio e associação com imunossupressão foram observadas4.
A lesão se localiza na derme e invade a tela subcutânea através de feixes de células que se ramificam paralelamente à epiderme4,9,10. Uma forma subcutânea, sem conexão com a derme, foi descrita. Ulceração epitelial pode ocorrer, graças a alterações tróficas da pele sobrejacente à neoplasia6.
O DFSP é caracterizado por população densa e uniforme de fibroblastos, arranjados de forma espiral ou radial (aspecto de cata-vento, roda de carroça ou redemoinho) em torno de pequenos vasos4,6,9,10, o que confere ao tumor o aspecto de esteira de junco (storiform em inglês)4,6 (Figura 5). No tecido adiposo, a lesão assume imagem reticulada, pela penetração entre os lóbulos de gordura, levando ao aspecto de favo de mel10 (Figura 6).
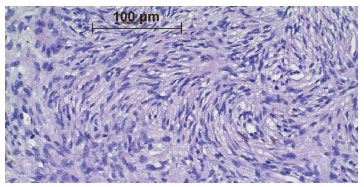
Figura 5. Fotomicrografia mostrando células tumorais organizadas ao redor de pequenos vasos sanguíneos em aspecto de turbilhão ou estoriforme. Médio aumento.
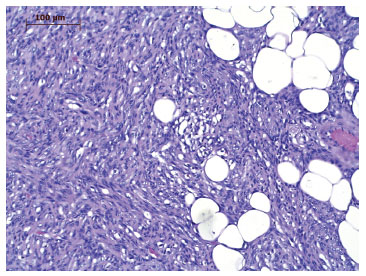
Figura 6. Fotomicrografia de tecido tumoral do DFSP infiltrando o tecido adiposo subcutâneo. Aumento de 200×.
O principal marcador imuno-histoquímico do DFSP é o CD34. As células tumorais são difusamente positivas para CD34 e negativas para outros marcadores, como fator XIIIa, proteína S-100, desmina e actina4,9 (Figura 7). Embora controversa, a histogênese do DFSP tem sido cada vez mais aceita como a de um tumor fibroblástico4,9.
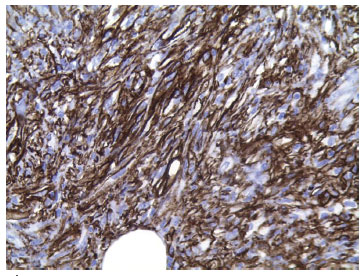
Figura 7. Preparação de imuno-histoquímica do DFSP com CD34 positivo.
Em relação aos aspectos patogenéticos, uma translocação cromossômica, envolvendo os genes COL1A1 no cromossomo 17 e PDGFB no cromossomo 22, é observada em mais de 90% dos casos. Esta alteração é marcada por uma translocação recíproca t(17;22)(q22;q13) e um cromossomo em anel supranumerário r(17;22), derivado da translocação, o que leva à fusão de dois genes: um gene do tipo colágeno 1 alfa 1 (COL1A1) e um gene do tipo fator de crescimento derivado de plaqueta de cadeia B (PDGFB)4. O PDGFB parece agir como um fator mitogênico por estimulação autócrina do receptor de PDGF. O mesilato de imatinibe, um antagonista da tirosinoquinase - um receptor de PDGF -, tem sido usado no tratamento do DFSP4, com bons resultados, inclusive em caso de metástases.
Metástases constituem fenômeno incomum e ocorrem principalmente em casos de múltiplas recorrências, em que se verifica a transformação do DFSP em fibrossarcoma. O DFSP fibrossarcomatoso pode produzir metástases em cerca de 20% dos casos4. Os órgãos mais afetados são fígado, pulmões, pâncreas e ossos11,12, e o envolvimento linfonodal é raro4,6,12. A existência de tumores de outras linhagens ocorrendo no mesmo indivíduo pode ter correlação genética ou ser atribuída ao acaso6. A forma familiar é excepcional4.
Em função do comportamento progressivo e recorrente da neoplasia, o tratamento padrão do DFSP se constituiu, durante décadas, na ressecção cirúrgica radical, com margens laterais amplas de tecido sadio. A margem profunda deveria incluir uma estrutura anatômica não infiltrada pelo tumor, como fáscia, músculo ou lâmina óssea externa. Nos últimos 15 anos, a cirurgia micrográfica de Mohs (CMM) tem sido progressivamente adotada no tratamento desta afecção, apesar de inúmeros vieses que serão discutidos.
A radioterapia para a terapêutica de lesões primárias demonstra resultados pobres, embora possa ser empregada como um complemento ao tratamento cirúrgico, especialmente na variante fibrossarcomatosa13.
Apesar de rara e indolente, a neoplasia pode afetar áreas corporais nobres, tais como face e extremidades, e as recidivas podem resultar em deformidades. É fundamental, portanto, estabelecer o método ideal de tratamento do DFSP.
O objetivo do presente estudo é rever os aspectos clínicos e anatomopatológicos do Dermatofibrossarcoma Protuberante, além de determinar se a ressecção alargada é método confiável no seu tratamento e analisar os vieses da literatura que recomenda a CMM.
MÉTODO
Dados de 30 pacientes, correspondendo a 31 lesões de DFSP tratadas entre agosto de 1968 e setembro de 2013, foram revistos para determinação de gênero, idade, localização do tumor, tratamento prévio e achados da proservação. Os primeiros dez casos desta série já foram publicados7, mas os aspectos pós-operatórios e as observações tardias foram inseridos nestes dados.
Todos os pacientes foram operados e acompanhados na Clínica de Cirurgia Plástica do Hospital Felício Rocho, Belo Horizonte-MG. A técnica cirúrgica consistiu em cirurgia radical, com remoção de 3 cm de tecido sadio nas margens laterais e margem profunda incluindo uma estrutura anatômica não invadida pelo tumor, tais como fáscia, músculo ou lâmina óssea externa. A totalidade dos indivíduos foi submetida a um método de reconstrução, como enxertos ou retalhos cutâneos. Em três casos, os retalhos foram previamente expandidos.
Os pacientes foram acompanhados com exame clínico a cada quatro meses nos primeiros dois anos e a cada seis meses, entre o terceiro e o quinto anos de pós-operatório. Foram aconselhados a se submeterem a uma consulta médica anual, indefinidamente. Pacientes que não compareceram a tal revisão foram acompanhados através de correio postal ou eletrônico, ou contato telefônico.
Todos os espécimes cirúrgicos foram examinados no Serviço de Anatomia Patológica da mesma instituição. A totalidade das amostras foi submetida à coloração de hematoxilina-eosina. Em alguns casos, estudos de imuno-histoquímica foram necessários para fins de diagnóstico diferencial.
Este estudo retrospectivo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Felício Rocho.
RESULTADOS
Dezenove (63,3%) pacientes eram do gênero masculino e 11 (37,7%) do feminino, resultando numa relação masculino-feminino de 1,7 (Figura 8).
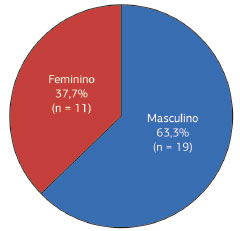
Figura 8. Dermatofibrossarcoma Protuberante. Distribuição em relação ao gênero.
A idade dos indivíduos, à época da cirurgia, variou de 9 a 72 anos, com média de 40,9 anos. Os tumores ocorreram principalmente entre a terceira e a quinta décadas de vida, correspondendo a 63,4% dos casos, e foram distribuídos num padrão ascendente-descendente entre os outros grupos etários. A idade-pico de incidência ocorreu entre os 30 e 39 anos (Figura 9).
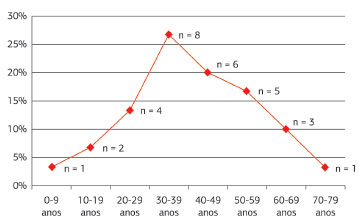
Figura 9. Dermatofibrossarcoma Protuberante. Distribuição em relação à faixa etária.
Do total de 31 lesões, 19 (61,3%) acometeram o tronco; sete (22,6%), a cabeça; duas (6,4%), os membros superiores; duas (6,4%), os membros inferiores, e uma (3,3%), o pescoço (Figura 10).
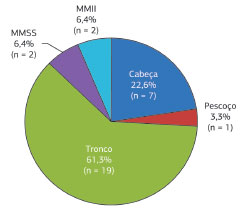
Figura 10. Dermatofibrossarcoma Protuberante. Distribuição em relação à localização.
Em relação a tratamento prévio, seis (19,3%) pacientes foram submetidos à excisão. Dois (6,4%) receberam radioterapia em associação com ressecção e um (3,3%) foi previamente tratado com quimioterapia em combinação com excisão. Quatro (12,9%) pacientes tiveram o diagnóstico errôneo de queloide e foram tratados com injeções intralesionais de acetonido de triancinolona. Em três (9,6%) destes casos, tal abordagem foi associada à remoção do tumor, enquanto em somente um (3,3%), o paciente recebeu apenas a infiltração de corticosteroide. Em 18 (58,1%) indivíduos, nenhum procedimento prévio foi observado (Figura 11). Em nove (29,0%) lesões, o diagnóstico correto foi estabelecido por meio de estudos imuno-histoquímicos.
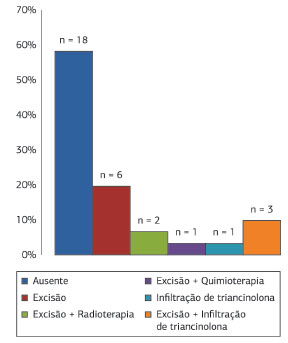
Figura 11. Dermatofibrossarcoma Protuberante. Distribuição em relação ao tratamento prévio.
Em relação ao tratamento cirúrgico, todas as lesões foram abordadas por meio de ressecção alargada, como descrito anteriormente. Dezessete lesões (51,6%) foram reconstruídas com retalho cutâneo; sete (21,2%), com enxerto cutâneo; três (9,1%), com retalho cutâneo previamente expandido; uma (3,0%), com retalho e enxerto cutâneo; uma (3,0%), com enxerto cutâneo sobre retalho muscular, e duas (6,1%), com retalho fasciocutâneo e enxerto cutâneo (Figura 12). Um paciente (3,0%) foi submetido à amputação transmetacarpal do dedo indicador e reconstrução com retalho (Figura 13). Uma cirurgia (3,0%) consistiu de craniectomia e maxilectomia, após duas tentativas, seguidas de recidivas, de excisão ampla e reconstrução com retalho cutâneo (Figura 14).
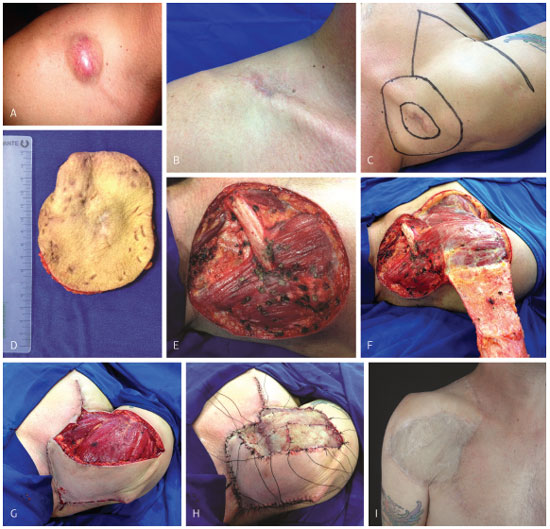
Figura 12. Caso 29, masculino, 47 anos, DFPS supraclavicular direito. Nódulo de coloração vermelho-acastanhada e aspecto protuberante (A). Biópsia excisional realizada alhures (B). Planejamento da operação (C). Peça cirúrgica (D). Resultado após ressecção alargada, incluindo-se, na peça cirúrgica, o periósteo da clavícula direita (E). Confecção do retalho fasciocutâneo (F). Fixação do retalho na área cruenta (G). Fixação de enxerto de pele parcial em leito (H). Resultado pós-operatório tardio (I).
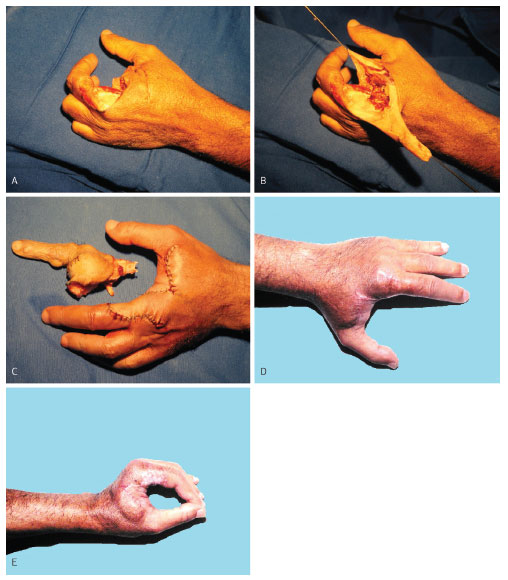
Figura 13. Caso 6, masculino, 54 anos, DFSP acometendo dedo indicador e segunda prega interdigital esquerdos. Amputação transmetacarpal do indicador e ressecção do lado radial da primeira falange do dedo médio (A). Retalho em capuz pediculado no dorso da mão (B). Retalho suturado e peça cirúrgica (C). Resultado pós-operatório tardio (D). Resultado pós-operatório tardio com movimento de pinça (E).
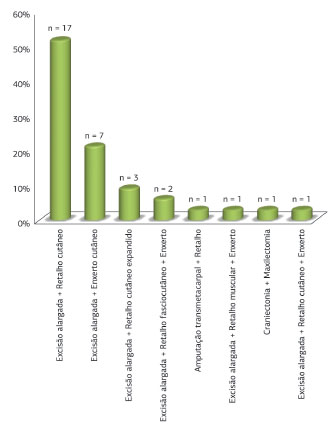
Figura 14. Dermatofibrossarcoma Protuberante. Distribuição em relação ao tratamento cirúrgico.
A proservação variou de 1 a 491 meses, com média de 114 meses. Vinte pacientes (66,7%) permaneceram vivos e livres da doença; um paciente (3,3%) evoluiu para óbito como consequência do tratamento cirúrgico da neoplasia e três (10,0%) faleceram por outras causas. Em seis indivíduos (20,0%), uma revisão recente não foi realizada, pela ausência de retorno às consultas (Figura 15). Somente um paciente (3,3%) apresentou recorrência tumoral. Por fim, um caso (3,3%) manifestou duas lesões em ocasiões distintas e um (3,3%) foi diagnosticado com tumor de Bednar.
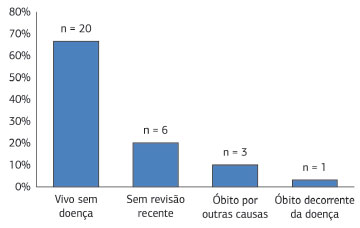
Figura 15. Dermatofibrossarcoma Protuberante. Distribuição em relação ao resultado.
DISCUSSÃO
DFSP tem sido extensamente relatado por autores brasileiros, com a presença de 23 artigos publicados, buscados através do Lilacs e Medline3,7,11-18.
A neoplasia afeta com maior frequência indivíduos na terceira e quarta décadas de vida4. Neste estudo, as lesões acometeram pacientes entre 9 e 72 anos, com média de 40,9 anos. Os tumores ocorreram mais comumente entre a terceira e a quinta décadas de vida, correspondendo a 63,4% dos casos, e a idade pico de apresentação se situou entre os 30 e 39 anos, o que confirma os achados da literatura.
Quanto ao gênero, o DFSP exibe uma discreta preponderância no sexo masculino4. Nesta série, 63,3% eram constituídos de indivíduos do gênero masculino e 37,7% do feminino, resultando numa relação masculino-feminino de 1,7, também corroborando os dados da literatura.
As áreas mais afetadas incluem, em ordem decrescente de frequência, o tronco, a região proximal dos membros e a região de cabeça e pescoço4,6,8-10. Este trabalho parcialmente reforçou tal informação, uma vez que 61,3% das lesões ocorreram no tronco, 22,6% na cabeça, 6,4% nos membros superiores, 6,4% nos membros inferiores e 3,3% no pescoço.
Em 18 neoplasias, não houve tratamento prévio. Nas 13 restantes, o tratamento anterior encontravase incorreto, com margens de excisão estreitas, radioterapia, quimioterapia e injeções intralesionais de corticosteroides.
Todos os pacientes foram acompanhados por um período de tempo variável, entre um e 491 meses, com média de 114 meses. Grande parte dos pacientes (66,7%) alcançou a cura e não desenvolveu recorrências tumorais ou metástases. Em um paciente (3,3%), apresentando lesão extensa na pálpebra inferior e bochecha, tratado alhures com injeções intralesionais de triancinolona por 18 anos, observou-se recidiva sete anos após o tratamento cirúrgico radical. Este paciente evoluiu para óbito como consequência de tratamento cirúrgico da lesão recorrente (craniectomia alargada e maxilectomia).
O tratamento padrão do DFSP consiste na ressecção cirúrgica ampla. A importância da excisão radical no tratamento primário desta condição foi reafirmada, em 1991, quando Smola, numa série de 20 pacientes submetidos a ressecções marginal, ampla e radical, verificou seis recorrências nos casos com excisão marginal17.
A recomendação quanto às margens laterais de ressecção tem apresentado considerável variação - entre um e cinco centímetros - e foi classicamente estabelecida como sendo de três centímetros4,7,8. Uma redução progressiva nas taxas de recorrência foi notada com o aumento das margens cirúrgicas4. Fatores que contribuem para um pior prognóstico incluem alto índice mitótico, idade superior a 50 anos, variante fibrossarcomatosa e margens de excisão comprometidas ou exíguas17. A utilização da ressecção alargada tem também demonstrado resultados satisfatórios em operações secundárias17. Vanderweyer, em um estudo com 18 pacientes tratados com margens de excisão variáveis, mas margens histológicas livres, apresentou apenas um caso de recidiva17. Dawes e Hanke relataram uma série de casos em que 85% de um total de 24 pacientes tiveram suas margens cirúrgicas negativas com excisão de 2,5 cm da lesão. Apesar disso, em dois casos, a margem-padrão de 3 cm não foi suficiente para completa ressecção da neoplasia. Portanto, independentemente do tipo de operação executada, as margens do espécime cirúrgico devem ser analisadas quanto à presença do tumor17.
A CMM surgiu em 1932 e, nos últimos 15 anos, inúmeras pesquisas foram desenvolvidas numa tentativa de se demonstrar a superioridade desta técnica em relação à ressecção cirúrgica ampla. O método, como quimiocirurgia, já havia sido empregado, em 1985, no tratamento do DFSP. Desde então, a CMM tem sido extensamente utilizada como opção terapêutica17. As principais dificuldades relacionadas à CMM são: 1) intolerância do paciente em função de o procedimento demandar tempo e requerer a manutenção do mesmo em posição inalterada na mesa cirúrgica, já que a operação é usualmente realizada com anestesia local; 2) possibilidade de interrupção do procedimento em caso de acometimento de tecido ósseo ou área anatômica perigosa; 3) cobertura escassa desse tipo de tratamento pelas empresas nacionais de saúde suplementar, devido a altos custos e suspeita de fraude17. Estudos comparativos abordando a terapêutica cirúrgica por CMM e ressecção alargada evidenciaram menor taxa de recidiva na primeira17.
A CMM tem sido considerada, por muitos autores, a primeira linha de tratamento do DFSP. Entretanto, um estudo prospectivo, multicêntrico e randomizado - o que seria desejável no caso de uma doença rara -, avaliando a eficácia entre CMM e excisão ampla, ainda não foi promovido17. Um viés de informação é detectado nestes artigos, graças à ausência de descrição do tamanho real das margens de ressecção e à grande variação de tal parâmetro encontrada na literatura. Além disso, as séries de CMM relatadas não retratam casos com metástases e invasão óssea, o que demonstra um viés de seleção8. Finalmente, o período de proservação mostrado nos diversos estudos não apresenta duração suficiente, o que demonstra um viés de detecção. O DFSP deve ser acompanhado em longo prazo, dado o seu comportamento recorrente. Recidivas após 148, 2317 e 2617 anos de pós-operatório, assim como metástases 16 anos depois da cirurgia inicial11, foram descritas. No presente trabalho, um paciente, que faleceu no pós-operatório mediato de craniectomia e maxilectomia, permaneceu livre da neoplasia por sete anos. Outro estudo informou uma taxa de recorrência de 25% após proservação de cinco anos17. Em um interessante artigo de Yu et al.19, nenhum sinal de recidiva foi detectado, após acompanhamento de 68 meses de 25 pacientes com DFSP tratados com ressecção ampla, ressecção ampla modificada, CMM e CMM seguida de ressecção ampla; os autores concluíram que um planejamento pré-operatório apropriado, combinado com uma seleção satisfatória da abordagem cirúrgica, são os elementos-chave para uma terapêutica bem-sucedida17,19.
Este trabalho apresenta um caráter inovador por demonstrar alguns aspectos interessantes no tratamento do DFSP. O emprego de retalhos previamente expandidos constitui nova abordagem na terapêutica da afecção, já que somente dois artigos na literatura tratam da questão7. Na casuística, três (10,0%) casos de lesões frontais, dois deles com acometimento ósseo, foram submetidos ao citado método, com resultados satisfatórios. Ademais, o presente estudo possui conotação única por relatar quatro (13,3%) casos previamente tratados com infiltrações intralesionais de triancinolona, devido a diagnóstico errôneo de queloide. Existe apenas um registro, na bibliografia médica, de pacientes com DFSP anteriormente tratados com injeções de corticosteroides em função de diagnóstico incorreto19,20. É amplamente conhecido que os esteroides exercem uma ação imunossupressora, assim como uma alteração na permeabilidade tissular. Embora um tratamento cirúrgico prévio ineficaz leve a recorrências e, portanto, a um pior prognóstico, o efeito da infiltração intralesional de triancinolona no comportamento tumoral ainda não foi estabelecido. O único caso do presente trabalho que apresentou recidiva e faleceu em decorrência da doença havia sido submetido à infiltração com corticosteroide por 18 anos.
A associação de tumores de outras linhagens em pacientes com DFSP pode apresentar uma correlação genética ou ser atribuída ao acaso4,8. Neste trabalho, quatro (13,3%) indivíduos foram acometidos por outras doenças neoplásicas. Um paciente, com DFSP escapular direito, foi curado após ressecção ampla, mas faleceu 81 meses depois de complicações de uma leucemia linfoide crônica. Outro, que se apresentou com um tumor no dedo indicador e foi tratado com amputação transmetacarpal, evoluiu para óbito após 127 meses, no pós-operatório imediato de cistectomia total, devida a um carcinoma de bexiga. Um terceiro paciente, com neoplasia frontal, foi submetido a excisão alargada, mas faleceu depois de 17 anos, durante tratamento de um nefrocarcinoma metastático. O quarto, que se apresentou com uma lesão no tronco, manifestou um melanoma extensivo superficial (Breslow 0,94 mm e Clark 2) no braço esquerdo e permanece vivo e saudável após tratamento.
CONCLUSÃO
O Dermatofibrossarcoma Protuberante é um tumor cutâneo raro.
O tratamento de escolha consiste na excisão cirúrgica completa. A ressecção ampla, caracterizada pela remoção de 3 cm de tecido sadio nas margens laterais e margem profunda incluindo uma estrutura anatômica não infiltrada pelo tumor, como fáscia, músculo ou lâmina óssea externa, demonstrou resultados eficientes no que tange ao controle da neoplasia. Tal fato pode ser confirmado pela ausência de metástases e presença de apenas um caso de recidiva tumoral, apesar do comportamento localmente agressivo desta afecção.
O presente trabalho ressalta, ainda, a importância de se considerar a existência do DFSP frente a lesões protuberantes, principalmente se localizadas em tronco, extremidades e cabeça, o que pode resultar em um diagnóstico preciso e, portanto, terapêutica apropriada. Por fim, a ressecção cirúrgica alargada constitui opção confiável, segura e adequada no tratamento da entidade.
AGRADECIMENTOS
Agradecemos ao Dr. Gil Patrus Mundim Pena, por ter gentilmente cedido e preparado as figuras referentes às fotomicrografias e à imuno-histoquímica utilizadas neste trabalho.
REFERÊNCIAS
1. Taylor RW. Interesting cases, dermatological and otherwise. J Cutan Genito-Urin Dis. 1890;8:379-88.
2. Darier J, Ferrand M. Dermatofibromes progressifs et récidivants ou fibrosarcomes de la peau. Ann Dermatol Syphil. 1924;5:545-62.
3. Costa OG. Progressive recurrent dermatofibroma (Darier-Ferrand); anatomoclinical study. Arch Derm Syphilol. 1946;54(4):432-54. http://dx.doi.org/10.1001/archderm.1946.01510390057005. PMid:21000203
4. McKee PH, Calonge E, Granter SR. Dermatofibrosarcoma protuberans. In: McKee PH, Calonge E, Granter SR, editores. Pathology of the skin with clinical correlations. 3. ed. Philadelphia: Elsevier Mosby; 2005. p. 1729-35.
5. Taylor HB, Helwig EB. Dermatofibrosarcoma protuberans. A study of 115 cases. Cancer. 1962;15(4):717-25. http://dx.doi.org/10.1002/1097-0142(196207/08)15:4<717::AIDCNCR2820150405>3.0.CO;2-2. PMid:13919964
6. Shapiro L, Brownstein MH. Dermatofibrosarcoma protuberans. In: Andrade R, Gumport SL, Popkin GL, Rees TD, editores. Cancer of the skin: biology, diagnosis, management. Philadelphia: WB Saunders; 1976. v. 2, p. 1069-78.
7. Silva AF Fo, Andrade JS Fo, Siqueira IMG, Saraiva PS, Magalhães GM, Alves JCRR. Dermatofibrossarcoma protuberante: aspectos clínicos e cirúrgicos. An Bras Dermatol. 1997;72(3):247-51.
8. McPeak CJ, Cruz T, Nicastri AD. Dermatofibrosarcoma protuberans: an analysis of 86 cases-five with metastasis. Ann Surg. 1967;166(5):803-16. http://dx.doi.org/10.1097/00000658-196711000-00011. PMid:4964386
9. Enzinger FM, Weiss SW. Fibrohistiocytic tumors of intermediate malignancy. In: Enzinger FM, Weiss SW, editores. Soft tissue tumors. 3. ed. St Louis: Mosby; 1995. p. 325-49.
10. Heenan PJ. Tumors of the fibrous tissue involving the skin. In: Elder D, editor. Lever's histopathology of the skin. 8. ed. Philadelphia: Lippincott-Raven; 1997. p. 847-87.
11. Fiod NJJ, Rezende JFN, Guitmann C, Meohas W, Estevan R. Dermatofibrosarcoma protuberans metastático para pulmão: relato de caso. Rev Bras Cancerol. 1994;40(3):169-73.
12. Silva RG, Paiva RKS, Santos CER, Melo ELR, Dias JA, Bravo Neto GP. Ressecção de metástase hepática de sarcomas de partes moles. Rev Col Bras Cir. 2006;33(6):380-6. http://dx.doi.org/10.1590/S0100-69912006000600010.
13. Bastos EM, Santos IDAO, Ferreira LM, Paiva GR, Brunstein F, Lima AH, et al. Radioterapia após cirurgia para dermatofibrossarcoma protuberante de grandes dimensões: revisão da literatura e relato de casos. Acta Oncol Bras. 2004;24(2):612-7.
14. Cláudio-da-Silva CS, Boghossian LC, Gonçalves LFF, Franco D, Franco T. Dermatofibrossarcoma protuberans gigante. Rev Soc Bras Cir Plast. 1997;12(2):7-14.
15. Fleury LFF Jr. Sarcomas cutâneos primários: estudo retrospectivo de casos registrados na divisão de Dermatologia do Hospital das Clínicas da FMUSP no período de 1992 a 2002 [Dissertação]. São Paulo: Universidade de São Paulo; 2007.
16. Golcman B, Bonetti EY, Friedhofer H, Filomeno LT, Monteiro AA Jr. Dermatofibrossarcoma protuberante. Rev Hosp Clin Fac Med Sao Paulo. 1984;39(4):197-200. PMid:6531616.
17. Alves JCRR. Tratamento cirúrgico radical do dermatofibrossarcoma protuberante. In: Anais da Academia Mineira de Medicina [Relação de trabalhos aprovados para ingresso como membros titulares]; 2010. Belo Horizonte, Brasil.
18. Furtado JPR, Furtado CF, Alves JCB, Morais CS, Laporte GA. Dermatofibrossarcoma protuberans: experiência e discussão numa série de casos. Rev AMRIGS. 2011;55(1):48-52.
19. Yu W, Tsoukas MM, Chapman SM, Rosen JM. Surgical treatment for dermatofibrosarcoma protuberans: the Dartmouth experience and literature review. Ann Plast Surg. 2008;60(3):288-93.
20. Manalan SS, Cohen IK, Theogaraj SD. Dermatofibrosarcoma protuberans or keloid-a warning. Case report. Plast Reconstr Surg. 1974;54(1):96-8. http://dx.doi.org/10.1097/00006534-197407000-00020. PMid:4832476
1. Doutor em Cirurgia pela Universidade Federal de Minas Gerais (UFMG), Membro Titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), Professor Titular de Técnicas Cirúrgicas e Anestésicas da Faculdade de Medicina da Universidade de Itaúna (UIT), Membro do corpo clínico do Serviço de Cirurgia Plástica do Hospital Felício Rocho e do Instituto de Cirurgia Plástica Avançada, Belo Horizonte, MG, Brasil
2. Médico, Cirurgiã plástica, Membro Especialista da Sociedade Brasileira de Cirurgia Plástica (SBCP), Membro do corpo clínico do Serviço de Cirurgia Plástica do Hospital Felício Rocho e do Instituto de Cirurgia Plástica Avançada, Belo Horizonte, MG, Brasil
3. Médico, Cirurgião plástico, Membro Titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), Membro do corpo clínico do Serviço de Cirurgia Plástica do Hospital Felício Rocho e do Instituto de Cirurgia Plástica Avançada, Belo Horizonte, MG, Brasil
4. Médico, Professor de Patologia da Faculdade de Ciências Médicas de Minas Gerais (FCMMG), Chefe do Serviço de Anatomia Patológica do Hospital Felício Rocho, Belo Horizonte, MG, Brasil
5. Médico, Membro Aspirante em Treinamento da Sociedade Brasileira de Cirurgia Plástica (SBCP), Médico Especializando do Serviço de Cirurgia Plástica do Hospital Felício Rocho, Belo Horizonte, MG, Brasil
Instituição: Trabalho realizado na Clínica de Cirurgia Plástica do Hospital Felício Rocho, Belo Horizonte, MG, Brasil.
Autor correspondente:
Rebeca Paohwa Liu da Fonseca
Rua Dionísio Cerqueira, 42/301 - Gutierrez
Belo Horizonte, MG, Brasil CEP 30430-140
E-mail: rebeca_liu@hotmail.com
Artigo submetido: 04/06/2014.
Artigo aceito: 14/01/2015.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter