

Original Article - Year 2014 - Volume 29 -
Reconstrução da parede torácica após a ressecção de extensos tumores
Reconstruction of chest wall after resection of large tumors
RESUMO
INTRODUÇÃO: Nos estágios finais da reconstrução torácica, consequente a exéreses tumorais, são necessários procedimentos complexos e implantes. O que requer cuidados multidisciplinares, com a participação dos cirurgiões torácicos, plástico, radiologista e fisioterapeuta. O objetivo foi descrever as opções de reconstrução torácica após ressecção de neoplasia, realizado no Hospital Sarah Brasília.
MÉTODO: Estudo retrospectivo de reconstrução torácica em tempo único, após excisão de tumor, fisioterapia respiratória com ventilação não invasiva e exercícios.
RESULTADOS: Entre 2007 a 2012 foram operados 10 pacientes, sete homens e três mulheres; idade 10 a 31 anos; oito apresentavam tumores torácicos metastáticos (osteosarcoma, sinoviosarcoma, Fibrosarcoma epitelioide esclerosante e Rabdomiosarcoma) e dois originários da parede torácica (fibromatose e condrosarcoma). Observou-se boa evolução no pós-operatório imediato, com extubação ao final da cirurgia, retirada do dreno torácico entre 5° e 8° PO. As complicações foram: atelectasia (10%), recorrência tumoral (10%), e óbito em 3 (30%) casos .
CONCLUSÃO: Foi possível a reconstrução torácica em tempo único utilizando tela de polipropileno, polimetilmetacrilato e retalhos musculares, com recuperação precoce da função pulmonar e baixo índice de complicações imediatas.
Palavras-chave: Reconstrução torácica; Tumor torácico; Polimetilmetacrilato.
ABSTRACT
INTRODUCTION: Complex procedures and implants are required in the final stages of chest wall reconstruction after tumor excision. This process requires multidisciplinary care with participation from thoracic and plastic surgeons, a radiologist, and a physical therapist. The goal of this study was to describe the options for chest wall reconstruction after neoplasm resection at Hospital Sarah Brasilia.
METHOD: A retrospective study of one-time chest wall reconstruction after tumor excision, respiratory physical therapy with noninvasive ventilation, and exercises was conducted.
RESULTS: Between 2007 and 2012, 10 patients underwent surgery (seven men, three women; age range: 10-31 years); eight patients had metastatic thoracic tumors (e.g., osteosarcoma, synovial sarcoma, sclerosing epithelioid fibrosarcoma, and rhabdomyosarcoma) and two had tumors originating from the chest wall (fibromatosis and chondrosarcoma). The outcomes were good after the immediate postoperative period, with extubation occurring at the end of surgery and chest tube removal between the fifth and eighth postoperative day. Three cases (30%) involved complications of atelectasis (10%), tumor recurrence (10%), or death.
CONCLUSION: One-time chest wall reconstruction using polypropylene mesh, polymethylmethacrylate, and muscle flaps was possible and was associated with early recovery of pulmonary function and a low rate of immediate complications.
Keywords: Chest wall reconstruction; Thoracic tumor; Polymethylmethacrylate.
O conceito de toracoplastia foi descrito em 1890 para o tratamento de empiema crônico e é ainda usado no século XXI. É considerado por muitos autores como um procedimento mutilante e pouco tolerado, geralmente é reservado como última escolha no tratamento das neoplasias malignas1-4. O conceito de toracoplastia envolvia a retirada de todos os arcos costais para o tratamento da infecção torácica. Para a reconstrução torácica, o uso de retalhos musculares tem sido descrito desde 19705-,7. Os músculos utilizados são: o grande dorsal, serrátil anterior, peitoral maior e o reto abdominal. Em alguns casos está descrito o uso de grande omento8. Muitos avanços têm ocorrido na reconstrução torácica ao longo dos anos com uso destes retalhos, todavia as complicações respiratórias e o óbito tem sido relatadas após grandes ressecções sem a reconstrução da parede torácica6,-8. A frequência de complicações pode ser diminuída pelo uso de próteses rígidas na reconstrução torácica9. Infelizmente, existem limitações na obtenção e utilização de materiais autólogos, e ainda não obtivemos o material aloplástico ideal. No século XXI muitos materiais autólogos, como fáscia lata, dura mater, osso, cartilagem e pericárdio foram utilizados nos processos reconstrutivos. Ademais os biomateriais, entre estes os titânio, a fibra de carbono, o acrílico (PMMA), teflon, nylon, silicone, polipropileno (Marlex R) tem sido empregados como opções, nas situações em que ha limitações no uso de materiais autólogos, nos extensos defeitos, para reduzir a morbidade do sítio doador, na reconstrução nos extremos de idade, na reabsorção do enxerto e nos casos de perdas das propriedades físicas do osso10,11. O material sintético ideal deve ser biocompatível, inerte, não condutor de calor, resistente a infecção, não magnético, leve, rígido, de preparo simples e fácil aplicação.
OBJETIVO
O objetivo da presente pesquisa foi representar um estudo retrospectivo dos resultados de 10 casos, submetidos à reconstrução e reabilitação torácica após ressecção cirúrgica de tumores da parede torácica, atendidos por equipe mulltidisciplinar no Hospital Sarah Brasília.
MÉTODO
Trata-se de estudo retrospectivo, de prontuários de pacientes submetidos à remoção de tumor torácico, reconstrução e fisioterapia pós-operatória no Hospital Sarah Brasília, no período de 2007 a 2012. Foram estudadas a idade, sexo, origem, localização e dimensões do tumor, extensão da exerese e o tipo de reconstrução torácica, assim como evolução pós-operatória, complicações imediatas e tardias. O trabalho foi avaliado e aprovado pelo CEP/APS.
Pré-operatório
Exames laboratoriais, espirometria (tabela 1) e exames de imagem.
Técnica cirúrgica
Sob anestesia geral, realizou-se a toracectomia, retirada alargada do tumor, com a incisão na pele incluindo o sítio da biópsia prévia do tumor torácico e de tecidos previamente irradiados. Retirada de costelas comprometidas, até 3cm de margens, e do tumor dentro da cavidade torácica, com a retirada de estruturas envolvidas como: pleura, pulmão, hilo ou diafragma. A excisão tumoral e a reconstrução foram realizadas em tempo único em todos os casos. A reconstrução da parede torácica foi semirrígida com tela de polipropileno; rígida com polimetilmetacrilato, na forma de cimento ósseo na técnica de "sanduíche" moldada no transoperatório, e por fechamento com retalhos musculares da vizinhança. A prótese foi fixada na estrutura rígida da margem, em pelo menos duas bordas, distribuindo-se a tensão, com fios de prolene 0. Foi realizada a cobertura do implante por tecido vascularizadocomo: músculo peitoral, reto abdominal, serrátil ou grande dorsal, impermeabilizando a cavidade pleural, com posterior drenagem torácica.
Pós-operatório
Internação em primeiro estágio, centro de recuperação pós-operatória; Uso de antibiótico profilático e de enoxiparina; Exames radiológicos e tomografia computadorizada de controle pós-operatório. Instalação de bomba de PCA Venoso (Patient Controlled Analgesia) com solução de morfina (0,5 mg/ml), dose de demanda de 2mg até o IV PO, de acordo com a necessidade; ou PCA peridural de solução de ropivacaína 0.2 % 4ml/h, bolus de 4.0 ml e intervalo de bloqueio de 30 minutos.
Fisioterapia pós-operatória
No presente estudo, a fisioterapia respiratória no pós-operatório teve como principais objetivos a manutenção das vias aéreas pérvias e promoção da expansão pulmonar. Foi utilizada a ventilação não invasiva (VNI), com pressão positiva em dois níveis de pressão - BIPAP (Bilevel Positive Pressure Airway) de forma intermitente, utilizando como interface uma máscara nasal ou oronasal, pelo menos três vezes ao dia, por um período de uma hora, com suplementação de oxigênio se necessário. Adicionalmente, como medidas preventivas de complicações pulmonares foram realizadas, pelo fisioterapeuta, técnicas de higiene brônquica através da tosse voluntária ou assistida, técnicas para expansão pulmonar associada ao padrão ventilatório, exercícios para mobilização de extremidades e deambulação precoce.
Avaliação de parâmetros clínicos
Foram avaliados: frequência respiratória, frequência cardíaca, utilização de musculatura acessória para respiração, respiração paradoxal, expansibilidade torácica, conforto do paciente, coordenação do movimento respiratório como disparo do aparelho, estado mental e gasométricos (saturação de oxigênio, melhora da hipercapnia e acidose respiratória) para monitoração dos pacientes em VNIPP. Uso de tipoia e faixa torácica elástica.
RESULTADOS
Durante o período de cinco anos (2007-2012) foram operados 10 pacientes, sete homens e três mulheres com idade entre 10 a 31 anos, sendo oito tumores metastáticos (quatro osteossarcomas, dois sinoviossarcomas, um fibrosarcoma epitelioide esclerosante e um rabdomiosarcoma) e dois originários da parede torácica (fibromatose e condrosarcoma). O tempo de seguimento médio foi de cinco anos (1-10anos). O tipo de tumor, a origem, as dimensões e localização estão descritos na tabela 2 e 3.
A origem do osteosarcoma foi principalmente da tíbia, em 50% dos casos. Nos procedimentos para reconstrução parietal empregou-se dupla camada de tela de polipropileno e placa moldada em metil metacrilato com ou sem retalhos musculares, em quatro casos (figura 1 e 2); reconstrução com tela de polipropileno com ou sem retalhos musculares, em quatro casos (figura 3 e 4,) e reconstrução somente muscular, em dois casos (tabela 4). Observou-se boa evolução no pós-operatório, com extubação ao final da cirurgia, em ventilação espontânea com suplemento de oxigênio a 1L/min, mantendo SpO2 entre 97-100%; pCO2=40,9/pO2= 131; o dreno torácico foi retirado entre 5º ao 8º PO (tabela 4).

Figura 1. Transoperatório de toracectomia direita associada à ressecção pulmonar em bloco (bilobectomia média e inferior) e ressecção parcial do diafragma e costelas de 5 a 11, ligadura sequencial das veias do lobo médio e inferior, ramos arteriais para os lobos médio e inferior; secção e sutura mecânica do brônquio intermediário; reconstrução parietal com dupla camada de tela de polipropileno e placa moldada de metilmetacrilato. A tela foi suturada nas bordas ósseas dos processos transversos e cartilagens costais anteriores, o diafragma foi suturado e reinserido primariamente a parede toracoabdominal e cobertura com retalho miocutâneo.
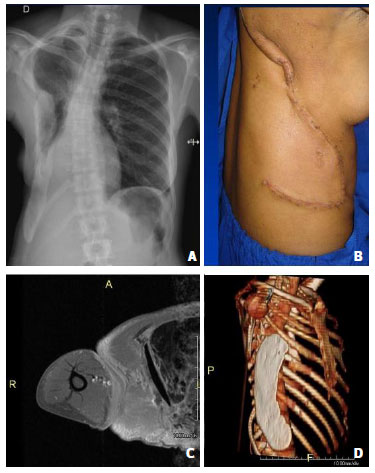
Figura 2. (A) Radiografia de controle, observar o cimento ósseo na parede torácica reconstruída; (B)Resultado no 30º dia de pós-operatório; (C) RMN pré-operatória; (D) RMN pós-operatória com a reconstrução com o PMMA.
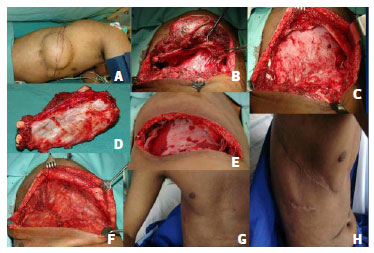
Figura 3. Transoperatório e pós-operatório do caso 2- Sob anestesia geral, em decúbito lateral foi realizada broncoscopia e alocação de tubo orotraqueal seletivo. (A). Marcação tumoral incluindo a área de biópsia prévia; (B). Toracotomia póstero- látero-anterior direita, rebatendo o músculo trapézio, e seccionando o grande dorsal até o serrátil anterior. Abordagem da cavidade no II espaço intercostal; (C). Secção anterior e posterior dos arcos costais de 3º a 9º, ligadura dos vasos intercostais, pneumonectomia, dissecação e ligadura com sutura mecânica da artéria pulmonar, brônquio esquerdo e as duas veias pulmonares. (D). Peça removida em monobloco com o pulmão e o gradil costal. (E). Sangramento de 1000ml, foi transfundida 1 unidade de concentrado de hemácias;(F). Reconstrução da parede torácica anterolateral com tela de polipropileno suturada com fio prolene 0; (G). Aproximação dos músculos peitoral e grande dorsal, também fixados na tela. Fechamento de subcutâneo e pele; (H). Resultado após seis meses.
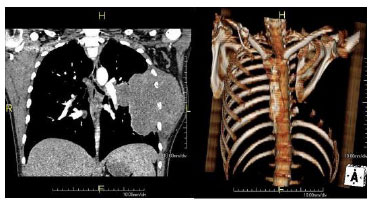
Figura 4. Exame de RMN pré-operatório e pós operatório após a toracectomia e a reconstrução com retalhos musculares.

As complicações foram: atelectasia(10%), recorrência do tumor torácico (10%), após 4 anos ; 3 (30%) casos evoluíram para o óbito (tabela 5) . Os casos de óbito ocorreram entre um e dois anos após a toracoplastia, devido à insuficiência respiratória pela progressão da doença pulmonar metastática e por insuficiência renal, devido ao uso de quimioterápicos. Não houve complicações infecciosas ou de perda de retalhos.
DISCUSSÃO
Neste estudo, o tumor mais frequente foi metastático de tumores ósseos para parede torácica, diagnosticado em 80% dos casos12. Entre os tumores da parede torácica apresentados nesta casuística, o condrossarcoma é o tumor ósseo maligno primário mais comum em adultos, sendo que o sarcoma de Ewing o mais comum em criancas13. A displasia fibrosa é a condição tumoral benigna mais evidenciada da parede torácica óssea, sendo responsável por cerca de 30% destes tumores13. Tradicionalmente, nos exames de imagem os tumores que demonstram extensa destruição cortical e formação de massa nos tecidos adjacentes são classificados como malignos. A destruição óssea é melhor estuda na Tomografia Computadorizada, enquanto que a formação extra óssea no exame de RMN, desta forma é necessário realizar tanto exame de CT como de RMN. Nem sempre o diagnostico do tumor maligno primário por exame de imagem é fácil, estes são melhores avaliados pelas características do padrão de mineralização da matriz óssea12,13. A história clínica (idade do paciente e doenças de base, como antecedentes de osteosarcomas e outros tumores) e os achados de imagem (características de intensidade do sinal visto na RMN) podem auxiliar no diagnóstico dos tumores da parede torácica12.
A excisão, de tumores da parede torácica, deve obedecer aos critérios de cirurgia oncológica, com a retirada do tumor com margem de segurança, todavia deve prever condições para a reconstrução da parede torácica, rígida a semirrígida, e desta forma evitar as complicações advindas da instabilidade torácica, alguns autores recomendam a estabilização rígida da parede torácica para melhor recuperação pós-operatória5,7. Os casos apresentados neste estudo são de tumores extensos e complexos, envolvendo mais de uma estrutura da parede torácica, na maioria (80%) consequente a metástases. Os pacientes com diagnóstico de sarcoma foram tratados previamente seguindo os protocolos de quimioterapia, radioterapia e cirurgias para controle local da doença1. Os principais aspectos para reconstrução torácica parietal foram a estabilização esquelética e a síntese de partes moles10,11. Nos casos de excisões menores, na extensão de 5 a 7cm, com retirada de 2 a 3 arcos costais, com boa cobertura muscular, ou na ressecção de tumores de localização lateral ou dorsal, não foi necessária a reconstrução do arcabouço torácico2,3. No tratamento cirúrgico oncológico foi necessária a retirada do tumor, englobando músculos, gradil costal e estruturas adjacentes, como descrito nesta casuística e na literatura. Quando o gradil costal é ressecado pode resultar em segmentos de costelas que podem ocasionar ferimentos na pele, movimento torácico paradoxal e deformidade no contorno corporal torácico. Os tumores extensos podem ser ressecados e reconstruídos com uso de retalhos musculares1, porém, muitas vezes, é necessário o cuidado de terapia intensiva e de suporte ventilatório devido à instabilidade torácica gerada. Muitos autores tem demonstrado que a estabilização da parede torácica associada à boa cobertura muscular tem proporcionado redução no tempo de internação e na função pulmonar adequada no pós-operatório. Desde 1972 se emprega a reconstrução de parede torácica com dupla camada de tela de polipropileno e placa moldada de metilmetacrilato4,5,10,11. As telas de polipropileno também estão indicadas em alguns casos, de exereses menores, sendo que estas são permeáveis, fáceis de manipular, tem alta resistência, durabilidade e resistência à infecção, todavia em contato com o pulmão provocam intensa fibrose o que dificulta as reoperações.
A prótese de polipropileno e a placa de metilmetacrilato devem ser fixadas na estrutura óssea rígida em pelo menos duas bordas, e devem ser cobertas por tecido vascularizado (músculo ou omento), impermeabilizando a cavidade pleural. Os músculos utilizados para esse fim foram o segmento do serrátil, peitoral maior e grande dorsal. Luz et al. demonstraram a aplicação de retalho miocutâneo do grande dorsal para reconstrução de defeitos torácicos extensos 9. Uma opção ao uso do material alógeno é a fáscia toracolombar associada ao músculo grande dorsal, utilizado em casos de infecção da parede torácica 7. Vale ressaltar que sempre que possível deve se manter os dois arcos costais superiores na realização da toracoplastia, quando não envolvidos por tumor, para preservar o contorno do ombro, pois sua ressecção tem pior resultado estético. Nos casos de infecção não está recomendado o uso do implante de metilmetacrilato.
A ocorrência de complicações pós-operatórias imediatas foi de 10%, um caso de atelectasia, e tardias de 40%, ocorrendo de 1 a 4 anos após a reconstrução torácica, caracterizadas por recorrência do tumor em 10% e óbito pela disseminação da doença metastática em 30%. Fouad4 et al descreveram 45,5% de complicações pós-operatórias imediatas como infecção, hematoma, pneumonia, insuficiência respiratória e 40% tardias, entre essas a recorrência local em 18% dos casos, metástases e infecção. Observa-se que a sobrevida após a retirada do tumor de parede torácica depende do momento do diagnostico, do tipo histológico tumoral, da possibilidade de ressecá-lo com margens livres e da presença de metástases. Nos dois casos estudados que evoluíram para óbito, um foi consequente a osteosarcoma osteoblástico e o outro caso a osteosarcoma de tíbia. Sendo que este último foi diagnosticado em 1993, evoluindo com a metástase torácica 17 anos após o diagnostico e tratamento da doença, o óbito ocorreu 2 anos após ao procedimento, devido a doença metastática pulmonar. É importante destacar que, a condição pré-operatória necessária para realização da toracoplastia é a reserva funcional pulmonar adequada 14. Esta é avaliada por espirometria com a avaliação do VEF1, volume expiratório forçado em 1 segundo, e estima-se que valores críticos de volume acima de 800ml ou 40% do previsto são suficientes. Segundo as diretrizes da Sociedade de Pneumologia o VEF1 e o VEF1PPO são variáveis espirométricas que devem ser avaliadas no pós-operatório (PO) das toracotomias com pneumonectomias14. Os procedimentos cirúrgicos, como a toracotomia, interferem na mecânica pulmonar e tendem a desenvolver alterações ventilatórias restritivas, com redução do Volume Expiratório Forçado no primeiro segundo (VEF1) e da Capacidade Vital Forçada (CVF). Pode ocasionar, também, repercussões pulmonares contralaterais, quando é necessário retirar mais de quatro arcos costais, nesses casos recomenda-se fazer em dois tempos. Nos casos descritos neste trabalho foram ressecados até quatro arcos costais, possibilitando a exérese e a reconstrução em tempo único.
As complicações pulmonares são importantes causas de morbidade após cirurgias torácicas e tem contribuído para o aumento significativo dos custos relacionados aos cuidados com a saúde, UTI e internação hospitalar14, todavia com a estrutura multiprofissional e a reconstrução torácica foi possível minimizar as complicações imediatas. As intervenções fisioterápicas contribuem para a redução de complicações no pós-operatório, e têm sido regularmente, utilizado no pré e pós-operatório das cirurgias torácicas, na prevenção de complicações clínicas e pulmonares, como se descreveu nesta pesquisa.
CONCLUSÃO
Demonstrou-se que foi possível a reconstrução torácica em tempo único para pacientes submetidos à exerese tumoral torácica extensa, com ou sem a reconstrução rígida da parede torácica. O tratamento foi realizado por equipe multidisciplinar e os pacientes apresentaram recuperação precoce da função pulmonar e baixo índice de complicações imediatas.
REFERÊNCIAS
1. Banic A, Ris HB, Erni D, Striffeler H. Free latissimus dorsi flaps for chest wall repair after complete resection of infected sternum. Ann Thorac Surg. 1995;60:1028-32.
2. Mansour KA, Thourani VH, Losken A, Reeves JG,Miller JI Jr, Carlson GW, et al. Chest wall resections and reconstruction: A 25-year experience. Ann Thorac Surg. 2002;73:1720-6.
3. Fouad A F. Chest Wall Resection and Reconstruction: Analysis of 11 Cases after Methylmethacrylate Reconstruction. Journal of the Egyptian Nat. Cancer Inst. 2006;18(3):175-182.
4. Miller DL, Force SD, Pickens A, Fernandez FG, Luu T, Mansour KA. Chest Wall Reconstruction Using Biomaterials. Ann Thorac Surg. 2013;95(3):1050-6.
5. Novoa N, Benito P, Jiménez MF, Juan A, Aranda JL, et al. Reconstruction of chest wall defects after resection of large neoplasms:Ten-year experience. Interact CardioVasc Thorac Surg.2005;4:250-55.
6. Raffoul W, Dusmet Ml, Landry M, Ris HB. A Novel Technique for the Reconstruction of Infected Full-Thickness Chest Wall Defects. Ann Thorac Surg . 2001;72:1720-4.
7. Chang RR, Mehrara BJ, Hu QY, Disa JJ, Cordeiro PG. Reconstruction of complex oncologic chest wall defects: A 10-year experience. Ann Plast Surg. 2004,52:471-79.
8. Tavares FM, Menezes CM, Moscozo MV, Xavier GR, Oliveira GM, Amorim JrM, et al. ,Retalho de omento: uma alternativa em cirurgia reparadora da parede torácica .Rev Bras Cir Plást . 2011;26(2)224-32.
9. Luz DP, Lobo CA, Hiraki P, Okada A, Montag E, Ferreira MC. Retalho miocutâneo de latíssimo do dorso em V-Y para reconstrução de grandes defeitos torácicos extensos. Rev Bras Cir Plást. 2010;25(1)52-55.
10. Costa PR, Melo JR, Andrade JrJ, Bezerra MM, Neves LJ, Araújo JM. Reconstrução da Parede Torácica com Metilmetacrilato: Relato de Caso. Rev Bras Cir Plást. 2007;22(4)345-8.
11. Kilic D, Gungor A, Kavukcu S, Okten I, Ozdemir N, Akal M, et al. Comparison of mersilene mesh-methyl metacrylate sandwich and polytetrafluoroethylene grafts for chest wall reconstruction. J Invest Surg. 2006;19(6):353-60.
12. O'Sullivan P, O'Dwyer H, Flint J, Munk PL, Muller NL. Malignant chest wall neoplasms of bone and cartilage: a pictorial review of CT and MR findings.Br J Radiol. 2007;80(956):678-684.
13. Meyer CA, White CS. Cartilaginous disorders of the chest. RadioGraphics 1998;18(5):1109-1123.
14. Reeve JC, Nicol K, Stiller K, McPherson KM, Denehy L. Does physiotherapy reduce the incidence of posoperative complications in patients following pulmonary resection via thoracotomy? A protocol for a randomised controlled trial. J Cardiothoracic Surg. 2008;3(1):48.
15. Pereira CA. Espirometria. J Pneumol. 2002;28(3)587-92.
1. Membro-Titular da SBCP - Médica Cirurgiã plástica do Hospital Sarah Brasília
2. Membro Titular da SBCP - Médico Cirurgião Plástico do Hospital Sarah Brasília
3. Membro Titular da SBCT - Cirurgião torácico da Rede Sarah de Hospitais
4. Membro da SBR - Médico Radiologista da Rede Sarah de Hospitais
5. Mestre em Ciências da Reabilitação - Fisioterapeuta da Rede Sarah de Hospitais
Instituição: Hospital Sarah.
Autor correspondente:
Katia Torees Batista
SMHS - Quadra 301 - Bloco A
Brasília, DF, Brasil CEP: 70335-901
E-mail: katiatb@terra.com.br
Artigo submetido: 30/7/2013.
Artigo aceito: 13/12/2014.





 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter