

Reviw Article - Year 2015 - Volume 30 -
Condutas atuais na prevenção da hipertrofia cicatricial pós-operatória
Current management for the prevention of postoperative scar hypertrophy
RESUMO
INTRODUÇÃO: Considerando um número estimado de cerca de 51 milhões de cirurgias a cada ano apenas nos EUA, podemos dizer que a hipertrofia cicatricial é um problema relevante, já que uma cicatriz fina, de boa qualidade, pode ser a linha divisória entre um bom resultado e uma cirurgia malsucedida. O objetivo é fazer uma revisão bibliográfica acerca dos métodos de tratamento não invasivos atualmente disponíveis para a prevenção da hipertrofia cicatricial pós-cirúrgica e discutir a sua eficácia baseada em evidências.
MÉTODO: Foi realizada uma pesquisa nas bases de dados Pubmed, Lilacs e SciELO, utilizando os termos "scar prevention" and "hypertrophic scars", por ensaios clínicos, meta-análises e artigos de revisão publicados a partir de 2004, em inglês ou português.
RESULTADOS E CONCLUSÕES: Foram encontrados vários trabalhos utilizando o silicone, proporcionando alguma evidência acerca da sua eficácia; foram encontrados apenas três ensaios clínicos prospectivos relacionados ao uso do Contractubex®; dois ensaios clínicos prospectivos, controlados, randomizados, sendo apenas um deles duplo-cego, com o imiquimode a 5%; foi encontrado apenas um ensaio clínico bem desenhado utilizando o esparadrapo microporoso e outro trabalho relacionado ao uso da vitamina E, que não mostrou bons resultados; não foram encontrados ensaios clínicos sobre o uso da massagem e da pressão local. Apesar das deficiências dos estudos, o silicone é considerado a primeira opção na prevenção da hipertrofia cicatricial pós-cirúrgica. Não há evidências que comprovem a eficácia do esparadrapo microporoso, da massagem, da pressão local, do Contractubex, do imiquimode a 5% e da vitamina E.
Palavras-chave: Cicatriz hipertrófica; Cicatriz hipertrófica/Prevenção & Controle; Cicatrização; Silicones; Vitamina E.
ABSTRACT
INTRODUCTION: Considering that nearly 51 million surgeries are performed annually just in the USA, we can state that scar hypertrophy is a relevant problem, since a thin, good quality scar can be the dividing line between a good outcome and an unsuccessful surgery. The objective is to perform a bibliographic review of the noninvasive methods currently available to prevent postoperative hypertrophic scars and discuss their evidence-based effectiveness.
METHOD: A search was performed in PubMed, LILACS, and SciELO databases, using the terms "scar prevention" and "hypertrophic scars," for clinical trials, meta-analyses, and review articles published since 2004 in English or Portuguese language.
RESULTS AND CONCLUSIONS: Several studies using silicone were found, providing some evidence on its effectiveness; only 3 prospective clinical trials using Contractubex® were found; 2 controlled, randomized prospective clinical trials using 5% imiquimod were found, but only one was double-blind; one well-designed clinical trial using a micropore adhesive tape was found; a similar clinical trial using vitamin E did not show good results. Clinical trials on the use of massage and local pressure were not found. Despite the limitations of the studies, silicone is considered the first treatment option for the prevention of postoperative hypertrophic scars. There is no evidence proving the effectiveness of micropore adhesive tape, massage, local pressure, Contractubex, 5% imiquimod, or vitamin E.
Keywords: Hypertrophic scar; Hypertrophic scar/Prevention & Control; Cicatrization; Silicone; Vitamin E.
Uma cicatriz hipertrófica, por definição, é uma "cicatriz avermelhada, elevada, por vezes pruriginosa, e confinada às bordas da incisão original."1.Podem ser dolorosas, causar limitação no movimento articular, estresse psicológico e prejuízo ao convívio social. Considerando que, apenas nos EUA, são realizadas cerca de 51 milhões de cirurgias por ano2, podemos dizer que a hipertrofia cicatricial pós-operatória é um problema relevante, no qual uma cicatriz fina, de boa qualidade, pode ser a linha divisória entre um bom resultado e uma cirurgia malsucedida (Figura 1).
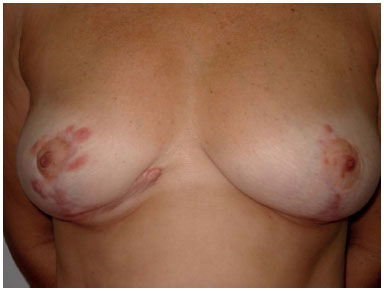
Figura 1. Hipertrofia cicatricial após cirurgia de redução mamária.
Diante da importância do problema, estão disponíveis vários métodos não invasivos a fim de prevenir a hipertrofia das cicatrizes lineares pósoperatórias: a massagem, a pressão local, o esparadrapo microporoso, o silicone, as formulações contendo extrato de cebola (Allium cepa), a vitamina E e o Imiquimode a 5%. Assim, o objetivo deste trabalho é fazer uma revisão bibliográfica acerca dos métodos de tratamento não invasivos atualmente disponíveis para a prevenção da hipertrofia cicatricial pós-cirúrgica e discutir a sua eficácia baseada em evidências.
MÉTODO
Foi realizada uma pesquisa nas bases de dados Pubmed, Lilacs e SciELO, utilizando os termos "scar prevention" and "hypertrophic scars", por trabalhos publicados a partir de 2004 em inglês e português. Os critérios utilizados para a seleção (inclusão) dos artigos foram: ensaios clínicos, meta-análises e artigos de revisão que abordassem terapias tópicas, não invasivas. Os ensaios clínicos prospectivos mais relevantes para o tema citados nos artigos de revisão, mas não relacionados na pesquisa inicial por terem data de publicação anterior a 2004, também foram incluídos. Foram excluídos os trabalhos publicados em outros idiomas, os experimentais, os que tratavam de cicatrizes de queimaduras, os referentes a tratamentos de hipertrofias cicatriciais, os infiltrativos e o laser.
RESULTADOS
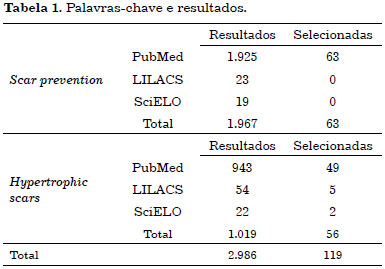
Foram obtidas um total de 2.986 referências, das quais foram selecionadas 119 para revisão (Tabela 1).
Os métodos não invasivos de prevenção da hipertrofia cicatricial pós-operatória encontrados nos trabalhos selecionados foram: a massagem da cicatriz, a pressão local, o uso do esparadrapo microporoso, o silicone, a Allium cepa, a vitamina E e imiquimode a 5%.
Massagem
Um estudo publicado em 2010, que pretendia validar a escala POSAS® (Patient and Observer Scar Assessment Scale) para a avaliação de cicatrizes faciais, dividiu 30 pacientes em dois grupos, tratando o primeiro grupo com silicone gel e o segundo grupo com massagem local. Após dois meses, submeteuos à avaliação pela escala POSAS®, obtendo boas pontuações, de forma semelhante, nos dois grupos3.
Em 2012 foi publicado um artigo de revisão sobre o papel da massagem no manejo das cicatrizes: dos dez artigos originais revisados pelo estudo, oito eram prospectivos e dois eram estudos de caso. Do total de 147 pacientes que constavam destes trabalhos como tendo recebido as massagens, em apenas 30 deles as cicatrizes eram pós-cirúrgicas. Os autores, então, concluíram que eram necessários mais ensaios clínicos bem desenhados, usando critérios de avaliação objetivos, a fim de que se pudessem estabelecer recomendações baseadas em evidências4.
Pressão local
Não foram encontrados estudos relacionados ao uso de dispositivos de pressão na prevenção da hipertrofia de cicatrizes pós-cirúrgicas.
Esparadrapo microporoso
Em 1995 foi publicado por Reiffel5 um estudo prospectivo com 64 pacientes onde o esparadrapo microporoso foi aplicado no sentido longitudinal das cicatrizes e mantido no local por dois meses ou mais, sendo trocado sempre que necessário. O autor concluiu que "a maioria dos pacientes demonstrou satisfação completa".
Em 2005 foi publicado um ensaio clínico, randomizado, com grupo controle, com 70 pacientes operadas de cesariana no qual o esparadrapo microporoso foi aplicado na cicatriz logo que as suturas foram removidas. O estudo concluiu que o esparadrapo microporoso reduziu significativamente o volume da cicatriz, avaliado por ultrassonografia, em média 0,16 cm3 (95% CI, 0,05 a 0,36). O efeito do tratamento foi maior quando considerado apenas aquelas mulheres que foram complacentes com o uso da fita de esparadrapo nas 12 semanas de acompanhamento6. Quatro pacientes (12%) apresentaram reação adversa (rash cutâneo) no local de contato da fita dentro nas primeiras 6 semanas de uso e foram excluídas do estudo. O uso do esparadrapo foi descontinuado e a reação local cessou espontaneamente. Ao final, nenhuma das 39 pacientes que completaram as 12 semanas de tratamento e os 6 meses de acompanhamento desenvolveu cicatriz hipertrófica, comparado com 12 pacientes (41%) do grupo controle.
Silicone
Em 1991, Ahn et al.7 publicaram um estudo prospectivo o qual utilizou um curativo contendo gel de silicone em 21 cicatrizes cirúrgicas por 12h/dia e foi constatado que as cicatrizes tratadas obtiveram menor ganho de volume após 1 mês e após 2 meses de tratamento quando comparadas com as cicatrizes controle.
Em 1996, foi publicado um estudo clínico prospectivo que avaliou 20 pacientes submetidas à mamoplastia redutora que usaram, 12 horas por dia durante 60 dias, uma tira de silicone nas cicatrizes de apenas uma das mamas. A avaliação destas cicatrizes revelou que 60% das cicatrizes não tratadas estavam hipertróficas, enquanto que apenas 25% das cicatrizes tratadas apresentavam hipertrofia8.
Em 2001, Gold et al.9 publicaram um ensaio clínico controlado, randomizado, no qual 96 pacientes submetidos à cirurgia dermatológica foram estratificados em dois grupos, sendo um sem história prévia de cicatrização anormal (baixo risco) e outro com história prévia de cicatrização. Dentro de cada grupo, os pacientes foram divididos aleatoriamente em dois outros grupos: o primeiro grupo recebeu, 48 horas após a cirurgia, uma tira de silicone na cicatriz, que foi utilizada 24h/dia por 6 meses. No segundo grupo foi realizado o acompanhamento pós-operatório normal. Um total de 66 pacientes, sendo 31 no grupo de baixo risco e 35 no grupo de alto risco, completaram os 6 meses do estudo. No grupo de baixo risco para cicatrização anormal, não foi observada nenhuma hipertrofia cicatricial ou queloide nos pacientes que utilizaram a tira de silicone e apenas um paciente que recebeu a rotina normal de cuidados pós-operatórios desenvolveu uma cicatriz hipertrófica. No grupo de pacientes de alto risco para cicatrização anormal, formado por 35 pacientes, 17 fizeram uso do silicone e 18 foram submetidos aos cuidados habituais. Dos 17 pacientes que utilizaram o silicone, 71% (n = 12) não apresentaram cicatriz hipertrófica ou queloide e 29% (5 pacientes) apresentaram cicatriz hipertrófica e dos 18 pacientes submetidos aos cuidados normais de pós-operatório, apenas 39% (n = 7) não apresentaram hipertrofia cicatricial, com 17% (n = 3) desenvolvendo queloides e 44% (n = 8) desenvolvendo cicatriz hipertrófica.
Em 2005, um ensaio clínico prospectivo, randomizado, duplo cego, com grupo controle, foi realizado com 50 pacientes submetidos à esternotomia. Os pacientes receberam dois envelopes, um contendo silicone em gel e outro contendo placebo, e foram orientados a aplicar cada envelope em uma metade da cicatriz. Ao final de 3 meses de acompanhamento, foi observada uma melhor pontuação na Escala de Vancouver na metade da cicatriz onde foi empregado o silicone, quando comparada ao grupo controle, com melhoria significativamente estatística nos parâmetros avaliados, incluindo pigmentação, vascularidade, maleabilidade, altura, dor e vermelhidão10.
Em 2007, foi publicado por Signorini et al.11 um estudo com 160 pacientes para avaliar a eficácia de um novo gel de silicone transparente e autossecante (Dermatix®). Os pacientes, que tinham sido submetidos à cirurgia entre 10 dias e 3 semanas antes para retirada de lesões cutâneas, foram divididos em dois grupos: no primeiro grupo, o gel de silicone foi aplicado duas vezes ao dia por 4 meses, com aplicações adicionais recomendadas após o banho e exercícios físicos. No grupo controle, foram prescritos tratamentos convencionais, tais como a pressão local, injeção de corticoide ou o silicone gel tradicional. Todos os pacientes foram acompanhados mensalmente por 4 meses e a avaliação final foi realizada aos 6 meses. Dos 80 pacientes do grupo tratado com o silicone, 72 completaram o estudo e 76 dos 80 pacientes do grupo controle completaram os 6 meses de observação. Os autores constataram que 67% das cicatrizes tratadas foram classificadas como grau 1 (normais: planas, suaves, cor normal) em comparação com 28% das cicatrizes tratadas por outros métodos, que 26% das cicatrizes tratadas foram classificadas como grau 2 (moderadamente hipertrófica: levemente elevada, moderadamente dura, coloração rosada), contra 46% no grupo controle e que 7% das cicatrizes tratadas foram classificadas como grau 3 e 4 (hipertrófica e queloide), contra 26% no grupo controle.
Em 2009, De Giorgi et al.12 publicaram um ensaio clínico randomizado no qual 110 pacientes submetidos à retirada de lesões cutâneas divididos em dois grupos, tratamento e controle, foram acompanhados por 8 meses quanto ao uso continuado do silicone gel, duas vezes ao dia, por 60 dias. Ao fim do período de acompanhamento, dos 65 pacientes que usaram o silicone gel, apenas 15% (n = 10) apresentaram cicatriz alargada, 9% (n = 6) apresentaram uma cicatriz hipertrófica e nenhum paciente desenvolveu um queloide. Dos 45 pacientes do grupo controle, 18% (n = 8) apresentaram uma cicatriz alargada, 22% (n = 10) desenvolveram uma cicatriz hipertrófica e 11% (n = 5) apresentaram um queloide.
Em 2010, Radwanski et al.13 publicaram um estudo prospectivo não controlado com 128 pacientes portadoras de cicatrizes recentes na fase de remodelação (entre as retiradas das suturas e o 3º mês de pósoperatório), nas quais foi empregado o silicone em gel (Kelo-cote®) em toda a extensão da cicatriz, duas vezes ao dia, em um período de 3 a 6 meses. Do total de pacientes, apenas 60 completaram as três etapas de avaliação e os seis meses do estudo. Utilizando a Escala de Vancouver, os autores constataram melhora significativa nas cicatrizes tratadas (p < 0,0001) ao longo do tratamento, principalmente entre o momento inicial e o intermediário (nos três primeiros meses).
Em 2010, um estudo prospectivo, com grupo controle, publicado por Rhee et al.14 avaliou 40 pacientes submetidos a pequenas cirurgias em áreas expostas do corpo, sendo que em 20 deles foi usado na cicatriz uma tira de silicone, 12 horas por dia por 3 meses. Ao final do período de observação, os autores constataram uma melhora significativamente estatística nos parâmetros avaliados, que foram a pigmentação (p = 0.0002), a vascularidade (p = 0.0002) e a altura das cicatrizes (p < 0.0001).
Em 2011, Sakuraba et al.15 publicaram um estudo com 9 pacientes submetidos à esternotomia, nos quais o silicone gel foi usado diretamente na incisão cirúrgica a partir de duas semanas de pós-operatório, 24h por dia. Ao final de 24 semanas, nenhum paciente apresentava queloide.
Em 2013, foi publicado por Medhi et al.16 um estudo prospectivo com 33 pacientes portadores de cicatrizes pós-cirúrgicas recentes, operados entre 10 dias e 3 semanas antes, nos quais foi aplicado o silicone gel duas vezes por dia por um período de 3 meses e avaliados segundo a pontuação definida pela Escala de Vancouver. Ao final de 3 meses, foi observada uma redução na altura em 57,6% (19/33) das cicatrizes, além de redução significativa na pigmentação, na flexibilidade e na vascularidade.
Em 2013, Riedel et al.17 publicaram um trabalho com 20 pacientes submetidos à retirada de um segmento de cartilagem costal: metade da cicatriz foi tratada por 3 meses com silicone gel e a outra metade foi usada como controle. As cicatrizes foram avaliadas visualmente e, dos 19 pacientes, apenas 8 apresentaram alguma melhora, sendo que 10 dos 19 pacientes apresentaram uma piora na avaliação visual. Os autores concluíram que não foram encontrados efeitos positivos do uso do silicone gel segundo os parâmetros utilizados.
Em 2013 foi publicada uma meta-análise que avaliou 20 ensaios clínicos referentes ao uso do silicone na prevenção e no tratamento da hipertrofia cicatricial. O estudo mostrou que, quando comparado a nenhum tratamento, o silicone reduziu a incidência de cicatriz hipertrófica em pacientes de alto risco (risco relativo [RR] 0.46, 95% CI), mas ressaltou que estes trabalhos foram altamente susceptíveis a vieses e concluiu que as evidências eram fracas18.
Extrato de cebola (Allium cepa)
O extrato de cebola (Allium cepa) é um ingrediente comum em algumas formulações empregadas na terapia tópica de cicatrizes. O Contractubex® (Merz Pharma, Frankfurt, Germany) é um gel contendo 10% de extrato de cebola (Allium cepa - Cepalina®), 50 UI de heparina e 1% de alantoína.
Em 1994, foi publicado por Willital & Heine19 um trabalho com 45 pacientes submetidos à cirurgia torácica, que foram divididos aleatoriamente em dois grupos, com o primeiro grupo aplicando o Contractubex® diariamente, pelo prazo de um ano. Os autores relataram que houve redução na largura das cicatrizes e uma ocorrência menor de cicatrizes hipertróficas e queloides no grupo tratado, quando comparados ao grupo controle. E não observaram diferença no comprimento e nem na altura das cicatrizes. Ao fim de um ano de observação, as cicatrizes foram classificadas como "muito boas" ou "boas" em mais de 90% dos pacientes que usaram a formulação, e como "boas" ou "moderadas ou ruins" em cerca de 40 e 60% dos pacientes não tratados, respectivamente.
Maragakis et al.,20 em 1995, publicaram um ensaio clínico com 65 crianças em pós-operatório de cirurgia torácica, divididas aleatoriamente em dois grupos, no qual um deles utilizou a formulação na cicatriz por 6 meses. Os autores descreveram que 84% das cicatrizes tratadas foram classificadas como "boas" e "muito boas", comparadas a 59% das cicatrizes do grupo controle e que o aumento no tamanho das cicatrizes tratadas foi "notadamente" menor do que nas não tratadas, além da tolerabilidade ao produto ter sido "muito boa" em 37 dos 38 pacientes tratados.
Em 2003, De Vita Júnior et al.21 publicaram um ensaio clínico, randomizado, duplo-cego, com grupo controle com 60 pacientes submetidas à mamoplastia redutora ou abdominoplastia, que foram randomizadas para receber a aplicação do produto ou placebo sobre as cicatrizes a partir do 21º dia de pós-operatório. As cicatrizes foram avaliadas por meio de fotografias por três outros cirurgiões alheios ao estudo e por exame clínico pelo próprio pesquisador. Os autores concluíram que o uso tópico por seis meses melhorava significativamente a qualidade das cicatrizes pós-operatórias.
Outro estudo publicado em 2006, desta vez retrospectivo, multicêntrico, com 771 pacientes (555 tratados com Contractubex® e 216 com injeção intralesional de corticoide), mostrou que o Contractubex® era significativamente mais eficaz do que o corticoide na redução do eritema, do prurido e da consistência da cicatriz hipertrófica22.
Mais recentemente, em 2013, Willital & Simon23 publicaram um estudo observacional, não controlado, no qual 1.268 pacientes foram tratados com Contractubex®, por vários médicos diferentes, no qual descreveram que houve uma melhora significativa na coloração, na flexibilidade e no tamanho das cicatrizes, com redução média de 47,8% na altura e de 32,5% na largura. Os autores concluíram que o Contractubex® poderia ser eficaz no tratamento precoce das cicatrizes e que poderia auxiliar na prevenção da hipertrofia cicatricial, mas que seriam necessários mais estudos bem desenhados para provar a sua eficácia.
Um artigo de revisão publicado em 2014 por Rabello et al.24 concluiu que faltavam dados para comprovar a eficácia do Contractubex® e que também não notava qualquer melhoria significativa nas cicatrizes hipertróficas de seus pacientes.
Imiquimode a 5%
O imiquimode a 5% é um imunomodulador indicado no tratamento de verrugas genitais, ceratoses actínicas e carcinomas basocelulares superficiais25. Apesar de o seu mecanismo de ação ainda não ser totalmente conhecido, o imiquimode parece induzir a produção de citoquinas pró-inflamatórias, tais como o interferon-alfa (INF-alfa), o fator de necrose tumoral alfa (TNF-alfa) e interleucinas, aumentando a degradação do colágeno. Baseado nessa premissa, Berman & Kaufman26, em 2002, publicaram um ensaio clínico prospectivo no qual avaliaram os seus efeitos na recorrência local de queloides após excisão cirúrgica: os pacientes foram instruídos a aplicar o imiquimode a 5% diariamente na cicatriz por 2 meses. Dos 11 queloides que completaram as 24 semanas de observação, não houve recorrência local em nenhum deles26.
Em 2005, Prado et al.27 publicaram um ensaio clínico prospectivo, controlado, duplo cego, randomizado, com 15 pacientes submetidas à mamoplastia redutora, divididas em três grupos: no primeiro grupo, o imiquimode a 5% (Aldara®, 3M) foi aplicado na mama esquerda, com a mama direita servindo como controle; no segundo grupo, a mama tratada foi a da direita, com a mama esquerda recebendo petrolatum; no terceiro grupo foi realizado um tratamento duplo-cego nas mamas, utilizando o Aldara® e petrolatum. Neste estudo, eles concluíram que quase todas as cicatrizes tratadas com Aldara® eram menos elevadas, possuíam coloração mais semelhante com a pele ao redor e pontuaram melhor na escala de avaliação.
Em 2009, Berman et al.28 publicaram um ensaio clínico com 20 pacientes cujos queloides foram excisados por shaving: eles foram divididos aleatoriamente em dois grupos e orientados a aplicar o imiquimode a 5% diariamente, iniciando logo na noite após a cirurgia, por duas semanas, e depois apenas três vezes por semana sob a forma de curativo. Ao final, apenas 8 pacientes completaram os 6 meses do estudo. Os autores concluíram que o índice de recorrência local do queloide foi de 37,5% no grupo tratado, contra 75% no grupo controle (p = 0,54)28.
Vitamina E
A vitamina E é uma vitamina lipossolúvel representada por um grupo de oito compostos estruturalmente relacionados: os tocoferois e tocotrienois. Em 1999, foi publicado um ensaio clínico randomizado, duplo-cego, no qual 15 pacientes submetidos à cirurgia micrográfica de Mohs foram tratadas por 4 semanas com uma pomada contendo 320 UI/gm de d-α Tocoferol (vitamina E), duas vezes ao dia. Este estudo concluiu que 90% dos pacientes não apresentaram melhora alguma na qualidade das cicatrizes, sendo que 33% deles apresentaram dermatite de contato29.
Em 2010, foi publicado um estudo prospectivo, monocego, com grupo controle, com 428 pacientes que iniciaram a vitamina E tópica 15 dias antes da cirurgia no local da incisão, reaplicando-a duas vezes ao dia por 30 dias após a cirurgia30. Ao término de 6 meses, os familiares dos pacientes foram orientados à responderem um questionário baseado na Escala de Vancouver. Após 10 dias de tratamento, o questionário já destacava que havia uma diferença significativamente estatística (p = 0,004) no resultado estético entre os grupos tratados e controle. Ao fim dos 6 meses, o questionário mostrou que 96% dos pacientes do grupo tratado apresentou "resultado estético muito bom" e 4% apresentou "bom" resultado, enquanto no grupo controle apenas 78% dos familiares consideraram o resultado "muito bom" e 15% consideraram o resultado "ruim"30.
Um outro estudo de 2010, prospectivo, randomizado, duplo-cego, com grupo controle, realizado com 122 pacientes com cicatrizes pós-cirúrgicas, tratadas por 6 semanas com tocotrienol tópico a 5%, não mostrou diferença significativa com relação ao grupo controle quando avaliadas pela escala POSAS®, por meio de fotografias e por Laser Doppler Imaging, um aparelho que demonstra de forma precisa a perfusão sanguínea da pele31.
DISCUSSÃO
Para que se possa recomendar um método terapêutico, são necessárias evidências científicas de que eles realmente são eficazes. Por isso, tem sido cada vez mais frequente a utilização na prática médico-científica da Medicina Baseada em Evidências. Segundo o Centre for Evidence-based Medicine de Oxford32, os estudos publicados são classificados de acordo com Níveis de Evidência e os tratamentos só devem ser recomendados aos pacientes se forem classificados, ao menos, na categoria B, numa Grade de Classificação de Recomendação que vai de A a D32. E para serem classificados na categoria B (Recomendação), os métodos de tratamento devem encontrar respaldo em estudos classificados nos Níveis II, III ou IV de Evidência. Para conseguirem esta classificação, os estudos devem ser construídos sob a forma de Revisões Sistemáticas, Ensaios Clínicos Controlados e Randomizados com Intervalo de Confiança estreito, Resultados Terapêuticos do tipo "tudo ou nada", Estudos de Coorte, Observação de Resultados Terapêuticos e Estudos Caso-Controle32. Foi baseado neste conhecimento que os autores embasaram a sua discussão.
Massagem
A massagem das cicatrizes é uma terapia rotineiramente empregada em vários centros especializados no tratamento de queimaduras4. Os poucos estudos existentes, realizados em cicatrizes de queimaduras, falharam em demonstrar benefícios na vascularização, na maleabilidade e na altura das cicatrizes hipertróficas. Mesmo assim, vários cirurgiões plásticos recomendam o início da massagem tão logo ocorra a retirada dos pontos e a reepitelização da ferida, geralmente com o auxílio de alguma substância hidratante. Foo & Tristani-Firouzi33, por exemplo, em seu artigo de revisão, mesmo admitindo não ser possível recomendar a massagem como método de tratamento nas cicatrizes, ponderam que costuma orientar seus pacientes a iniciarem as massagens 4 semanas após a cirurgia, duas a três vezes por dia, durante 3 a 5 minutos junto com um creme hidratante, por 3 a 4 meses. Na sua experiência pessoal, esta simples medida resulta em melhoria no contorno e na espessura das cicatrizes.
Pressão local
Com relação ao emprego de pressão local na prevenção da hipertrofia cicatricial pós-cirúrgica, não foi encontrado nenhum estudo. Atualmente, as vestes elásticas de pressão são muito usadas na prevenção e no controle da hipertrofia cicatricial após queimaduras34. E, mesmo quando empregados em cicatrizes de queimaduras, os dados acerca da sua eficácia são controversos e possuem pouca evidência científica34-37.
Esparadrapo microporoso
Apesar de a aplicação do esparadrapo microporoso na cicatriz cirúrgica ser uma prática comum entre os cirurgiões plásticos para prevenir a hipertrofia cicatricial, há somente dois ensaios clínicos prospectivos com o objetivo de avaliar a sua eficácia: o estudo publicado por Reiffel5, em 1995, e o trabalho de 2005 com cicatrizes de cesariana6. O primeiro foi apenas um estudo observacional, uma série de casos, com avaliação final de maneira subjetiva do autor, com baixo nível de evidência (Evidência Nível IV: série de casos, sem grupo controle). Já o trabalho publicado em 2005 foi um ensaio clínico randomizado, com grupo controle, com o examinador cego para o objeto do estudo, portanto, com um nível de evidência maior (Evidência Nível 1b: ensaio clínico randomizado, com intervalo de confiança pequeno). Porém, apenas 39 pacientes, um número muito pequeno de casos, completou os 6 meses de acompanhamento6. No passado, acreditava-se que o esparadrapo microporoso ofereceria "suporte" à cicatriz, sem definir o que se queria dizer com "suporte". Atualmente, acredita-se que possa haver um efeito mecânico, análogo à pressão, e oclusivo, mimetizando o estrato córneo, melhorando a hidratação da pele, similar ao mecanismo de ação do silicone. Diante da ausência de um maior número de ensaios clínicos randomizados, duplo-cegos, com grupo controle (Evidência Nível 1b ou 2b), não se pode afirmar que o uso do esparadrapo microporoso hipoalergênico é eficaz. Por não ser invasivo, ser barato, fácil de usar, com poucas complicações, bastando ter seu uso interrompido para cessarem6, ele pode ser indicado apenas nos pacientes de baixo risco para o desenvolvimento hipertrofia cicatricial ou antes mesmo do início da terapia com silicone38. Deve ser mantido no local por pelo menos 12 semanas, já que no único ensaio clínico randomizado, com grupo controle, foi observada uma perda da sua eficácia quando usado por menos tempo6.
Silicone
O seu mecanismo de ação ainda não foi completamente esclarecido, mas acredita-se que seus efeitos benéficos estejam relacionados à oclusão e à hidratação das cicatrizes: cerca de uma ou duas semanas após a injúria tecidual, temos o aumento na perda de água transepidérmica (do inglês: Transepidermal Water Loss - TEWL), levando a desidratação do estrato córneo. Com isso, ocorre a ativação da Interleucina 1 (IL-1) que estimula a proliferação dos queratinócitos, com o objetivo de restaurar a função de barreira e conter a desidratação. A IL-1, por sua vez, sinaliza aos fibroblastos presentes na derme para aumentarem a produção de colágeno. Essa produção excessiva de colágeno é responsável pela cicatrização anormal. A utilização do silicone por sobre as cicatrizes restaura a função de barreira do estrato córneo, reduzindo a TEWL, interrompendo a estimulação dos queratinócitos e cessando o estímulo aos fibroblastos da derme, normalizando a produção de colágeno (Figuras 2 a 5)39-42.
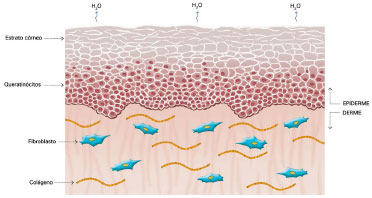
Figura 2. Pele Normal. Modificado de: Mustoe TA. Evolution of silicone therapy and mechanism of action in scar management.
Fonte: Aesth Plast Surg. 2008;32(1):82- 9242. Autora da ilustração: Luciane dos Santos Mori.
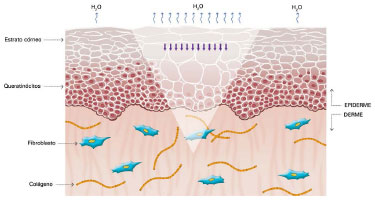
Figura 3. Células do estrato córneo sinalizando aos queratinócitos o aumento na perda de água sob a forma de vapor. Modificado de: Mustoe TA. Evolution of silicone therapy and mechanism of action in scar management.
Fonte: Aesth Plast Surg. 2008;32(1):82-9242. Autora da ilustração: Luciane dos Santos Mori.
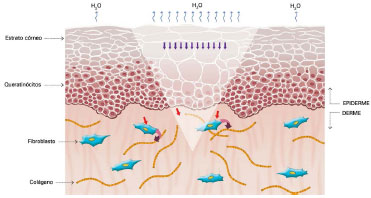
Figura 4. Queratinócitos estimulando os fibroblastos a produzirem colágeno. Modificado de: Mustoe TA. Evolution of silicone therapy and mechanism of action in scar management.
Fonte: Aesth Plast Surg. 2008;32(1):82-9242. Autora da ilustração: Luciane dos Santos Mori.
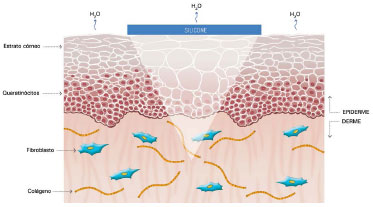
Figura 5. A oclusão pelo silicone restaura ao normal a perda de vapor d'água pela cicatriz e interrompe o estímulo à produção de colágeno pelos fibroblastos. Modificado de: Mustoe TA. Evolution of silicone therapy and mechanism of action in scar management.
Fonte: Aesth Plast Surg. 2008;32(1):82-9242. Autora da ilustração: Luciane dos Santos Mori.
Os efeitos benéficos do silicone foram inicialmente descritos nas cicatrizes de queimaduras, em 198343. Alguns anos depois, surgiram os primeiros estudos não controlados documentando o sucesso do uso de uma tira de silicone no tratamento de cicatrizes hipertróficas e dos quelóides44-46. A partir de 1991, começaram a ser publicados inúmeros outros estudos proporcionando evidências de que o silicone é eficaz, tanto na prevenção7-10,12-16 quanto no tratamento das cicatrizes hipertróficas pós-cirúrgicas ou traumáticas47,48. No entanto, a maioria desses estudos possui deficiências: tamanho pequeno da amostra7-9,13-16,48-50, falta de objetividade nos critérios de avaliação10-16,48-50, ausência de grupo controle13,15,16 e falta de padronização na seleção de pacientes7,8. Dois estudos, inclusive, concluíram que o silicone não foi eficaz na prevenção da hipertrofia de cicatrizes pósoperatórias17,51. Niessen et al.51, em sua discussão, ainda contemporizaram que havia iniciado o tratamento precocemente, ainda na fase inflamatória, aos dois dias de pós-operatório.
Assim, diante das evidências existentes, e das vantagens sobre outros métodos de prevenção, tais como o baixo custo e a ausência de reações adversas graves, o silicone é considerado, por vários autores, a primeira opção no manejo das cicatrizes pós-cirúrgicas e na prevenção da hipertrofia cicatricial33,36-38,52-55.
O polímero mais usado na composição dos dispositivos é o polimetilsiloxane. Dependendo do comprimento da sua cadeia e do grau de ligações cruzadas, o silicone pode ser líquido, gel ou borracha. A escolha da forma de apresentação dependerá, principalmente, da aceitação pelo paciente, já que ambas se mostraram eficazes: o gel pode ser preferível em regiões muito expostas, tais como a face, ou em locais onde não se consiga manter a tira de borracha aderida à cicatriz sem o auxílio de um esparadrapo, como em áreas sobre as articulações. Recomenda-se que seja aplicado logo após o fechamento cirúrgico, quando a incisão estiver totalmente epitelizada38, o que ocorre por volta de duas semanas, podendo ser mantido por até 12 semanas54,56. Ele deve ser usado por, no mínimo, 12h/dia e, se possível, 24h/dia38. Ao fim de 12 semanas, caso a cicatriz mostre algum grau de hipertrofia, recomenda-se que seja mantido por mais 12 semanas, juntamente com a terapia de pressão local, totalizando 6 meses54. A mesma recomendação não pode ser feita acerca da forma de creme de silicone a 20%, uma vez que só mostrou resultados satisfatórios quando usado sob oclusão em estudos não controlados com poucos pacientes57,58.
Extrato de cebola (Allium cepa)
Os primeiros trabalhos acerca do uso do Contractubex® foram publicados em 1994-95 de autoria de Willital (autor e coautor)19,20 e Maragakis20. Tratavamse de ensaios clínicos controlados, randomizados, que poderiam ser classificados como Nível de Evidência 1b (Ensaios clínicos randomizados com Intervalo de Confiança pequeno), caso tivessem uma amostragem maior e sido submetidos à testes estatísticos. Ademais, utilizaram critérios subjetivos para avaliar os resultados. O mesmo autor, Willital, apresenta outro estudo em 2013, desta vez um trabalho multicêntrico, prospectivo, com um grande número de casos, mas sem grupo controle e com a avaliação dos resultados de forma subjetiva, por vários avaliadores diferentes23. Há de se ressaltar que este último trabalho23 foi custeado pela Merz Pharma, fabricante do produto, e que o autor declara ter recebido suporte financeiro da empresa para pesquisa e consultoria23. Os outros autores dos outros trabalhos não declararam se possuíam algum conflito de interesse21,22.
Para recomendarmos uma terapêutica, ou o uso de algum produto, são necessários mais estudos com Nível II, III ou IV de evidência. Desta forma, ainda não é possível recomendar, baseado em evidências, o uso do Contractubex® na prevenção das cicatrizes hipertróficas pós-operatórias.
Imiquimode a 5%
Os estudos conduzidos por Berman & Kaufman26, por Prado et al.27 e por Berman et al.28 possuíam um número muito pequeno de casos, além de um deles não possuir grupo controle26. Prado et al., inclusive, concluem o estudo dizendo que seriam "necessários outros estudos com amostras maiores de casos e com mais tempo de acompanhamento"27. Vale destacar que o trabalho publicado em 2002 por Berman & Kaufman foi patrocinado por um auxílio educacional da empresa 3M Pharmaceuticals, fabricante do Aldara® e que Berman, em 2009, declarou ser um investigador e consultor da mesma empresa28. Deste modo, novos estudos com Níveis mais elevados de Evidência e com achados mais significativos são necessários para se determinar o papel do imiquimode tópico a 5% no manejo das cicatrizes pós-operatórias.
Vitamina E
Podemos dizer que são poucas as evidências a corroborarem o uso da vitamina E tópica como estratégia para minimizar a cicatrização das feridas cutâneas. Não foram encontrados outros trabalhos com Níveis de Evidência II ou III que fizesse com que pudéssemos recomendar esta terapêutica. No primeiro trabalho avaliado o seu uso não apenas se mostrou incapaz de melhorar a aparência das cicatrizes como foram observados índices elevados de efeitos adversos29. Os dois outros estudos publicados em 2010, apesar de apresentarem uma casuística maior, possuem deficiência quanto ao método de avaliação: no estudo conduzido com 428 casos, os avaliadores dos resultados foram os próprios familiares dos pacientes, enquanto que, no estudo com 128 pacientes, os resultados foram avaliados com o uso da escala POSAS® e por meio de fotografias, também considerados métodos subjetivos de avaliação, de grande variabilidade conforme o examinador. Assim, mais estudos, que proporcionem resultados significativos, são necessários antes de podermos recomendar o seu uso na prevenção da hipertrofia cicatricial.
CONCLUSÃO
Apesar das deficiências dos estudos existentes, o silicone é considerado a primeira opção na prevenção da hipertrofia cicatricial pós-cirúrgica, sendo indicado tão logo a cicatriz esteja totalmente epitelizada, o que ocorre cerca de duas semanas após a cirurgia.
Mesmo não tendo, ainda, a sua eficácia comprovada, a fita de esparadrapo microporoso pode ser usada em pacientes de baixo risco para a prevenção da hipertrofia cicatricial pós-operatória.
Diante da falta de evidências, não é possível recomendar a massagem, a pressão local, o estrato de cebola (Allium cepa), o imiquimode a 5% e a vitamina E na prevenção da hipertrofia de cicatrizes lineares pós-cirúrgicas.
REFERÊNCIAS
1. Peacock EE Jr, Madden JW, Trier WC. Biologic basis for the treatment of keloids and hypertrophic scars. South Med J. 1970;63(7):755-60. PMID: 5427162
2. Centers For Disease Control and Prevention. FastStats - Inpatient Surgery [Citado 28 Out 2015]. Disponível em: http://www.cdc.gov/nchs/fastats/inpatient-surgery.htm
3. Bianchi FA, Roccia F, Fiorini P, Berrone S. Use of Patient and Observer Scar Assessment Scale for evaluation of facial scars treated with self-drying silicone gel. J Craniofac Surg. 2010;21(3):719-23. DOI: http://dx.doi.org/10.1097/SCS.0b013e3181d841af
4. Shin TM, Bordeaux JS. The role of massage in scar management: a literature review. Dermatol Surg. 2012;38(3):414-23. DOI: http://dx.doi.org/10.1111/j.1524-4725.2011.02201.x
5. Reiffel RS. Prevention of hypertrophic scars by long-term paper tape application. Plast Reconstr Surg. 1995;96(7):1715-8. DOI: http://dx.doi.org/10.1097/00006534-199512000-00031
6. Atkinson JA, McKenna KT, Barnett AG, McGrath DJ, Rudd M. A randomized, controlled trial to determine the efficacy of paper tape in preventing hypertrophic scar formation in surgical incisions that traverse Langer's skin tension lines. Plast Reconstr Surg. 2005;116(6):1648-56. DOI: http://dx.doi.org/10.1097/01.prs.0000187147.73963.a5
7. Ahn ST, Monafo WW, Mustoe TA. Topical silicone gel for the prevention and treatment of hypertrophic scar. Arch Surg. 1991;126(4):499-504. PMID: 2009067 DOI: http://dx.doi.org/10.1001/archsurg.1991.01410280103016
8. Cruz-Korchin NI. Effectiveness of silicone sheets in the prevention of hypertrophic breast scars. Ann Plast Surg. 1996;37(4):345-8. DOI: http://dx.doi.org/10.1097/00000637-199610000-00001
9. Gold MH, Foster TD, Adair MA, Burlison K, Lewis T. Prevention of hypertrophic scars and keloids by the prophylactic use of topical silicone gel sheets following a surgical procedure in an office setting. Dermatol Surg. 2001;27(7):641-4.
10. Chan KY, Lau CL, Adeeb SM, Somasundaram S, Nasir-Zahari M. A randomized, placebo-controlled, double-blind, prospective clinical trial of silicone gel in prevention of hypertrophic scar development in median sternotomy wound. Plast Reconstr Surg. 2005;116(4):1013-20. DOI: http://dx.doi.org/10.1097/01.prs.0000178397.05852.ce
11. Signorini M, Clementoni MT. Clinical evaluation of a new self-drying silicone gel in the treatment of scars: a preliminary report. Aesthetic Plast Surg. 2007;31(2):183-7. DOI: http://dx.doi.org/10.1007/s00266-005-0122-0
12. de Giorgi V, Sestini S, Mannone F, Papi F, Alfaioli B, Gori A, et al. The use of silicone gel in the treatment of fresh surgical scars: a randomized study. Clin Exp Dermatol. 2009;34(6):688-93. DOI: http://dx.doi.org/10.1111/j.1365-2230.2008.03096.x
13. Radwanski HN, Correa WEMY, Refosco TJ, Farrapeira Júnior A. Pitanguy I. Silicone gel em cicatrizes de cirurgia plástica: estudo clínico prospectivo. Rev Bras Cir Plást. 2010;25(3):428-33. DOI: http://dx.doi.org/10.1590/S1983-51752010000300005
14. Rhee SH, Koh SH, Lee DW, Park BY, Kim YO. Aesthetic effect of silicone gel on surgical scars in Asians. J Craniofac Surg. 2010;21(3):706-10. DOI: http://dx.doi.org/10.1097/SCS.0b013e3181d83fec
15. Sakuraba M, Takahashi N, Akahoshi T, Miyasaka Y, Suzuki K. Use of silicone gel sheets for prevention of keloid scars after median sternotomy. Surg Today. 2011;41(4):496-9. DOI: http://dx.doi.org/10.1007/s00595-010-4265-5
16. Medhi B, Sewal RK, Kaman L, Kadhe G, Mane A. Efficacy and safety of an advanced formula silicone gel for prevention of post-operative scars. Dermatol Ther (Heidelb). 2013;3(2):157-67. DOI: http://dx.doi.org/10.1007/s13555-013-0036-8
17. Riedel M, Brinckmann J, Steffen A, Nitsch S, Wollenberg B, Frenzel H. Influence of silicone gel on standardized postoperative scars. J Dtsch Dermatol Ges. 2013;11(5):412-9. DOI: http://dx.doi.org/10.1111/ddg.12011
18. O'Brien L, Jones DJ. Silicone gel sheeting for preventing and treating hypertrophic and keloid scars. Cochrane Database Syst Rev. 2013;9:CD003826.
19. Willital GH, Heine H. Efficacy of Contractubex gel in the treatment of fresh scars after thoracic surgery in children and adolescents. Int J Clin Pharmacol Res. 1994;14(5-6):193-202.
20. Maragakis M, Willital GH, Michel G, Görtelmeyer R. Possibilities of scar treatment after thoracic surgery. Drugs Exp Clin Res. 1995;21(5):199-206.
21. De Vita Júnior J, Cezaretti JA, Tavarez PH, Vieira SAT, Oliveira MSL, Ávila DEP, et al. Avaliação da ação da associação de cepalin®, alantoína e heparina sódica* na evolução do processo de cicatrização de incisões cirúrgicas. Rev Bras Med. 2007;64(1):42-9.
22. Beuth J, Hunzelmann N, Van Leendert R, Basten R, Noehle M, Schneider B. Safety and efficacy of local administration of contractubex to hypertrophic scars in comparison to corticosteroid treatment. Results of a multicenter, comparative epidemiological cohort study in Germany. In Vivo. 2006;20(2):277-83.
23. Willital GH, Simon J. Efficacy of early initiation of a gel containing extractum cepae, heparin, and allantoin for scar treatment: an observational, noninterventional study of daily practice. J Drugs Dermatol. 2013;12(1):38-42.
24. Rabello FB, Souza CD, Farina Júnior JA. Update on hypertrophic scar treatment. Clinics (Sao Paulo). 2014;69(8):565-73. DOI: http://dx.doi.org/10.6061/clinics/2014(08)11
25. Berman B. Imiquimod: a new immune response modifier for the treatment of external genital warts and other diseases in dermatology. Int J Dermatol. 2002;41 Suppl 1:7-11. DOI: http://dx.doi.org/10.1111/j.1365-4632.2002.00018.x
26. Berman B, Kaufman J. Pilot study of the effect of postoperative imiquimod 5% cream on the recurrence rate of excised keloids. J Am Acad Dermatol. 2002;47(4 Suppl):S209-11. PMID: 12271279 DOI: http://dx.doi.org/10.1067/mjd.2002.126585
27. Prado A, Andrades P, Benitez S, Umaña M. Scar management after breast surgery: preliminary results of a prospective, randomized, and double-blind clinical study with aldara cream 5% (imiquimod). Plast Reconstr Surg. 2005;115(3):966-72. PMID: 15731724 DOI: http://dx.doi.org/10.1097/01.PRS.0000153823.52784.7E
28. Berman B, Harrison-Balestra C, Perez OA, Viera M, Villa A, Zell D, et al. Treatment of keloid scars post-shave excision with imiquimod 5% cream: A prospective, double-blind, placebo-controlled pilot study. J Drugs Dermatol. 2009;8(5):455-8.
29. Baumann LS, Spencer J. The effects of topical vitamin E on the cosmetic appearance of scars. Dermatol Surg. 1999;25(4):311-5. DOI: http://dx.doi.org/10.1046/j.1524-4725.1999.08223.x
30. Zampieri N, Zuin V, Burro R, Ottolenghi A, Camoglio FS. A prospective study in children: Pre- and post-surgery use of vitamin E in surgical incisions. J Plast Reconstr Aesthet Surg. 2010;63(9):1474-8. DOI: http://dx.doi.org/10.1016/j.bjps.2009.08.018
30. Zampieri N, Zuin V, Burro R, Ottolenghi A, Camoglio FS. A prospective study in children: Pre- and post-surgery use of vitamin E in surgical incisions. J Plast Reconstr Aesthet Surg. 2010;63(9):1474-8. DOI: http://dx.doi.org/10.1016/j.bjps.2009.08.018
31. Khoo TL, Halim AS, Zakaria Z, Mat Saad AZ, Wu LY, Lau HY. A prospective, randomised, double-blinded trial to study the efficacy of topical tocotrienol in the prevention of hypertrophic scars. J Plast Reconstr Aesthet Surg. 2011;64(6):e137-45. PMID: 20869928 DOI: http://dx.doi.org/10.1016/j.bjps.2010.08.029
32. Oxford Centre for Evidence-based Medicine - Levels of Evidence (March 2009) [Citado 28 Out 2015]. Disponível em: http://www.cebm.net/oxford-centre-evidence-based-medicine-levels-evidence-march-2009/
33. Foo CW, Tristani-Firouzi P. Topical modalities for treatment and prevention of postsurgical hypertrophic scars. Facial Plast Surg Clin North Am. 2011;19(3):551-7. DOI: http://dx.doi.org/10.1016/j.fsc.2011.06.008
34. Puzey G. The use of pressure garments on hypertrophic scars. J Tissue Viability. 2002;12(1):11-5. DOI: http://dx.doi.org/10.1016/S0965-206X(02)80004-3
35. Anzarut A, Olson J, Singh P, Rowe BH, Tredget EE. The effectiveness of pressure garment therapy for the prevention of abnormal scarring after burn injury: a meta-analysis. J Plast Reconstr Aesthet Surg. 2009;62(1):77-84. PMID: 18249046 DOI: http://dx.doi.org/10.1016/j.bjps.2007.10.052
36. Atiyeh BS. Nonsurgical management of hypertrophic scars: evidence-based therapies, standard practices, and emerging methods. Aesthetic Plast Surg. 2007;31(5):468-92. DOI: http://dx.doi.org/10.1007/s00266-006-0253-y
37. Shih R, Waltzman J, Evans GR; Plastic Surgery Educational Foundation Technology Assessment Committee. Review of over-the-counter topical scar treatment products. Plast Reconstr Surg. 2007;119(3):1091-5. PMID: 17312518 DOI: http://dx.doi.org/10.1097/01.prs.0000255814.75012.35
38. Mustoe TA, Cooter RD, Gold MH, Hobbs FD, Ramelet AA, Shakespeare PG, et al.; International Advisory Panel on Scar Management. International clinical recommendations on scar management. Plast Reconstr Surg. 2002;110(2):560-71. PMID: 12142678 DOI: http://dx.doi.org/10.1097/00006534-200208000-00031
39. Sawada Y, Sone K. Hydration and occlusion treatment for hypertrophic scars and keloids. Br J Plast Surg. 1992;45(8):599-603. PMID: 1493533 DOI: http://dx.doi.org/10.1016/0007-1226(92)90027-U
40. Tandara AA, Mustoe TA. The role of the epidermis in the control of scarring: evidence for mechanism of action for silicone gel. J Plast Reconstr Aesthet Surg. 2008;61(10):1219-25. PMID: 18653391 DOI: http://dx.doi.org/10.1016/j.bjps.2008.03.022
41. Mustoe TA, Gurjala A. The role of the epidermis and the mechanism of action of occlusive dressings in scarring. Wound Repair Regen. 2011;19 Suppl 1:s16-21. DOI: http://dx.doi.org/10.1111/j.1524-475X.2011.00709.x
42. Mustoe TA. Evolution of silicone therapy and mechanism of action in scar management. Aesthetic Plast Surg. 2008;32(1):82-92. PMID: 17968615 DOI: http://dx.doi.org/10.1007/s00266-007-9030-9
43. Perkins K, Davey RB, Wallis KA. Silicone gel: a new treatment for burn scars and contractures. Burns Incl Therm Inj. 1983;9(3):201-4.
44. Quinn KJ, Evans JH, Courtney JM, Gaylor JD, Reid WH. Non-pressure treatment of hypertrophic scars. Burns Incl Therm Inj. 1985;12(2):102-8. PMID: 4092154 DOI: http://dx.doi.org/10.1016/0305-4179(85)90035-X
45. Mercer NS. Silicone gel in the treatment of keloid scars. Br J Plast Surg. 1989;42(1):83-7. PMID: 2917222
46. Ohmori S. Effectiveness of silastic sheet coverage in the treatment of scar keloid (hypertrophic scar). Aesthetic Plast Surg. 1988;12(2):95-9. DOI: http://dx.doi.org/10.1007/BF01576921
47. de Oliveira GV, Nunes TA, Magna LA, Cintra ML, Kitten GT, Zarpellon S, et al. Silicone versus nonsilicone gel dressings: a controlled trial. Dermatol Surg. 2001;27(8):721-6. DOI: http://dx.doi.org/10.1097/00042728-200108000-00005
48. Li-Tsang CW, Lau JC, Choi J, Chan CC, Jianan L. A prospective randomized clinical trial to investigate the effect of silicone gel sheeting (Cica-Care) on post-traumatic hypertrophic scar among the Chinese population. Burns. 2006;32(6):678-83. DOI: http://dx.doi.org/10.1016/j.burns.2006.01.016
49. Lee SM, Ngim CK, Chan YY, Ho MJ. A comparison of Sil-K and Epiderm in scar management. Burns. 1996;22(6):483-7. PMID: 8884011 DOI: http://dx.doi.org/10.1016/0305-4179(95)00165-4
50. Maján JI. Evaluation of a self-adherent soft silicone dressing for the treatment of hypertrophic postoperative scars. J Wound Care. 2006;15(5):193-6. DOI: http://dx.doi.org/10.12968/jowc.2006.15.5.26913
51. Niessen FB, Spauwen PH, Robinson PH, Fidler V, Kon M. The use of silicone occlusive sheeting (Sil-K) and silicone occlusive gel (Epiderm) in the prevention of hypertrophic scar formation. Plast Reconstr Surg. 1998;102(6):1962-72. PMID: 9810992 DOI: http://dx.doi.org/10.1097/00006534-199811000-00023
52. Widgerow AD, Chait LA, Stals PJ, Stals R, Candy G. Multimodality scar management program. Aesthetic Plast Surg. 2009;33(4):533-43. PMID: 19048338 DOI: http://dx.doi.org/10.1007/s00266-008-9276-x
53. Tziotzios C, Profyris C, Sterling J. Cutaneous scarring: Pathophysiology, molecular mechanisms, and scar reduction therapeutics Part II. Strategies to reduce scar formation after dermatologic procedures. J Am Acad Dermatol. 2012;66(1):13-24. PMID: 22177632 DOI: http://dx.doi.org/10.1016/j.jaad.2011.08.035
54. Monstrey S, Middelkoop E, Vranckx JJ, Bassetto F, Ziegler UE, Meaume S, et al. Updated scar management practical guidelines: non-invasive and invasive measures. J Plast Reconstr Aesthet Surg. 2014;67(8):1017-25. DOI: http://dx.doi.org/10.1016/j.bjps.2014.04.011
55. Son D, Harijan A. Overview of surgical scar prevention and management. J Korean Med Sci. 2014;29(6):751-7. DOI: http://dx.doi.org/10.3346/jkms.2014.29.6.751
56. Kim S, Choi TH, Liu W, Ogawa R, Suh JS, Mustoe TA. Update on scar management: guidelines for treating Asian patients. Plast Reconstr Surg. 2013;132(6):1580-9. PMID: 24281584 DOI: http://dx.doi.org/10.1097/PRS.0b013e3182a8070c
57. Sawada Y, Sone K. Treatment of scars and keloids with a cream containing silicone oil. Br J Plast Surg. 1990;43(6):683-8.
58. Wong TW, Chiu HC, Chang CH, Lin LJ, Liu CC, Chen JS. Silicone cream occlusive dressing-a novel noninvasive regimen in the treatment of keloid. Dermatology. 1996;192(4):329-33. PMID: 8864367 DOI: http://dx.doi.org/10.1159/000246405
1. Universidade Federal Fluminense, Niterói, RJ, Brasil
2. Sociedade Brasileira de Cirurgia Plástica, Rio de Janeiro, RJ, Brasil
Instituição: Hospital Universitário Antônio Pedro. Departamento de Cirurgia Geral de Especializada, Niterói, RJ, Brasil.
Autor correspondente:
Pedro Leonardo Sanches Faveret
Rua Marquês de Paraná, 303
Niterói, RJ, Brasil CEP 24033-900
E-mail: pedrofaveret@id.uff.br
Artigo submetido: 14/12/2014.
Artigo aceito: 26/5/2015.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter