

Review Article - Year 2016 - Volume 31 -
Mamoplastia de aumento com lipoenxertia autóloga: revisão da literatura e relato de caso
Breast augmentation with autologous fat grafting: literature review and case report
RESUMO
INTRODUÇÃO: O autotransplante do lipoaspirado na mama para fins estéticos e reconstrutivas tem avançado intensamente na técnica e na tecnologia, assim como na aceitação dos médicos e dos pacientes. O autor relata um caso de aumento mamário estético e discute a revisão da literatura, interessando a eficácia, o potencial carcinogênico e o exame de imagem.
MÉTODO:Revisão da literatura no Pubmed na língua inglesa e na Revista Brasileira de Cirurgia Plástica, e relato de caso da experiência inicial do autor.
RESULTADO: O volume manteve-se estável a partir do segundo mês, e não houve complicações no pós-operatório. Os exames de imagem não apresentaram alterações patológicas. Foram selecionados 24 artigos relacionados.
DISCUSSÃO: Dos 24 artigos, só há dois artigos prospectivos não controlados, mas, de maneira geral, não há problemas no diagnóstico nos exames por imagem, não há aumento de potencial cancerígeno, e os resultados são bons nas séries de casos.
CONCLUSÃO: O procedimento é reprodutível, seguro e eficaz, consolidando-se como uma indicação no tratamento reparadora da mama e uma opção no aumento estético. Entretanto, uma curva de aprendizado mais longa pode ser necessária, para evitar complicações e atingir bons resultados.
Palavras-chave: Enxertos; Gordura; Lipoaspiração; Mamoplastia; Mama.
ABSTRACT
INTRODUCTION: The technique and technology lipoaspirate autotransplantation to the breast with the aim of aesthetic appearance and reconstruction has strongly advanced; further, its acceptance by doctors and patients has also improved. The author reports cosmetic breast augmentation and performed a literature review, focusing on the efficacy, carcinogenic potential, and imaging diagnosis.
METHOD:A literature review was performed using English-language articles from the PubMed database and the Brazilian Journal of Plastic Surgery (RBCP); in addition, case series of the initial experience of the author has been described.
RESULTS: The volume remained stable from the second month, and there were no postoperative complications. Imaging did not show any pathological alterations. In all, 24-related articles were selected.
DISCUSSION: Among the 24 articles, only two prospective non-controlled studies were found, but overall, imaging diagnostic tests did not reveal problems, the carcinogenic potential was not increased, and case series had positive results.
CONCLUSION: The procedure is reproducible, safe and effective, and reinforces the use of this technique in breast reconstruction and as an option in cosmetic breast augmentation. However, it may require a longer learning curve to avoid complications and achieve good results.
Keywords: Grafts; Fat; Lipoaspiration; Mammoplasty; Breast.
A lipoenxertia na mama foi condenada pela Sociedade Americana de Cirurgiões Plásticos e Reconstrutivos em 1987, devido à possibilidade de resultar em calcificações que podem interferir na interpretação de exames de detecção de câncer mamário1-3. Recentemente, este cenário vem mudando. Devido ao avanço dos exames de imagem e aprimoramento das técnicas de lipoenxertia, o autotransplante do lipoaspirado tem sido aplicado no aumento estético da mama, e na reconstrução mamária, interessando tanto na reposição do volume mamário quanto na regeneração cutânea, como nas lesões pós-radioterapia4-20.
Em 2009, a Sociedade Americana de Cirurgiões Plásticos reviu a sua posição e advertiu que o resultado é dependente da técnica e da experiência do cirurgião21. A melhor compreensão da ação das células mesenquimais do tecido adiposo proporcionou resultados mais previsíveis na manutenção do volume enxertado, e iniciou uma nova era da regeneração tecidual e na cirurgia reconstrutiva22-24.
A controvérsia da lipoenxertia na mama reside na possibilidade de interferir nos exames de imagem na detecção de câncer de mama25-32 e, se as células mesenquimais transplantadas poderiam originar câncer de mama, ou propiciar um câncer existente33,34. Na literatura, até o presente momento, não há nenhum relato de caso de câncer mamário causado por lipoenxertia, nem nenhum relato de câncer mamário não diagnosticado devido à lipoenxertia mamária, e este procedimento vem ganhando popularidade crescente na Europa, Estados Unidos, Japão e China35. No presente trabalho, o autor discute a revisão bibliográfica e relata a experiência inicial do autor.
MÉTODOS
Revisão bibliográfica
A busca pelas publicações na revisão bibliográfica foi feita no Pubmed, na língua inglesa, com os termos "breast augmentation fat", e na Revista Brasileira de Cirurgia Plástica foi usado os termos "lipoaspiração" e "mama". Interessaram os artigos sobre a eficácia e a segurança da técnica, o estudo de imagem no controle pós-operatório, a pesquisa sobre o potencial carcinogênico do autotransplante do lipoaspirado, e da posição das Sociedades e da Saúde Pública em relação ao procedimento.
Relato de caso
CFA, sexo feminino, 23 anos de idade, nulípara, portadora de hipomastia e discreta assimetria, sem antecedentes familiares de neoplasia mamária, desejava aumento moderado das mamas, porém, recusa implante de silicone. Foi submetida à lipoaspiração, sob anestesia geral, das regiões lombares e abdominal, com infiltração de solução de adrenalina 1:250.000, na proporção de 1:1, com cânula de 3 mm de diâmetro interno e seringa de 60 ml de bico cateter (Becton Dickinson do Brasil). O lipoaspirado foi centrifugado por 3 minutos a 3.000 rpm.
Das quatro fases formadas após a centrifugação, foi aproveitada a camada de células adiposas e a pequena fração estromal. A lipoenxertia foi feita com seringa de 10 ml Luer-lock, e agulha 14G, por retroinjeção, nos planos retroglandular e subcutâneo, com a entrada pela borda ou base da mama nas posições de 12, 2, 4, 6, 8, e 10 horas, e distribuição homogênea, evitando injeção em bolus e injeção no parênquima mamário (Figura 1).
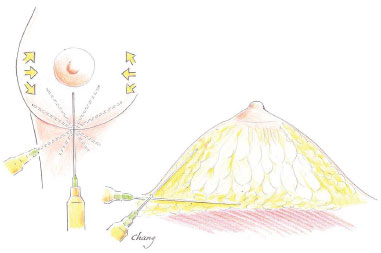
Figura 1. Técnica de lipoenxertia, nos planos retromamário e subcutâneo.
Foram transplantados 190 ml do centrifugado na mama esquerda e 240 ml na direita. O ultrassonografia mamária de 6 meses pós operatório evidenciou um cisto inespecífico. A segunda sessão de lipoenxertia 6 meses após, foi realizada com a mesma técnica, retirando das regiões trocantéricas, do joelho e da face interna superior da coxa, e foram injetados 200 ml em cada mama (Figuras 2, 3 e 4).
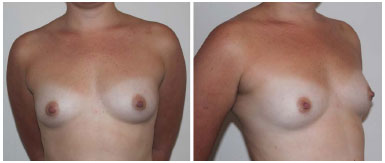
Figura 2. Pré-operatório.
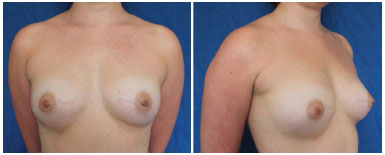
Figura 3. Resultado de 6 meses após a primeira sessão de lipoenxertia.
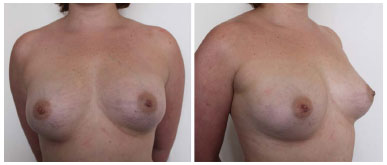
Figura 4. Pós-operatório de 7 meses após a segunda sessão de lipoenxertia, e 13 meses após a primeira sessão de lipoenxertia.
RESULTADOS
O edema e a equimose cederam em 2 a 3 semanas e, ao longo de 2 a 4 meses, houve uma pequena a moderada perda de volume inicial e, posteriormente, um pequeno ganho volumétrico, estabilizando-se após esse período. O volume antes e depois dos procedimentos não foi mensurado, mas aparentemente houve um ganho significativo de volume.
Revisão da Literatura
No PUBMED, foram encontrados 136 artigos e selecionados 4 artigos de revisão, 7 séries de casos, 8 de estudo de imagem, 2 de análise do potencial cancerígeno, e 3 de complicações. Nos relatos de série de casos, só 2 artigos são prospectivos mas não controlados. Na Revista Brasileira de Cirurgia Plástica foi encontrado 1 pôster que citou a lipoenxertia na complementação pós reconstrução mamária, e um artigo de revisão.
Estudo de imagem
No estudo cego conduzido por Rubin et al.25, as alterações mamográficas de lipoenxertia mamária de 27 pacientes foi comparada com as de redução mamária de 23 pacientes, e foi encontrado menos anormalidades radiológicas, menor índice de BI-RADS, e menos calcificações com indicação de biópsia no grupo de lipoenxertia para aumento mamário. Entretanto, Wang et al.26 encontraram microcalcificações agrupadas em 8 pacientes num total de 48 pacientes, todas foram submetidas a biopsias e foram identificadas como esteatonecrose, concluindo que a lipoenxertia mamária deve permanecer "proibida". Na discussão desse artigo, Del Vecchio27 ressalta que esta conclusão não está consoante com a literatura, deve-se melhorar ou adaptar as técnicas de imagem ao invés de "proibir" o procedimento, e, se for seguida a lógica do Dr. Wang, deve-se parar imediatamente com os procedimentos de mamoplastia redutora também. Na revisão de 20 pacientes feita por Veber et al., não foi encontrada alteração na densidade radiológica mamária e no BI-RADS, e conclui que a imagem radiológica no pós-operatório de lipoenxertia mamária não é um problema, e não deve ser um impedimento ao procedimento28,29. Wang et al. investigaram as características da ultrassonografia e o seguimento da evolução dos nódulos após a lipoenxertia mamária em 34 pacientes e concluem que a ultrassonografia é um procedimento simples e preciso no diagnóstico e no acompanhamento da evolução dos nódulos, podendo evitar biópsias desnecessárias30,31. Carvajal & Patiño32 estudaram as características específicas da esteatonecrose da lipoenxertia mamária em 20 pacientes e identificaram como a alteração mais comum a microcalcificação esparsa, seguido de cisto de óleo, e 3 pacientes que tiveram o BI-RADS de grau 3 foram reclassificadas como grau 2 após realização de mamografia digital.
Potencial carcinogênico
Um estudo retrospectivo multicêntrico conduzido por Petit et al.33 envolvendo três instituições europeias especializadas em câncer e reconstrução mamária - Milão, Paris e Lion - analisou as complicações imediatas e o perfil oncológico de 646 procedimentos de lipoenxertia após tratamento de câncer de mama, e teve o resultado de 2,8% de complicações (2% por liponecrose, 0,5 por infecção local, 0,2% por seroma, e 0,2% por pneumotórax), 2,07% de recorrência loco-regional no grupo após tratamento conservador, e 1,38% no grupo tratada com mastectomia. Este artigo demonstrou que a lipoenxertia apresenta um índice bastante baixo de complicações, não afeta o controle radiológico, entretanto, necessita de estudo controlado para provar a segurança na recorrência do câncer33.
Rigotti et al.34 examinaram a taxa de recorrência de câncer mamário após lipoenxertia no local ou perto do local da ressecção, comparando a incidência da recorrência pós-mastectomia e antes da lipoenxertia com a do depois da lipoenxertia, e não encontrou diferença. E devido à capacidade de regeneração do enxerto do lipoaspirado, e aparentemente sem efeito na recorrência de câncer, este procedimento é recomentado pelo Rigotti nas reconstruções pósmastectomia.
Série de casos
Fulton publicou uma série de 20 casos de aumento mamário com lipoenxertia em 1992, com o lipoaspirado lavado no Ringer Lactato, e obteve uma média de volume de injeção inicial de 289,5 ml taxa e com taxa de retenção de 71%. Na sua segunda série, publicada em 2003, com 65 pacientes, foi utilizado o lipoaspirado "encubado" em plasma rico em plaquetas (PRP), e obteve uma taxa de retenção de 73%, e um aumento médio mamário equivalente a um implante de 200 a 250 ml4. Salgarello et al.5 não notaram diferenças na sua revisão comparando 17 pacientes submetidas à lipoenxertia com a técnica do Coleman associada a PRP a 10%, com 25 pacientes submetida à lipoenxertia mamária, técnica do Coleman sem PRP.
Coleman & Saboeiro6 descreveram a sua técnica atraumática, com pequenos volumes, boa distribuição, e injeção intraparenquimatosa limitada, e relataram uma série de 17 pacientes, lipoenxertia foi feita com volume entre 50 e 450 ml, de uma a 3 sessões, com a estabilização do volume enxertado em 4 a 6 meses e com excelente resultado estético sete anos após o procedimento, sem complicações importantes. Duas pacientes tiveram câncer diagnosticado pela mamografia, uma na área que não recebeu lipoenxertia, e a outra, provavelmente na área enxertada. Ambas foram diagnosticadas e tratadas sem atraso.
Zocchi & Zuliani7 abandonaram a técnica de injeção em bloco intraparenquimatosa devido a alto índice de complicações e reabsorção do enxerto, concluíram que o resultado é técnica dependente, e passaram a utilizar a pré-expansão da mama com sistema BRAVA, separação das fases do lipoaspirado com a mesa vibratória, e injeção nos planos retromamário e subcutâneo, conseguindo uma média de retenção de 55% do volume transplantado e volume médio de 325 ml, com um mínimo de complicações.
Na série relatada por Zheng et al.8, com 66 pacientes, o lipoaspirado foi lavado com soro fisiológico e centrifugado a 600 rpm por 2 minutos, a média do volume injetado foi de 101 ml no subcutâneo, 73 ml subglandular. Dezessete pacientes foram submetidas a 3 sessões, 21 pacientes a 2 sessões, e 28 a uma sessão de lipoenxertia. No julgamento de 3 cirurgiões plásticos independentes, houve aumento significativo em 33%, aumento em 58% e sem aumento em 8%, e na avaliação das pacientes, 33% muito satisfeitas, 63% satisfeitas e 4% insatisfeita.
Na série do Illouz & Sterodimas9, de 1983 a 2007, 820 pacientes se submeteram à lipoenxertia, dentre total, aumento estético foi em 385 pacientes. O lipoaspirado foi decantado, com a média de volume injetado de 240 ml, no parênquima e no subcutâneo, evitando o retromamário, em de uma a 5 sessões de lipoenxertia. Foi necessário complementar o volume com implante de silicone em 36, mas a maioria das pacientes ficou satisfeita.
Delay et al.10 publicaram uma série retrospectiva de 10 anos com 880 transplantes de lipoaspirado centrifugado em 734 pacientes, sendo apenas 30 são de finalidade estética. A média de volume injetada foi de 140 ml, com perda de 30 a 40%, e estabilização em 3 a 4 meses. Alto índice de satisfação pelas pacientes e pelos cirurgiões foi atingido, não foi notado aumento de reincidência de câncer mamário, e a taxa de necrose gordurosa de 15% inicialmente caiu quando evitou a hipersaturação de volume transplantado.
Yoshimura et al.11 isolaram a fração vascular estromal, contendo as células tronco mesenquimais da metade do lipoaspirado e juntaram estas células a outra metade do lipoaspirado, denominando a técnica de "lipotransplante célula assistida" (CAL), e notaram, em 40 pacientes, a manutenção do volume final de 100 a 200 ml após a injeção média de 270 ml. Este volume não mudou significativamente após dois meses, e comparados a casos de lipoenxertia convencional, notou-se aumento da circunferência da mama, entretanto, este trabalho não é controlado.
Kamakura e Ito12 enriqueceram o lipoaspirado com "células regeneradoras derivadas de tecido adiposo" (ADRCs) processado pelo Celution 800 System® (dispositivo ainda em revisão pelo Food and Drug Administration - FDA), e prospectivamente fizeram uma análise não controlada em 20 pacientes que tiveram um aumento médio de 3,3 cm de circunferência mamária, 9 meses após a lipoenxertia.
O estudo prospectivo, multicêntrico com 81 pacientes, conduzido por Khoury et al.13 (Khoury foi o inventor do sistema Brava), comparou os resultados de transplante de lipoaspirado em mamas pré-expandidas por pressão negativa com os de lipoenxertia mamária sem expansão prévia de meta-análises de 6 recentes publicações. A expansão por pressão negativa foi feita durante 10 horas por dia por 4 semanas, e contínua por 36 a 48 horas imediatamente antes da lipoenxertia. O lipoaspirado é centrifugado a 15 g por 3 minutos, e a média de volume transplantado foi de 277 ml. De 3 a 6 meses, o volume permaneceu estável, comparado com a meta-análise, o aumento médio de volume em 12 meses foi de 233 ml contra 134 ml por mama sem expansão prévia, e a taxa de sobrevivência do enxerto foi de 82 ± 18% contra 55 ± 18%.
DISCUSSÃO
As questões em relação à lipoenxertia para aumento estético mamário, em termos de segurança, são a interferência na interpretação de exames de imagem na detecção de câncer e na possibilidade da célula tronco mesenquimal de causar câncer de mama. Em relação à eficácia, é a sobrevivência do enxerto, o volume do lipoaspirado que a mama comporta sem resultar em necrose, e a manutenção desse volume.
A necrose no centro do enxerto do lipoaspirado, quando volumoso, acarreta em formação de cisto de óleo, e pode evoluir para nodulação e calcificação. A técnica de injeção em bolo é a principal causa e já foi abandonada7. Atualmente, parece haver pouca discordância entre radiologistas em relação à facilidade de distinção entre as imagens de calcificação pós-lipoenxertia e a calcificação com suspeita de malignidade.
O potencial de carcinogênese da célula tronco mesenquimal ainda não é bem conhecido, as pesquisas in vitro e em modelo animal tem demostrado resultados contraditórios de propensão e de inibição. Não há nenhum relato na literatura de câncer mamário causado pela lipoenxertia, entretanto, ainda não é conclusiva a segurança nos casos da lipoenxertia após tratamento conservador de câncer de mama.
A outra discussão é em relação à eficácia e vantagens e desvantagens do procedimento. O transplante autólogo do lipoaspirado evita uma cicatriz, não acarreta alterações sensitivas, não está sujeito às consequências da presença de corpo estranho, o resultado é mais natural, a sua aplicação é versátil, e a área doadora também é uma cirurgia estética. Entretanto, o volume transplantado é limitado pela capacidade do recipiente e pela taxa de sobrevivência do enxerto, além de outras complicações específicas ou comuns aos procedimentos cirúrgicos35-41.
O resultado em geral ainda não é previsível, podendo ser necessárias várias sessões de lipoenxertia. Baseado nas séries revistas, consegue-se, com a técnica refinada, a manutenção de 60 a 70% do volume injetado, obtendo um aumento moderado, somente com lipoaspirado, sem adição de fatores de crescimento ou células tronco mesenquimais. Quando se desejam aumentos maiores e não houver pele mamária suficiente, o sistema de expansão externa a pressão negativa pode ser a solução.
No caso relatado, a paciente desejava aumento moderado e simetrização e não queria implante mamário de silicone. Apesar de não haver evidências contra, ainda é controversa a segurança na adição de fatores de crescimento ou de células mesenquimais no lipoaspirado transplantado, e não foi utilizado no caso. O aumento moderado do conteúdo sem aumento do continente pode resultar em mama mais firme.
CONCLUSÃO
As técnicas de lipoenxertia em geral e especificamente na mamária já estão bem estabelecidas. O controle oncológico pós-operatório por imagem também não é mais problemático. Não há evidências de aumento do potencial carcinogênico do transplante do lipoaspirado. A técnica é reprodutível, os resultados estão cada vez mais previsíveis, com maior volume transplantado numa só sessão, e maior taxa de manutenção desse volume, entretanto, uma curva de aprendizado mais longo pode ser necessária, uma vez que os resultados são técnica-dependentes.
REFERÊNCIAS
1. Parrish JN, Metzinger SE. Autogenous fat grafting and breast augmentation: a review of the literature. Aesthet Surg J. 2010;30(4):549-56. DOI: http://dx.doi.org/10.1177/1090820X10380859
2. Rosing JH, Wong MS, Sahar D, Sevenson TR, Pu LL. Autologous fat grafting for primary breast augmentation: a systematic review. Aesthetic Plast Surg. 2011;35(5):882-90. DOI: http://dx.doi.org/10.1007/s00266-011-9691-2
3. Mizuno H, Hyakusoku H. Fat grafting to the breast and adipose-derived stem cells: recent scientific consensus and controversy. Aesthet Surg J. 2010;30(3):381-7. DOI: http://dx.doi.org/10.1177/1090820X10373063
4. Fulton JE. Breast countouring with "gelled" autologous fat: a 10 year update. Int J Cosmet Surg Aesthetic Dermatol. 2003;5(2):155-63. DOI: http://dx.doi.org/10.1089/153082003769591272
5. Sagarello M, Visconti G, Rusciano A. Breast fat grafting with platelet-rich plasma: a comparative clinical study and current state of the art. Plast Reconstr Surg. 2011;127(6):2176-85. DOI: http://dx.doi.org/10.1097/PRS.0b013e3182139fe7
6. Coleman SR, Saboeiro AP. Fat grafting to the breast revisited: safety and efficacy. Plast Reconstr Surg. 2007;119(3):775-85. DOI: http://dx.doi.org/10.1097/01.prs.0000252001.59162.c9
7. Zocchi ML, Zuliani F. Biocompartimental breast lipostructuring. Aesthetic Plast Surg. 2008;32(2):313-28. PMID: 18188638 DOI: http://dx.doi.org/10.1007/s00266-007-9089-3
8. Zheng DN, Li QF, Lei H, Zheng SW, Xie YZ, Xu QH, et al. Autologous fat grafting to the breast for cosmetic enhancement: experience in 66 patients with long-term follow up. J Plast Reconstr Aesthet Surg. 2008;61(7):792-8. PMID: 18321802 DOI: http://dx.doi.org/10.1016/j.bjps.2007.08.036
9. Illouz YG, Sterodimas A. Autologous fat transplantation to the breast: a personal technique with 25 years of experience. Aesthetic Plast Surg. 2009;33(5):706-15. PMID: 19495856 DOI: http://dx.doi.org/10.1007/s00266-009-9377-1
10. Delay E, Garson S, Tousson G, Sinna R. Fat injection to the breast: technique, results, and indications based on 880 procedures over 10 years. Aesthet Surg J. 2009;29(5):360-76. DOI: http://dx.doi.org/10.1016/j.asj.2009.08.010
11. Yoshimura K, Sato K, Aoi N, Kurita M, Hirohi T, Harii K. Cellassisted lipotransfer for cosmetic breast augmentation: supportive use of adipose-derived stem/stromal cells. Aesthetic Plast Surg. 2008;32(1):48-55. PMID: 17763894 DOI: http://dx.doi.org/10.1007/s00266-007-9019-4
12. Kamakura T, Ito K. Autologous cell-enriched fat grafting for breast augmentation. Aesthetic Plast Surg. 2011;35(6):1022-30. DOI: http://dx.doi.org/10.1007/s00266-011-9727-7
13. Khouri RK, Eisenmann-Klein M, Cardoso E, Cooley BC, Kacher D, Gombos E, et al. Brava and autologous fat transfer is a safe and effective breast augmentation alternative: results of a 6-year, 81-patient, prospective multicenter study. Plast Reconstr Surg. 2012;129(5):1173-87. PMID: 22261565 DOI: http://dx.doi.org/10.1097/PRS.0b013e31824a2db6
14. Serra-Renom JM, Muñoz-Olmo J, Serra-Mestre JM. Treatment of grade 3 tuberous breasts with Puckett's technique (modified) and fat grafting to correct the constricting ring. Aesthetic Plast Surg. 2011;35(5):773-81. DOI: http://dx.doi.org/10.1007/s00266-011-9686-z
15. Khouri R, Del Vecchio D. Breast reconstrution and augmentation using pré-expansion and autologous fat transplantation. Clin Plast Surg. 2009;36(2):269-80. DOI: http://dx.doi.org/10.1016/j.cps.2008.11.009
16. Del Vecchio DA, Bucky LP. Breast augmentation using preexpansion and autologous fat transplantation: a clinical radiographic study. Plast Reconstr Surg. 2011;127(6):2441-50. PMID: 21617476 DOI: http://dx.doi.org/10.1097/PRS.0b013e3182050a64
17. Hughes LM, Stephen C, Johnson AB, Wilson S. Breast augmentation in Familial Partial Lipodystrophy: a case report. J Plast Reconstr Aesthet Surg. 2011;64(5):e121-4. DOI: http://dx.doi.org/10.1016/j.bjps.2011.01.001
18. Rigotti G, Marchi A, Galiè M, Baroni G, Benati D, Krampera M, et al. Clinical treatment of radiotherapy tissue damage by lipoaspirate transplant: a healing process mediated by adipose-derived adult stem cells. Plast Reconstr Surg. 2007;119(5):1409-22. DOI: http://dx.doi.org/10.1097/01.prs.0000256047.47909.71
19. Penettiere P, Marchetti L, Accorsi D. The serial free fat transfer in irradiated prosthetic breast reconstructions. Aesthetic Plast Surg. 2009;33(5):695-700. DOI: http://dx.doi.org/10.1007/s00266-009-9366-4
20. Sultan SM, Stern CS, Allen RJ Jr, Thanik VD, Chang CC, Nguyen PD, et al. Human fat grafting alleviates radiation skin damage in a murine model. Plast Reconstr Surg. 2011;128(2):363-72. DOI: http://dx.doi.org/10.1097/PRS.0b013e31821e6e90
21. Gutowski KA; ASPS Fat Graft Task Force. Current applications and safety of autologous fat grafts: a report of the ASPS fat graft task force. Plast Reconstr Surg. 2009;124(1):272-80. PMID: 19346997 DOI: http://dx.doi.org/10.1097/PRS.0b013e3181a09506
22. Gir P, Oni G, Brown SA, Mojallal A, Rohrich RJ. Human adipose stem cells: current clinical applications. Plast Reconstr Surg. 2012;129(6):1277-90. PMID: 22634645 DOI: http://dx.doi.org/10.1097/PRS.0b013e31824ecae6
23. Hanson SE, Bentz ML, Hematti P. Mesenchymal stem cell therapy for nonhealing cutaneous wounds. Plast Reconstr Surg. 2010;125(2):510-6. PMID: 20124836 DOI: http://dx.doi.org/10.1097/PRS.0b013e3181c722bb
24. Li H, Zimmerlin L, Marra KG, Donnenberg VS, Donnenberg AD, Rubin JP. Adipogenic potential of adipose stem cell subpopulations. Plast Reconstr Surg. 2011;128(3):663-72. PMID: 21572381 DOI: http://dx.doi.org/10.1097/PRS.0b013e318221db33
25. Rubin JP, Coon D, Zuley M, Toy J, Asano Y, Kurita M, et al. Mammographic changes after fat transfer to the breast compared with changes after breast reduction: a blinded study. Plast Reconstr Surg. 2012;129(5):1029-38. PMID: 22261561 DOI: http://dx.doi.org/10.1097/PRS.0b013e31824a2a8e
26. Wang CF, Zhou Z, Yan YJ, Zhao DM, Chen F, Qiao Q. Clinical analyses of clustered microcalcifications after autologous fat injection for breast augmentation. Plast Reconstr Surg. 2011;127(4):1669-73. PMID: 21187809 DOI: http://dx.doi.org/10.1097/PRS.0b013e318208d1e4
27. Del Vecchio DA. Discussion: Clinical analyses of clustered microcalcifications after autologous fat injection for breast augmentation. Plast Recontr Surg. 2011;127(4):1674-6. PMID: 21460674 DOI: http://dx.doi.org/10.1097/PRS.0b013e3182100ddd
28. Veber M, Tourasse C, Toussoun G, Moutran M, Mojallal A, Delay E. Radiographic findings after breast augmentation by autologous fat transfer. Plast Reconstr Surg. 2011;127(3):1289-99. PMID: 21364429 DOI: http://dx.doi.org/10.1097/PRS.0b013e318205f38f
29. Veber M, Tourasse C, Moutran M, Mojallal A. Clinical analyses of clustered microcalcifications after autologous fat injection for breast augmentation. Plast Reconstr Surg. 2012;129(1):168e-9e. DOI: http://dx.doi.org/10.1097/PRS.0b013e3182362e2b
30. Wang H, Jiang Y, Meng H, Zhu Q, Dai Q, Qi K. Sonographic identification of complications of cosmetic augmentation with autologous fat obtained by liposuction. Ann Plast Surg. 2010;64(4):385-9. PMID: 20224341 DOI: http://dx.doi.org/10.1097/SAP.0b013e3181b14265
31. Wang H, Jiang Y, Meng H, Yu Y, Qi K. Sonographic assessment on breast augmentation after autologous fat graft. Plast Reconstr Surg. 2008;122(1):36e-8e. DOI: http://dx.doi.org/10.1097/PRS.0b013e3181774732
32. Carvajal J, Patiño JH. Mammographic findings after breast augmentation with autologous fat injection. Aesthet Surg J. 2008;28(2):153-62. DOI: http://dx.doi.org/10.1016/j.asj.2007.12.008
33. Petit JY, Lohsiriwat V, Clough KB, Sarfati I, Ihrai T, Rietjens M, et al. The oncologic outcome and immediate surgical complications of lipofilling in breast cancer patients: a multicenter study-Milan-Paris-Lyon experience of 646 lipofilling procedures. Plast Reconstr Surg. 2011;128(2):341-6. PMID: 21502905 DOI: http://dx.doi.org/10.1097/PRS.0b013e31821e713c
34. Rigotti G, Marchi A, Stringhini P, Baroni G, Galiè M, Molino AM, et al. Determining the oncological risk of autologous lipoaspirate grafting for post-mastectomy breast reconstruction. Aesthetic Plast Surg. 2010;34(4):475-80. PMID: 20333521 DOI: http://dx.doi.org/10.1007/s00266-010-9481-2
35. Mu DL, Luan J, Mu L, Xin MQ. Breast augmentation by autologous fat injection grafting menagement and clinical analysis of complications. Ann Plast Surg. 2009;63(2):124-7. DOI: http://dx.doi.org/10.1097/SAP.0b013e318189a98a
36. Blumenschein AR, Freitas-Júnior R, Tuffanin AT, Blumenschein DI. Lipoenxertia nas mamas: procedimento consagrado ou experimental? Rev Bras Cir Plást. 2012;27(4):616-22.
37. Kim H, Yang EJ, Bang SI. Bilateral liponecrotic pseudocysts after breast augmentation by fat injection: a case report. Aesthetic Plast Surg. 2012;36(2):359-62. DOI: http://dx.doi.org/10.1007/s00266-011-9790-0
38. Lazzaretti MG, Giovanardi G, Gibertoni F, Cagossi K, Artioli F. A late complication of fat autografting in breast augmentation. Plast Reconstr Surg. 2009;123(2):71e-2e. DOI: http://dx.doi.org/10.1097/PRS.0b013e3181959571
39. Hyakusoku H, Ogawa R, Ono S, Ishii N, Hirakawa K. Complications after autologous fat injection to the breast. Plast Reconstr Surg. 2009;123(1):360-70. DOI: http://dx.doi.org/10.1097/PRS.0b013e31819347ba
40. Lee KS, Seo SJ, Park MC, Park DH, Kim CS, Yoo YM, et al. Sepsis with multiple abscesses after massive autologous fat grafting for augmentation mammoplasty: a case report. Aesthetic Plast Surg. 2011;35(4):641-5. DOI: http://dx.doi.org/10.1007/s00266-010-9605-8
41. Bircoll M. Clinical analyses of clustered microcalcifications after autologous fat injection for breast augmentation. Plast Reconstr Surg. 2011;128(6):779e. PMID: 22094783 DOI: http://dx.doi.org/10.1097/PRS.0b013e318230bf6a
1. Sociedade Brasileira de Cirurgia Plástica, Rio de Janeiro, RJ, Brasil
2. Hospital Federal dos Servidores do Estado do Rio de Janeiro, Rio de Janeiro, RJ, Brasil
Instituição: Chang Yung Chia Cirurgia Plástica, Rio de Janeiro, RJ, Brasil.
Autor correspondente:
Chang Yung Chia
Rua Carlos Oswald, 140 bloco 1, apto. 206, Barra da Tijuca
Rio de Janeiro, RJ, Brasil CEP 22793-120
E-mail: changplastica@gmail.com
Artigo submetido: 26/12/2012.
Artigo aceito: 1/9/2013.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter