

Articles - Year 2003 - Volume 18 -
Efeitos da L-Arginina sobre as Concentrações in vivo de Metabólitos no Sangue e em Retalho Miocutâneo Contendo Cicatriz Cirúrgica, em Ratos Wistar
Effects of L-Arginine on in vivo Concentrations of Metabolites in the Blood and in Myocutaneous Flaps with Surgical Scars, in Wistar Rats
RESUMO
A epitelização, a contração e a deposição da matriz de tecido conjuntivo constituem mecanismos pelos quais as feridas cicatrizam. Estudos demonstraram que a L-arginina favorece a cicatrização, aumentando a síntese de colágeno. Objetivou-se, neste trabalho, estudar os efeitos da suplementação da L-arginina sobre concentrações in vivo de glicose, piruvato, lactato e corpos cetônicos no sangue e retalho miocutâneo em cicatrização.
Quarenta e oito ratos brancos, machos, da linhagem Wistar, foram distribuídos em dois grupos: (G-1/Controle) e (G-2/Experimento). Os animais do G-1 receberam suplementação isoprotéica de caseinato e os do grupo/G-2 de L-arginina, por gavagem, diariamente. Ambos os grupos foram submetidos à confecção de retalho miocutâneo, pediculado e dorsal. No pós-operatório, cada grupo foi subdividido em três subgrupos e, após 7, 14 e 30 dias, foram coletadas amostras de sangue e tecidos cicatriciais para análises enzimáticas. A queda das concentrações sanguíneas, de piruvato, lactato e corpos cetônicos no 14º dia sugere maior utilização desses metabólitos nos tecidos periféricos por possível ação anabólica da oferta de L-arginina. O aumento das concentrações tissulares, no retalho miocutâneo, de corpos cetônicos no 30º dia de pós-operatório nos animais tratados com suplementação alimentar de L-arginina traduz provável aumento de captação desses metabólitos pelos tecidos em cicatrização. Os resultados sugerem que a suplementação de L-arginina tem efeito sobre as concentrações séricas de substratos e sobre a cicatrização cutânea e muscular.
Palavras-chave: Trauma cirúrgico; metabolismo; cicatrização; L-arginina; ratos
ABSTRACT
The epithelialization, contraction and deposition of connective tissue are the mechanisms by which wounds heal. Studies have shown that L-Arginine favors wound healing by increasing the synthesis of collagen. This paper aimed at studying the effects of L-Arginine supplementation on in vivo concentrations of glucose, pyruvate, lactate and ketone bodies in the blood and in myocutaneous flaps undergoing healing. Forty-four white male Wistar rats were distributed in two groups: (G-l/Control) and (G-2/Experiment). The G-1 animals received iso-proteic casein supplementation and the G-2 group received L-Arqinine by gavage daily. Both groups were submitted to pediculated and dorsal myocutaneous flaps. In the post-operative period, each group was subdivided into three subgroups and, after 7, 14 and 30 days) blood and scar tissue samples were collected for analyses of enzymes. The drop in blood concentrations of pyruvate, lactate and ketone bodies on the l4th day suggests higher utilization of these metabolites in peripheral tissues by a possible anabolic action of L-Arginine. The increase of tissue concentrations of leetone bodies in the myocutaneous flap on the 30th; post-operative day in animals treated with L-Arginine food supplementation indicates a probable increase in the utilization of these metabolites by tissues under scarring. The results suggest that L-Arginine supplementation has an effect on serum concentrations of substrates and on shin and muscle scarring.
Keywords: Surgical trauma; metabolism; scarring; L-Arginine; rats
O processo de cicatrização pode ser compreendido como uma reação de defesa do organismo agredido produzida por qualquer agente traumático para manter sua integridade, utilizado para restabelecer uma solução de continuidade de seus tecidos e consistindo em quimiotaxia, divisão celular, neovascularização, síntese de matriz protéica extracelular e remodelação de cicatriz(1, 2).
Graças às descobertas em metabologia cirúrgica, bioquímica e nutrição, surgiu uma nova época na qual se pretende interferir na biologia molecular, influindo na síntese de substâncias responsáveis pelo desenvolvimento dos fenômenos cicatriciais. Entretanto, em nível local, persiste o princípio de "interferência mínima", isto é, causar o mínimo de trauma químico e cirúrgico aos tecidos danificados, para que o processo de cicatrização seja levado a termo sem modificar significativamente suas células originais(3,4).
O processo de cicatrização resulta de um mecanismo competitivo entre a síntese e a lise do colágeno. Assim, qualquer fator que aumente a lise ou faça diminuir a síntese do colágeno pode concorrer para a alteração da cicatrização(5).
Estudos experimentais demonstraram que um suplemento de 1% de arginina na dieta de ratos aumentava a força tênsil do tecido lesionado e a deposição de colágeno(6).
Doses farmacológicas de arginina aumentaram significativamente a quantidade de hidroxiprolina, presente quase exclusivamente no colágeno, no tecido celular subcutâneo em humanos, demonstrando que a arginina pode aumentar a síntese de colágeno reparativo(7).
Objetivou-se, neste trabalho, estudar por meio de métodos enzimáticos os efeitos da suplementação alimentar de L-arginina sobre as concentrações in vivo de glicose, piruvato, lactato e corpos cetônicos no sangue e no retalho miocutâneo em processo de cicatrização.
MÉTODOS
A pesquisa foi realizada de acordo com as Normas Internacionais para a Pesquisa Biomédica em Animais (1990) e de acordo com a Lei Federal no. 6.638, de 08 de maio de 1979. Utilizaram-se 48 ratos albinos (Rattus norvegicus albinus), da linhagem Wistar, machos, com peso oscilando entre 250 e 300 g, provenientes do biotério central da Universidade Federal do Ceará e mantidos no Laboratório de Cirurgia Experimental do Departamento de Cirurgia da Faculdade de Medicina (UFC) em gaiolas de polipropileno, recebendo água e alimento adequado ad libitum até 12 horas antes do início de cada experimento. Os ratos foram distribuídos eqüitativamente em dois grupos: Grupo 1 (G-1 - Controle) e Grupo 2 (G-2 - Experimento). Cada grupo foi subdividido em 3 subgrupos (n=8). Após a indução da anestesia geral inalatória, com éter dietílico, confeccionou-se um retalho miocutâneo dorsal, pediculado na sua extremidade cefálica, medindo 3x3x3 cm (Figs. 1 e 2). A sutura do retalho foi feita com fio de náilon monofilamentado, em pontos separados. Foi utilizada iodopovidona para antissepsia do campo cirúrgico. Os animais do grupo controle (G-1) receberam suplementação alimentar, administrada por gavagem, de caseinato de cálcio (aproximadamente 5% do valor calórico total (VCT) ingerido/dia para ratos com peso na faixa selecionada para este estudo, ou seja, 1,0 g de caseinato de cálcio dissolvido em 3,0 ml de soro fisiológico(8)), diariamente. Os animais do grupo experimento (G-2) receberam, também diariamente, por gavagem, 5% do VCT/dia - 1,0 g de L-arginina dissolvida em 3,0 ml de soro fisiológico. Após 7, 14 e 30 dias do início da suplementação alimentar e do ato cirúrgico, retirava-se um fragmento do retalho dorsal, sob anestesia inalatória, e coletava-se 2,0 ml de sangue arterial, seguindo-se o sacrifício do animal por exposição mais prolongada ao anestésico.
Fig. 1 - Demarcação do retalho miocutâneo.
Fig. 2 - Retalho miocutâneo (detalhe).
As concentrações dos metabólitos no sangue e no retalho miocutâneo foram determinadas por métodos de ensaio enzimático(9, 10, 11). Foram aferidas neste estudo as concentrações de D-glicose, piruvato, lactato e corpos cetônicos (acetoacetato e 3-hidroxibutirato). As concentrações dos metabólitos foram calculadas em µmol/g de tecido fresco ou µmol/ml de sangue.
Os resultados foram expressos como Média ±E.P.M. (Erro Padrão da Média). O teste não paramétrico de Mann-Whitney foi utilizado para a análise estatística, fixando-se o valor de significância em 5% (p < 0,05).
RESULTADOS
Não se observaram diferenças significantes na glicemia nem nas concentrações de glicose no retalho miocutâneo em nenhum dos tempos estudados (Figs. 3 e 4).
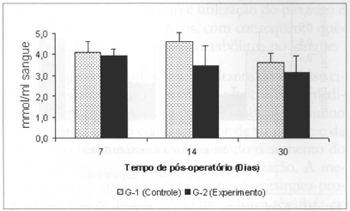
Fig. 3 - Concentração de glicose no sangue(µmol/ml de sangue).
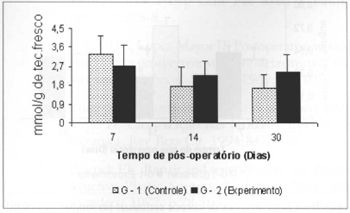
Fig. 4 - Concentrações de glicose no retalho miocutâneo(µmol/g de tecido fresco).
As concentrações de piruvato aferidas no sangue foram significantemente menores (0,453 ± 0,12 versus 1,597 ± 0,41), comparando-se os valores aferidos nos grupos G-2 versus G-1 no 14º dia de pós-operatório (Fig. 5). Não se observaram diferenças significantes nas concentrações de piruvato no retalho miocutâneo em nenhum dos tempos estudados (Fig. 6).

Fig. 5 - Concentrações de piruvato no sangue(µmol/ml de sangue). *(p< 0,05) quando comparado ao respectivo controle.+(p < 0,01) quando comparado ao 7º dia no grupo de controle.
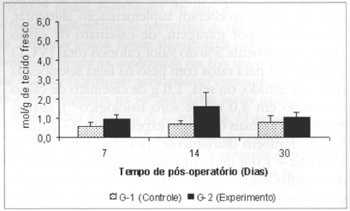
Fig. 6 - Concentrações de piruvato no retalho miocutâneo(µmol/g de tecido fresco).
As concentrações de lactato no sangue dos animais do grupo G-2 foram significantemente menores (5,103±0,78 versus 7,795±0,51) que as concentrações aferidas no respectivo controle (G-1) no 14º dia. Observou-se aumento significante (7,795±0,51 versus 3,629±0,86) nas concentrações de lactato no sangue dos animais do G-2, no 14º dia, em comparação aos valores aferidos no 7º dia de pós-operatório no mesmo grupo (Fig. 7). Não foram observadas diferenças significantes nas concentrações de lactato aferidas no retalho miocutâneo em nenhum dos tempos estudados (Fig. 8).
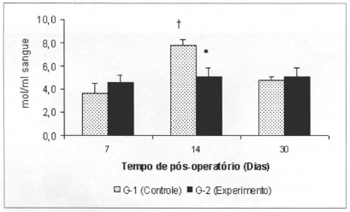
Fig. 7 - Concentrações de lactato no sangue(µmol/ml de sangue).* (p< 0,01) quando comparado ao respectivo controle. +(p< 0,05) quando comparado ao 7º no grupo controle.
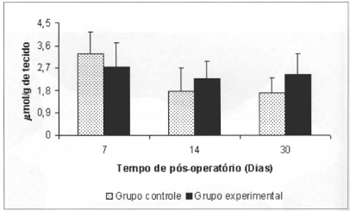
Fig. 8 - Concentrações de lactato no retalho miocutâneo(µmol/g de tecido fresco).
Ocorreu queda significante (0,325±0,06 versus 0,725±0,07) nas concentrações de corpos cetônicos no sangue dos animais do grupo G-2 em relação às concentrações aferidas no grupo G-1, no 14º dia de pós-operatório. Observou-se ainda queda significante (0,325±0,06 versus 0,516±0,054) nas concentrações de corpos cetônicos no sangue dos animais do grupo G-2, no 14.º dia, quando comparadas às concentrações aferidas no 7º dia no mesmo grupo (Fig. 9). Observou-se ainda aumento significante (0,525±0,10 versus 0,164±0,04) nas concentrações de corpos cetônicos no retalho miocutâneo (Fig. 10) no 30º dia em relação às concentrações aferidas no 7º dia de pós-operatório, nos animais tratados (G-2).
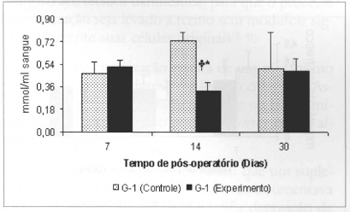
Fig. 9 - Concentrações de corpos cetônicos no sangue(µmol/ml de sangue).*(p < 0,05) quando comparado ao respectivo controle. +(p< 0,05) quando comparado ao 7º no grupo controle.
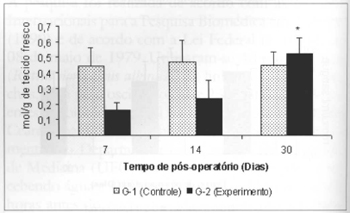
Fig. 10 - Concentrações de corpos cetônicos na pele(µmol/g de tecido fresco). *(p < 0,05) quando comparado ao 7º dia no grupo experimento.
DISCUSSÃO
A queda significante nas concentrações sanguíneas de piruvato, lactato e corpos cetônicos no 14º pós-operatório, em plena fase proliferativa fibroblástica do processo de cicatrização, nos animais tratados com suplementação alimentar de L-arginina, pode ser explicada pela ação anabólica desse aminoácido, que é secretagogo do hormônio do crescimento e induz a liberação de insulina e IGF-1. Esse fator de crescimento insulina símile está presente no fígado, plasma e fibroblastos e estimula a síntese de proteoglicanos sulfatados, de colágeno e a proliferação de fibroblastos.
A possível elevação na insulinemia sinalizaria para o fígado uma redução na cetogênese, o que explicaria a queda das concentrações de corpos cetônicos no sangue. Do mesmo modo, a ação anabólica desses fatores levaria a maior captação e utilização do piruvato e lactato por tecidos periféricos, com conseqüente queda nas concentrações desses metabólitos no sangue.
Sabe-se que a NO-sintetase, resultante do estresse cirúrgico, facilita a síntese do óxido nítrico (NO) mediante seqüência específica, a partir do radical guanidino da arginina, agindo como inibidor da trombose e da agregação plaquetária, condicionando o aumento do fluxo sanguíneo nos tecidos em cicatrização. A melhora da oxigenação no local da ferida cirúrgica propicia a epitelização e o aumento da força tênsil da cicatriz por formação de colágeno mais estável, auxiliando a quimiotaxia e facilitando, assim, o processo cicatricial(12,13,14).
O aumento significante nas concentrações de corpos cetônicos no retalho miocutâneo no 30º dia de pós-operatório em relação aos valores aferidos no 7º dia, nos animais tratados (G-2), pode ser explicada por um maior anabolismo nos animais recipientes de L-arginina exógena, com elevação da captação e utilização desse metabólito por tecidos em cicatrização.
Os resultados sugerem que a suplementação alimentar de L-arginina, por sua ação anabólica, teria efeito sobre as concentrações de substratos e sobre a cicatrização cutânea e muscular.
CONCLUSÕES
1. A suplementação alimentar de L-arginina induz uma redução significante nas concentrações sanguíneas de piruvato, lactato e corpos cetônicos, no 14.º dia de pós-operatório da confecção de retalho miocutâneo.
2. A suplementação alimentar de L-arginina induz um aumento significante nas concentrações tissulares de corpos cetônicos no 30º dia de pós-operatório, em retalho miocutâneo em cicatrização.
BIBLIOGRAFIA
1. Biondo-Simões MLP. Cicatrização. In: Castro e Silva Jr O. Modelos experimentais de pesquisa em cirurgia. São Paulo: Robe; 1998. p.265-74.
2. Modolin MLA, Bevilacqua RG, Margarido NF, Gonçalves EL. Cicatrização das feridas abertas na desnutrição com hipoproteinemia. Estudo experimental. Rev Hosp Clín Fac Med S Paulo. 1982;37:275-8.
3. Polk Jr HC, Lopez-Mayor JF. Postoperative wound infection: a prospective study of determinant factors and prevention. Surgery. 1969;66:103.
4. Corsi RCC, Corsi PR, Pirana S, Muraco FAE, Jorge D. Cicatrização das feridas - Revisão da literatura. Rev Bras Cir. 1994;84:19-53.
5. Peacock EE. Repair and regeneration. In: Reconstructive Plastic Surgery. 2.ed. New York: WB Saunders; 1977. p.78-103.
6. Seifter E, Rettura G, Barbul A, Levenson SM. Arginine: an essential amino acid for injured rats. Surgery. 1978;84(2):224-30.
7. Barbul A, Lazarou SA, Efron DT, Wasserkrug HL, Efron G. Arginine enhances wound healing and lymphocyte immune responses in humans. Surgery. 1990;108:331-7.
8. Silva LFG, Cavalcante JLBG, Soares FSD, Moraes MO, Vasconcelos PRL. Effects of arginine-enriched enteral nutrition in Walker tumor bearing rats in the kidney. Braz J Urol. 2001;27(2):178-85.
9. Hohorst apud Vasconcelos PRL. Hepatic metabolism during sepsis. 1987, 55f. Thesis (Ph. D.) University of Oxford.
10. Williamson DH, Mellanby J, Krebs HA. Enzymic determination of D(-)-beta-hydroxybutyric acid and acetoacetic acid in blood. Biochem J. 1962;15:90-6.
11. Slein apud Vasconcelos PRL. Hepatic metabolism during sepsis. 1987, 54f. Thesis (Ph. D.) University of Oxford.
12. Modolin MLA, Bevilacqua RG. Cicatrização das feridas. Síntese das aquisições recentes. Rev Bras Clín Terap. 1985;14(6):208.
13. Faintuch J, Faintuch J. Efeitos cardiovasculares da arginina e do óxido nítrico. Rev Hosp Clín Fac Med S Paulo. 1995;50:334-8.
14. Cohen K, Digelmann LR, Yager DR, Wornum ILL, Graham MF, Croffland MC. Wound care and wound healing. In: Schwartz SI. Principles of surgery. 7. ed. New York: Mcgraw-Hill; 1999. p. 263-95.
I. Membro Titular da Sociedade Brasileira de Cirurgia Plástica. Mestranda, Programa de Pós-Graduação Stricto Sensu em Cirurgia, Departamento de Cirurgia, UFC.
II. Membro Titular (Fellow) do American College of Surgeons, Mestre em Cirurgia pela Universidade Federal do Ceará. Prof. Adjunto, Faculdade de Medicina (UFC).
III. Mestre em Farmacologia pela Universidade Federal do Ceará.
IV. Estudantes, Faculdade de Medicina, Universidade Federal do Ceará.
V. Professor Doutor (Ph.D), Coordenador do Curso de Pós-Graduação Stricto Sensu em Cirurgia da Faculdade de Medicina (UFC), Fortaleza, CE.
Endereço para correspondência:
Paulo Roberto Leitão de Vasconcelos
Depto. de Cirurgia
R. Prof. Costa Mendes, 1608 - 3º and.
Fortaleza - Ceará - 60430-140
Fone: (85) 288-8063 - Fax: (85) 288-8064
e-mail: mcirur@npd.ufc.br
Trabalho realizado no Laboratório de Cirurgia Experimental (LABCEX), do Depto. de Cirurgia, Programa de Pós-Graduação Stricto Sensu em Cirurgia, Faculdade de Medicina da Universidade Federal do Ceará, (UFC), Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter