

Original Article - Year 2017 - Volume 32 -
Reconstrução de parede torácica em extensas ressecções oncológicas
Reconstruction of the chest wall in extensive oncological resections
RESUMO
INTRODUÇÃO: Apesar do avanço no diagnóstico e no tratamento das pacientes com neoplasia mamária, ainda há casos que se apresentam como doença localmente avançada. Nesse contexto, o controle oncológico requer ressecções extensas e complexos procedimentos reparadores. A participação do cirurgião plástico nas equipes multidisciplinares de tratamento oncológico tem apresentado importância crescente tanto nas etapas de planejamento como de execução. O objetivo é analisar prospectivamente casos de pacientes com extensas ressecções no tórax e reconstrução de parede torácica quanto aos seus resultados e complicações no período de 2014-2016.
MÉTODOS: Seguimento prospectivo por 6 meses de 15 casos de pacientes submetidas a extensas ressecções oncológicas no tórax e reconstrução por um mesmo cirurgião plástico em hospitais da rede pública de São Paulo-SP. Foram coletados os dados: idade, diagnóstico, queixa pré-operatória, extensão da área de ressecção e incidência de complicações locais.
RESULTADOS: As pacientes tinham idade média de 49,2 anos, a queixa mais comum era massa papável, o diagnóstico mais comum era neoplasia da mama (80%), a maioria das ressecções preservou o plano muscular e a área média de ressecção foi de 259,2 cm2. O retalho miocutâneo do grande dorsal em V-Y foi o mais utilizado, e o toracoabdominal foi o segundo. Epiteliólise foi detectada em 13,3% das pacientes e necrose parcial menor que 5% do retalho em 13,3%.
CONCLUSÃO: Na presente casuística, as pacientes portadoras de neoplasias extensas no tórax representaram um desafio para a reconstrução local, necessitando de planejamento pré-operatório minucioso e com múltiplas opções. A participação do cirurgião plástico no tratamento desses casos contribuiu para redução de morbidade e demonstrou baixo índice de complicações.
Palavras-chave: Procedimentos cirúrgicos reconstrutivos; Neoplasias da mama; Mamoplastia; Parede torácica; Neoplasias de tecidos moles.
ABSTRACT
INTRODUCTION: In spite of advances in the diagnosis and treatment of patients with breast cancer, there are still cases that present with locally advanced disease. In this context, cancer control requires extensive resections and complex repair procedures. The participation of the plastic surgeon in the multidisciplinary cancer treatment teams has been increasingly important in both the planning and execution stages. The aim of this study is to prospectively analyze patients who underwent extensive chest resections and thoracic wall reconstruction with regard to their results and complications in the period 2014-2016.
METHODS: Prospective 6-month follow-up of 15 patients who underwent extensive oncological resections in the chest and reconstruction by the same plastic surgeon in public hospitals of São Paulo was done. The following data were collected: age, diagnosis, preoperative complaint, extent of resection area, and incidence of local complications.
RESULTS: Patients had a mean age of 49.2 years, the most common complaint was a papillary mass, the most common diagnosis was breast cancer (80%), the most resection area preserved was the muscular plane, and the mean resection area was 259.2 cm2. The V-Y latissimus dorsi myocutaneous flap was the most used, and the thoracoabdominal flap was the second. Epitheliolysis was detected in 13.3% of the patients, and partial necrosis less than 5% of the flap in 13.3%.
CONCLUSION: In the present study, patients with extensive cancers in the thorax presented a challenge for local reconstruction, requiring detailed preoperative planning and multiple options. The participation of the plastic surgeon in the treatment of these patients contributed to the reduction of morbidity rate and low rate of complications.
Keywords: Reconstructive surgical procedures; Breast cancers; Mammoplasty; Thoracic wall; Soft tissue cancer.
O câncer de mama é a neoplasia mais comum em mulheres no Brasil e no mundo, excluindo-se as neoplasias de pele não melanoma1,2. Com o diagnóstico precoce e o avanço nos tratamentos, a sobrevida dessas pacientes vem crescendo a cada ano, mesmo em estádios mais avançados, tornando a reabilitação funcional e social por meio da reconstrução de mama e parede torácica partes importantes do tratamento dessas pacientes1.
Apesar das campanhas de rastreamento populacional e ações educativas, a neoplasia localmente avançada, embora não represente a maioria dos casos de câncer de mama, pode abranger até 20-25% deles3. Em populações assistidas pelo serviço público de saúde, esses casos ainda são frequentes possivelmente pela dificuldade no acesso aos centros de referência e no diagnóstico precoce. Trata-se do estádio III, em que as pacientes têm a mama comprometida em grande extensão (2-5 cm ou mais de 5 cm), invasão de pele ou parede torácica e/ou linfonodos regionais, sem apresentar metástase à distância4.
Certamente, é a situação que oferece maiores desafios ao cirurgião plástico quanto ao planejamento e à execução da reconstrução local. Ainda quando a sobrevida livre de doença não pode ser o principal objetivo do tratamento, como em tumores muito avançados, a reconstrução é fundamental para conferir condições locais de tratamento adjuvante (fechar áreas cruentas para a realização de radioterapia) e aumentar a qualidade de vida no tempo de sobrevida5,6.
A evolução das técnicas de reconstrução de parede torácica tem sólida e íntima relação com o tratamento do câncer de mama por mastectomia. Desde os tempos de Halsted, em 1882, em que as feridas eram deixadas a cicatrizar por segunda intenção, até o surgimento dos retalhos musculares em 1896 com Tansini e, mais recentemente, o uso de microcirugia7.
A dificuldade técnica da reconstrução de parede torácica é ditada em sua maior parte pela variabilidade na extensão das ressecções e, consequentemente, pelo caráter pouco previsível da extensão dos defeitos resultantes. O ponto principal é a definição da necessidade de reconstrução do arcabouço ósseo costal, indicada quando quatro ou mais costelas são ressecadas ou quando há um defeito lateral de mais de 5 cm, situações em que a estabilidade do arcabouço torácico é comprometida8.
A necessidade de cobertura de estruturas nobres e extensas áreas torna os retalhos musculares ou miocutâneos as opções mais utilizadas para a reconstrução de extensos defeitos oncológicos no tórax7,9. Os retalhos tradicionalmente mais usados são o miocutâneo do grande dorsal, miocutâneo transverso do reto abdominal e muscular do peitoral maior associado a enxertia de pele10. Além disso, desde que não haja materiais sintéticos ou exposição óssea, também constituem valiosas opções os retalhos fasciocutâneos locais como o toracoepigástrico e toracoabdominal. Retalhos cutâneos ao acaso como o romboide e os de avanço, e, mesmo os enxertos de pele, também têm lugar em casos particulares, nos quais a simplicidade da estratégia reparadora é fundamental.
A participação do cirurgião plástico no tratamento desses pacientes tem tido importância crescente dentro de equipes multidisciplinares, envolvendo mastologistas, cirurgiões torácicos e oncologistas. Abandonou-se a ideia de que a presença do profissional reparador no planejamento terapêutico pré-operatório poderia comprometer o rigor oncológico. Na realidade, foi possível reconhecer que o cirurgião plástico, com sua habilidade de realizar grandes intervenções reparadoras com versatilidade, permitiu o tratamento de lesões previamente consideradas irressecáveis e contribuiu para reduzir o tempo de recuperação desses pacientes, além de lhes fornecer maior conforto e qualidade de vida7,11.
OBJETIVO
Analisar prospectivamente casos de pacientes submetidas à reconstrução de parede torácica após extensas ressecções oncológicas quanto às estratégias cirúrgicas adotadas, seus resultados e complicações.
Definir o papel do cirurgião plástico no planejamento terapêutico de pacientes com tumores localmente avançados da mama.
MÉTODOS
Foram avaliadas no pré-operatório, tratadas por cirurgia e seguidas prospectivamente no pós-operatório 15 pacientes submetidas a extensas ressecções de lesões torácicas e reconstrução de parede torácica em dois serviços de referência da rede pública de saúde em São Paulo-SP, Brasil.
Os procedimentos desse trabalho seguiram os princípios de Helsinque e as pacientes assinaram um Termo de Consentimento Livre e Esclarecido para inclusão no grupo estudo.
Todas as paciente foram operadas pelo mesmo cirurgião plástico (MMAS) em conjunto com equipes de Cirurgia Torácica e/ou Mastologia. Receberam seguimento pós-operatório de 3-6 meses.
Foi realizada documentação fotográfica padronizada pré, intra e pós-operatória, conforme as condições clínicas das pacientes.
Durante o acompanhamento, realizou-se a coleta dos seguintes dados: idade, sintoma inicial, diagnóstico, extensão da área de ressecção da lesão oncológica, profundidade da ressecção (plano remanescente), técnica utilizada para reconstrução, incidência de complicações associadas à intervenção cirúrgica e óbito em 6 meses.
Os dados foram analisados por meio de estatística descritiva e medidas-resumo, sendo as variáveis numéricas expressas em médias e as variáveis categóricas em porcentagens.
Técnica cirúrgica
Descrevem-se a seguir as técnicas cirúrgicas dos principais retalhos utilizados neste estudo:
Retalho miocutâneo do grande dorsal em VY
A marcação foi realizada com a paciente em posição ortostática confeccionando-se um triângulo cuja base é a margem lateral do defeito torácico anterior. As laterais do triângulo são formadas por linhas que partem das margens superior e inferior do defeito na parede torácica anterolateral e convergem para a linha média posterior do tórax. A convergência pode ocorrer antes da linha média (em caso de defeitos menores a reconstruir) ou além dela (defeitos extensos ou necessidade de compensação de "orelhas").
A técnica cirúrgica consistiu em posicionar a paciente em decúbito lateral oposto à área doadora e com membro superior abduzido. As incisões foram até o plano muscular em que toda a extensão do grande dorsal é dissecada desde a crista ilíaca até a sua inserção no úmero, que pode ser liberada na intenção de acrescentar amplitude em seu arco de rotação. A esqueletização do pedículo toracodorsal não é desejável, mas pode ser necessária também para incrementar o arco de rotação. A área doadora foi fechada primariamente com sutura por planos, pontos de adesão e submetida a drenagem a vácuo. Após a transposição, o retalho foi fixado à musculatura peitoral. Procedeu-se ao fechamento por planos.
Retalho toracoabdominal
A marcação foi realizada com paciente em posição ortostática. A incisão deve ser marcada a partir do ângulo lateral inferior do defeito torácico e segue inferiormente em curva pela linha média axilar. A paciente foi posicionada em decúbito dorsal horizontal na mesa cirúrgica e a dissecção progrediu a partir da incisão em direção medial e inferior em plano subfascial, preservando as perfurantes da epigástrica superior. O retalho foi então avançado superiormente em direção ao defeito. Drenagem a vácuo foi feita em todas as pacientes e o retalho foi suturado por planos.
RESULTADOS
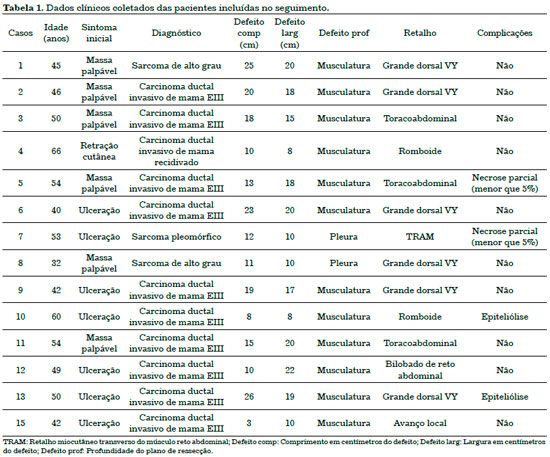
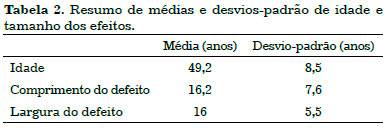
A casuística deste estudo incluiu 15 pacientes do sexo feminino com idade entre 66 e 32 anos (idade média de 49,2 anos).
As queixas pré-operatória eram massas palpáveis em 46,7%, massas palpáveis e ulceradas em 46,7% dos casos e retração cutânea 6,6%. Todos os tumores foram unilaterais.
Os sujeitos foram submetidos à cirurgia para ressecção de tumores malignos do tórax, sendo duas delas pela cirurgia torácica por tratarem-se de casos em que a invasão de parede torácica em seus componentes ósseos era evidente na avaliação clínica pré-operatória. As demais foram submetidas à ressecção oncológica pela equipe de Mastologia.
Todas as pacientes foram submetidas à avaliação pré-operatória pela equipe multidisciplinar e foi realizado planejamento cirúrgico englobando opções primárias e secundárias de reconstrução, mantendo-se o princípio de realizar-se a reconstrução mais simples possível, poupando-se opções mais rebuscadas para possíveis situações de recidiva.
A maioria das pacientes (80%) apresentavam carcinoma ductal invasivo da mama em estádio III, indicando um tumor localmente avançado e/ou com acometimento linfonodal. Duas dessas pacientes apresentavam lesões recidivadas. As demais pacientes (20%) apresentavam sarcomas de partes moles do tórax, sendo em sua totalidade sarcomas de alto grau na análise histológica.
Os atos cirúrgicos ocorreram sob anestesia geral e não houve intercorrências intraoperatórias. A maioria das ressecções (86,7%) forneceram leito com plano muscular íntegro ou parcialmente preservado. Apenas duas pacientes (13,3%) tiveram necessidade de ressecar musculatura da parede torácica em toda sua espessura e elementos ósseos do gradil costal. Essas últimas tiveram reconstrução em conjunto com a equipe da cirurgia torácica com uso de tela de polipropileno e uma delas necessitou de barras metálicas.
A extensão das áreas cruentas deixadas pelas ressecções teve uma área média de 259,2 cm2. O comprimento variou de 30-3 cm (média de 16,2 cm) e a largura variou de 25-8 cm (média de 16 cm).
Dentre as opções de reconstrução, os retalhos locais (fasciocutâneo toracoabdominal, romboide e cutâneo de avanço) foram utilizados em 6 pacientes (40%). Dentre os retalhos musculares, à distância, utilizados em 60% dos casos, foram eleitos o grande dorsal com ilha de pele em V-Y (46,7%), o retalho miocutâneo transverso do músculo reto abdominal (TRAM). (6,7%) e o retalho vertical miocutâneo do reto abdominal com ilha de pele bilobada (6,7%).
As pacientes receberam antibioticoterapia intravenosa no intraoperatório e por sete dias no pós-operatório. Foram submetidas à drenagem de sucção em área doadora e receptora em todos os retalhos, exceto os romboides e de avanço local.
Ao longo do seguimento pós-operatório, duas pacientes (13,3%) apresentaram epiteliólise no pós-operatório precoce, com cicatrização por segunda intenção e excelente resultado tardio. Duas pacientes (13,3%) apresentaram necrose parcial (menor que 5%) e receberam debridamento químico com pomada e seguimento para cicatrização por segunda intenção, com ótimos resultados após 2 meses de seguimento.
A totalidade das pacientes seguidas neste estudo recebeu tratamento adjuvante com quimioterapia e/ou radioterapia e uma delas (6,7%) apresentou óbito antes do fim do seguimento de 6 meses. Todas as pacientes finalizaram o seguimento com sucesso da reconstrução torácica.
Na Tabela 1 estão demonstrados os dados apresentados acima, que caracterizam a amostra e as estratégias reconstrutoras. Na Tabela 2, há um resumo de médias e desvios-padrão das variáveis numéricas.
Nas Figuras 1, 2, 3, 4 e 5 são demonstradas as distribuições percentuais de sintomas, diagnóstico, plano profundo dos defeitos, retalhos escolhidos e complicações.
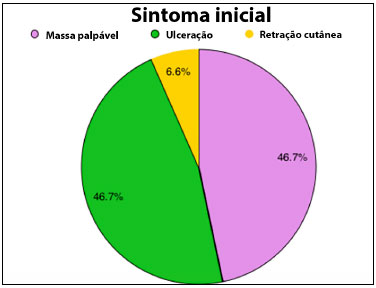
Figura 1. Gráfico de setor circular demonstrando distribuição percentual do sintoma inicial principal apresentado pelas pacientes na avaliação multidisciplinar para tratamento das neoplasias.
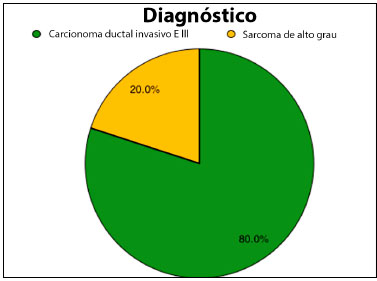
Figura 2. Gráfico de setor circular demonstrando distribuição percentual de diagnóstico anatomopatológico das lesões neoplásicas. EIII: estádio III.
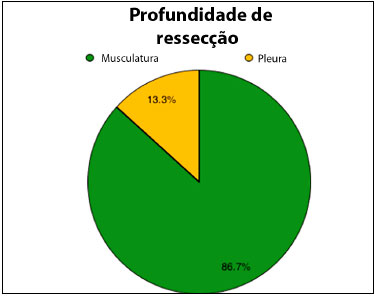
Figura 3. Gráfico de setor circular demonstrando distribuição percentual de profundidade de ressecção das lesões neoplásicas.
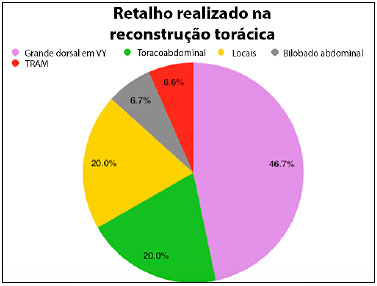
Figura 4. Gráfico de setor circular demonstrando distribuição percentual dos retalhos realizados para reconstrução de parede torácica nas pacientes estudadas. TRAM (retalho miocutâneo transverso do músculo reto abdominal).
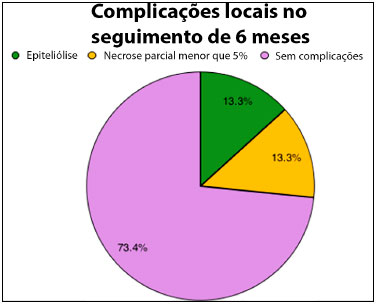
Figura 5. Gráfico de setor circular demonstrando distribuição percentual das complicações locais detectadas no seguimento de 6 meses das pacientes submetidas a ressecções oncológicas extensas e reconstruções de parede torácica.
Nas Figuras 6 a 14 apresentam-se documentações fotográficas de pacientes do estudo.
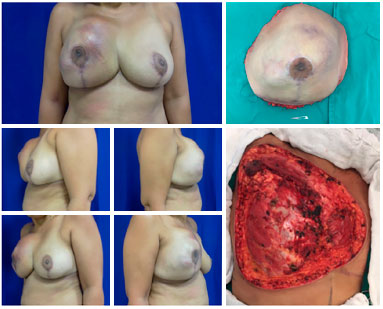
Figura 6. Pré-operatório de paciente portadora de sarcoma de partes moles do tórax recidivado (à esquerda). Peça ressecada no intraoperatório com peso de 2,3 kg (superior direita). Leito de ressecção do tumor medindo 25 x 20 cm (inferior direita).
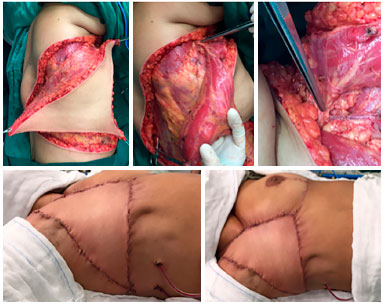
Figura 7. Intraoperatório de paciente portadora de sarcoma de partes moles do tórax recidivado. Confecção de retalho miocutâneo do grande dorsal com ilha de pele em VY e destaque para o pedículo dissecado (linha superior). Aspecto final do retalho já suturado em área receptora (linha inferior direita).
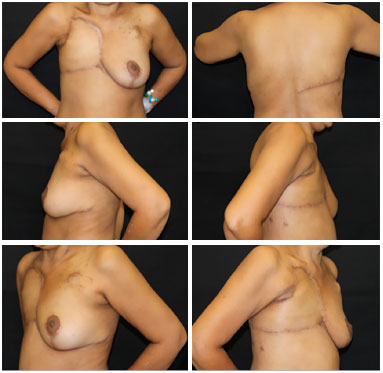
Figura 8. Pós-operatório de 6 meses paciente portadora de sarcoma de partes moles do tórax recidivado com excelente resultado do retalho miocutâneo de grande dorsal em VY, sem complicações ou sinais de recidiva.
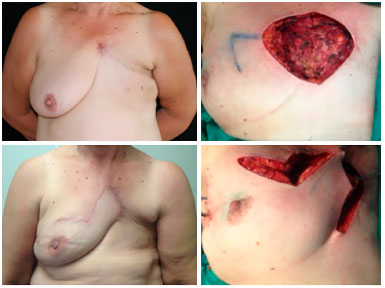
Figura 9. Pré-operatório de paciente portadora de recidiva tumoral de neoplasia mamária em pele do tórax (superior esquerda). Intraoperatório com reconstrução local por meio de retalho romboide - marcação (superior direita) e transposição (inferior direita). Pós-operatório de 6 meses de retalho romboide com ótimo resultado (inferior esquerda), sem complicações ou sinais de recidiva.
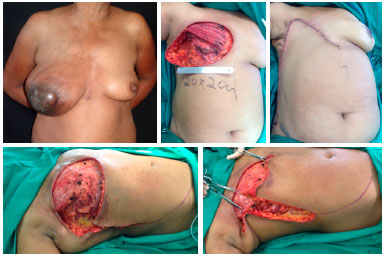
Figura 10. Pré-operatório de paciente portadora de neoplasia mamária localmente avançada (superior esquerda). Intraoperatório com dimensões do leito de ressecção (superior central). Aspecto final da reconstrução com retalho toracoabdominal (superior direita). Intraoperatório com demarcação de incisões (inferior esquerda) e de demonstração do avanço do retalho em direção à área receptora (inferior direita), determinante para a correta extensão da dissecção.
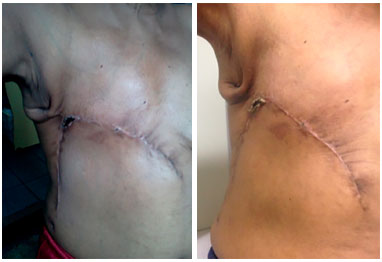
Figura 11. Pós-operatório de 1 mês (esquerda) e 45 dias (direita) de paciente portadora de neoplasia mamária localmente avançada submetida à reconstrução com retalho toracoabdominal, que evoluiu com necrose parcial menor que 5% de área. Boa evolução da área de necrose com delimitação, debridamento químico e cicatrização por segunda intenção.
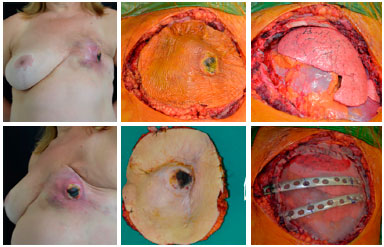
Figura 12. Pré-operatório de paciente portadora de sarcoma torácico de partes moles ulcerado (esquerda). Intraoperatório com delimitação da ressecção (central superior), leito de ressecção (superior direita), aspecto da peça ressecada (central inferior) e reconstrução de arcabouço torácico pela equipe de Cirurgia Torácica.
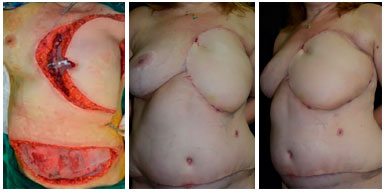
Figura 13. Intraoperatório de paciente portadora de sarcoma torácico de partes moles ulcerado demonstrando posicionamento do retalho miocutâneo transverso de reto abdominal (TRAM) na área receptora. Pós-operatório de 3 meses com bom aspeto do retalho, sem sinais de recidiva ou complicações.
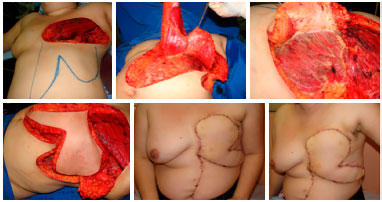
Figura 14. Intraoperatório de paciente portadora de neoplasia mamária localmente avançada demonstrando demarcação de retalho bilobado abdominal (superior esquerda) com componente muscular em seu lobo vertical (central superior) e fasciocutâneo em seu lobo horizontal (superior direita). Intraoperatório ilustrando fim da confecção do retalho bilobado (inferior esquerda). Pós-operatório de 3 meses em vista frontal (central inferior) e oblíqua esquerda (inferior direita) com ótimo aspecto, sem sinais de recidiva ou complicações.
DISCUSSÃO
Até recentemente, uma grande proporção de tumores extensos eram julgados irressecáveis e tumores de mama avançados eram considerados contraindicações para a reconstrução imediata de mama. Os principais motivos para essa conduta eram a preocupação com o controle de margens e o aumento da área de feridas com possibilidade de complicações5. O atraso na cicatrização de feridas pode repercutir negativamente no tempo de início da terapia adjuvante.
Em se tratando dos sarcomas, segundo tumor mais frequente nesta casuística, o tratamento cirúrgico consistindo em ressecção com margens amplas é o fator mais associado ao bom prognóstico de sobrevida longa. A reconstrução de parede torácica em seus componentes ósseos e de tecidos moles, por sua vez, é fator de grande importância para o sucesso global do tratamento12.
O planejamento do tratamento oncológico e reparador da parede torácica em conjunto deve envolver a análise cautelosa da quantidade de tecido mole, elementos ósseos e cartilaginosos ressecados, o tipo de tumor, os materiais autólogos e sintéticos disponíveis, os retalhos de vizinhança e à distância em boas condições de vascularização, a manutenção de aspectos funcionais (como a expansão pulmonar) e o respeito à estética, quando possível11. O cirurgião plástico deve ser o profissional capacitado a realizar planejamento com múltiplas opções reparadoras escalonadas em complexidade (da menor para a maior) e deve estar pronto para adequar suas propostas terapêuticas às condições intraoperatórias, que não raramente, impõem a necessidade de adaptação ou mudança de planos.
A importância da avaliação multidisciplinar pré-operatória incluindo o cirurgião plástico é destacada por vários autores como fundamental para o sucesso de tratamentos complexos envolvendo amplas ressecções e grandes reconstruções3,7,11,13. Para Franco et al.11, a presença do cirurgião plástico, desde a etapa de planejamento até a execução do tratamento, colabora para a preservação de estruturas importantes à reabilitação sem dano aos princípios oncológicos.
No grupo de Chen et al.7, da Universidade de Wisconsin- Estados Unidos da América, foram compilados 91 casos de reconstrução torácica, sendo os tumores malignos a principal causa de ressecções extensas de parede torácica extrapleural. O uso cauteloso, mas liberal de retalhos musculares foi considerado por eles como de máxima importância para o sucesso de tais reconstruções. Assim como no presente estudo, o grande dorsal figurou como o retalho de uso mais frequente, mas foram necessários dois retalhos para reconstruir a maioria dos seus casos.
Marcondes et al.14, assim como neste trabalho, descreveram uma série de casos de pacientes com fechamento de parede torácica com múltiplas estratégias. A casuística foi composta de paciente um pouco mais jovens, com idade média de 44,9 anos, e todas eram portadoras de neoplasia mamária localmente avançada. Foram utilizados 3 retalhos fasciocutâneos, 2 enxertos de pele e 6 retalhos miocutâneos, sendo os de reto abdominal os mais utilizados. Embora as estratégias de reconstrução tenham uma distribuição diferente deste estudo, os resultados também foram descritos como satisfatórios. A escolha do método de reconstrução sofre influências de muitos fatores do intraoperatório, de condições próprias das pacientes e da preferência e experiência do cirurgião.
O retalho miocutâneo do músculo grande dorsal foi o retalho mais utilizado neste estudo, sendo a opção eleita para 7 (46,7%) das pacientes. Apesar de ter sua descrição datada do século 19 por Tansini, o retalho do grande dorsal continua sendo a principal opção de reconstrução em diversas casuísticas por diversos motivos, entre os quais destacam-se: facilidade de dissecção; constância e segurança de seu pedículo vascular; e grande arco de rotação, sendo capaz de alcançar regiões cervical, torácica anterior e dorsal, e de ser ampliado por meio da desinserção umeral em até 5-10 cm.
As desvantagens apontadas para esse retalho são necessidade de decúbito lateral intraoperatório para dissecção, alto índice de seroma em área doadora, deiscência de ferida operatória, cicatriz aparente/hipertrófica em área doadora10. A capacidade funcional geral e específica do membro superior ipsilateral ao retalho de grande dorsal não se alteram após a cirurgia e a qualidade de vida apresenta melhora após o procedimento em populações com tumores não avançados15,16.
Maia et al.17, em 2011, propuseram uma modificação da localização da ilha de pele no retalho miocutâneo de grande dorsal. Com um elegante estudo anatômico associado um relato de caso, demonstram haver vascularização confiável para a confecção de ilha cutânea sobre o terço inferior do músculo, de modo que seu arco de rotação passa a atingir áreas centrais do tórax anterior com facilidade. Em 2006, Woo et al.18 propuseram modificação no desenho do retalho com laterais mais curvilíneas na intenção de aumentar a área de pele a ser incluída.
No entanto, a modificação responsável por maior impacto na indicação do retalho miocutâneo de grande dorsal foi realizada por Micali e Carramaschi19, em 2001. Os autores propuseram a modificação da ilha de pele sobre retalho para a forma triangular com vértice na linha média posterior e base voltada para o defeito com fechamento em V-Y. Essa modificação permitiu recrutar uma extensão de pele muito maior para o retalho de grande dorsal e ampliar o seu alcance de cobertura para áreas superiores da parede torácica, onde o TRAM e o toracoabdominal, outras importantes opções, não alcançam. A ilha de pele em V-Y permitiu o fechamento primário da área doadora e o aumento sensível das dimensões de defeitos que esse retalho poderia reconstruir. Após a sua divulgação, outros autores publicaram sua experiência positiva com o retalho13,20.
Munhoz et al.13 relataram uma série de 25 casos tratados com mastectomia radical e reconstrução com retalho miocutâneo do grande dorsal em V-Y com idade média de 54,8 anos. Assim como no presente estudo, todas as pacientes tiveram sucesso na reconstrução e não sofreram atraso no início da terapia adjuvante. Pequenas complicações ocorreram em ambas as casuísticas, mas nenhuma exigiu aumento do tempo de internação ou reinternações.
Os retalhos fasciocutâneos, como o toracoabdominal, segundo mais utilizado neste estudo, são baseados na vascularização superficial de artérias perfurantes. Há nessa região uma área ricamente vascularizada permitindo a confecção de retalhos longos, espessos, resistentes e seguros. Podem ser usados com pedículo medial ou lateral a depender da necessidade de cobertura do defeito. O toracoabdominal tem base medial e utiliza as perfurantes da artéria espigástrica superior. Tem uma boa indicação quando a necessidade de avanço medial é menor que a lateral21.
Park et al.21 descreveram uma série de 24 casos em que o fechamento de áreas extensas de mastectomia foi feito exclusivamente com retalhos fasciocutâneos toracoabdominal, toracoepigástrico ou de avanço bilateral. Num seguimento de 14 meses, reportaram-se 36% de complicações, sendo a maioria de pequeno porte e com resolução em tratamento conservador. São vantagens conhecidas dos retalhos fasciocutâneos o menor tempo cirúrgico, menor perda sanguínea e menor permanência hospitalar pós-operatória22.
Particularmente nos casos de ressecções extensas, como as descritas no presente trabalho, a manipulação das regiões torácica e axilar é frequente. Dessa forma, verificar a integridade dos pedículos vasculares é fundamental para o sucesso dos retalhos8,13. No presente estudo, todos os retalhos de músculo grande dorsal e TRAM tinham seu pedículo principal íntegro. Os demais retalhos não tiveram pedículos dissecados.
À semelhança da integração dos princípios da Cirurgia Plástica no planejamento das ressecções tumorais do câncer de mama, tornando a programação da extirpação e da reconstrução de mama partes de um processo integrado, grandes centros têm iniciado a abordagem toracoplástica para os tumores com extensão para a parede torácica. Dessa forma, o cirurgião plástico da equipe faz a marcação de incisões e a dissecção inicial de planos musculares de modo a preservar estruturas importantes para a cirurgia reparadora sem comprometer o resultado oncológico.
Numa série de casos da Universidade da Philadelphia, com 45 pacientes, sendo 14 tratadas com abordagem toracoplástica, não foram evidenciadas diferenças no que diz respeito a complicações, recidiva tumoral ou sucesso da reconstrução em relação aos que receberam abordagem habitual pela equipe de cirurgia torácica. Assim como no presente estudo, essa série de casos foi composta por pacientes com tumores primários da parede torácica ou de mama, o retalho de grande dorsal foi o mais utilizado e o índice de complicações foi baixo. Apenas pacientes com perda de arcabouço ósseo tiveram complicações sistêmicas. A participação do cirurgião plástico foi considerada importante fator para o sucesso do tratamento8.
CONCLUSÃO
Na presente casuística, as pacientes portadoras de doença neoplásica extensa do tórax representam um desafio para reconstrução após as extensas ressecções a que são submetidas.
A participação de uma equipe de cirurgia plástica mostrou-se benéfica para o sucesso de tais procedimentos e baixo nível de complicações na casuística descrita.
O planejamento pré-operatório com múltiplas opções estratificadas em complexidade auxilia as decisões intraoperatórias e contribui para menor morbidade nos casos relatados.
COLABORAÇÕES
MMAS Compilação de documentação fotográfica; revisão de Literatura; aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
MSN Aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos.
ATL Aprovação final do manuscrito; compilação de documentação fotográfica; realização das operações e/ou experimentos.
PAPG Aprovação final do manuscrito; realização das operações e/ou experimentos.
LMF Aprovação final do manuscrito; concepção e desenho do estudo.
REFERÊNCIAS
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin. 2016;66(1):7-30. DOI: http://dx.doi.org/10.3322/caac.21332
2. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva - INCA. Estimativa 2016: Síntese de resultados e comentários. [acesso 2016 Out 11]. Disponível em: http://www.inca.gov.br/estimativa/2016/sintese-de-resultados-comentarios.asp
3. D'Aiuto M, Cicalese M, D'Aiuto G, Rocco G. Surgery of the chest wall for involvement by breast cancer. Thorac Surg Clin. 2010;20(4):509-17. DOI: http://dx.doi.org/10.1016/j.thorsurg.2010.09.001
4. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva - INCA. Condutas do INCA/MS 2001. Câncer de Mama. [acesso 2016 Out 11]. Disponível em: http://www.inca.gov.br/rbc/n_47/v01/pdf/normas.pdf
5. Lee MC, Newman LA. Management of patients with locally advanced breast cancer. Surg Clin North Am. 2007;87(2):379-98. DOI: http://dx.doi.org/10.1016/j.suc.2007.01.012
6. Drake DB, Oishi SN. Wound healing considerations in chemotherapy and radiation therapy. Clin Plast Surg. 1995;22(1):31-7.
7. Chen JT, Bonneau LA, Weigel TL, Maloney JD, Castro F, Shulzhenko N, et al. A Twelve-Year Consecutive Case Experience in Thoracic Reconstruction. Plast Reconstr Surg Glob Open. 2016;4(3):e638. DOI: http://dx.doi.org/10.1097/GOX.0000000000000603
8. Basta MN, Fischer JP, Lotano VE, Kovach SJ. The thoracoplastic approach to chest wall reconstruction: preliminary results of a multidisciplinary approach to minimize morbidity. Plast Reconstr Surg. 2014;134(6):959e-67e. PMID: 25415119 DOI: http://dx.doi.org/10.1097/pRS.0000000000000734
9. Larson DL, McMurtrey MJ. Musculocutaneous flap reconstruction of chest-wall defects: an experience with 50 patients. Plast Reconstr Surg. 1984;73(5):734-40. PMID: 6718572 DOI: http://dx.doi.org/10.1097/00006534-198405000-00003
10. Skoracki RJ, Chang DW. Reconstruction of the chestwall and thorax. J Surg Oncol. 2006;94(6):455-65. PMID: 17061266 DOI: http://dx.doi.org/10.1002/jso.20482
11. Franco D, Tavares Filho JM, Cardoso P, Moreto Filho L, Reis MC, Boasquevisque CH, et al. Plastic surgery in chest wall reconstruction: relevant aspects - case series. Rev Col Bras Cir. 2015;42(6):366-70. DOI: http://dx.doi.org/10.1590/0100-69912015006003
12. Foroulis CN, Kleontas AD, Tagarakis G, Nana C, Alexiou I, Grosomanidis V, et al. Massive chest wall resection and reconstruction for malignant disease. Onco Targets Ther. 2016;9:2349-58.
13. Munhoz AM, Montag E, Arruda E, Okada A, Brasil JA, Gemperli R, et al. Immediate locally advanced breast cancer and chest wall reconstruction: surgical planning and reconstruction strategies with extended V-Y latissimus dorsi myocutaneous flap. Plast Reconstr Surg. 2011;127(6):2186-97. PMID: 21617452 DOI: http://dx.doi.org/10.1097/pRS.0b013e318213a038
14. Marcondes CA, Pessoa SGP, Pessoa BBGP, Dias IS, Ribeiro NP. Estratégias em reconstruções de tórax pós-ressecções extensas de tumores de mama localmente avançados: uma série de 11 casos. Rev Bras Cir Plást. 2015;30(3):339-44.
15. Guerreiro V, Sabino Neto M, Dutra AK, Ferreira LM. Capacidade funcional de pacientes submetidas a reconstrução mamária com retalho musculocutâneo de latíssimo do dorso. Rev Bras Cir Plást. 2013;28(3):367-74.
16. Dutra AK, Neto MS, Garcia EB, Veiga DF, Netto MM, Curado JH, et al. Patients' satisfaction with immediate breast reconstruction with a latissimus dorsi musculocutaneous flap. J Plast Surg Hand Surg. 2012;46(5):349-53. DOI: http://dx.doi.org/10.3109/2000656X.2012.704726
17. Maia M, Oni G, Wong C, Saint-Cyr M. Anterior chest wall reconstruction with a low skin paddle pedicled latissimus dorsi flap: a novel flap design. Plast Reconstr Surg. 2011;127(3):1206-11. PMID: 21088645 DOI: http://dx.doi.org/10.1097/pRS.0b013e318205f2f7
18. Woo E, Tan BK, Koong HN, Yeo A, Chan MY, Song C. Use of the extended V-Y latissimus dorsi myocutaneous flap for chest wall reconstruction in locally advanced breast cancer. Ann Thorac Surg. 2006;82(2):752-5. PMID: 16863813 DOI: http://dx.doi.org/10.1016/j.athoracsur.2005.07.030
19. Micali E, Carramaschi FR. Extended V-Y latissimus dorsi musculocutaneous flap for anterior chest wall reconstruction. Plast Reconstr Surg. 2001;107(6):1382-90. DOI: http://dx.doi.org/10.1097/00006534-200105000-00010
20. Luz DP, Lobo CAH, Hiraki P, Okada A, Montag E, Ferreira MC. Retalho miocutâneo de latíssimo do dorso em V-Y para reconstrução de grandes defeitos torácicos extensos. Rev Bras Cir Plast. 2010;25(3 Suppl.1):64.
21. Park JS, Ahn SH, Son BH, Kim EK. Using local flaps in a chest wall reconstruction after mastectomy for locally advanced breast cancer. Arch Plast Surg. 2015;42(3):288-94. DOI: http://dx.doi.org/10.5999/aps.2015.42.3.288
22. Persichetti P, Tenna S, Cagli B, Scuderi N. Extended cutaneous 'thoracoabdominal' flap for large chest wall reconstruction. Ann Plast Surg. 2006;57(2):177-83. DOI: http://dx.doi.org/10.1097/01.sap.0000215253.54577.28
1. Sociedade Brasileira de Cirurgia Plástica, São Paulo, SP, Brasil
2. Universidade Federal de São Paulo, São Paulo, SP, Brasil
Instituição: Universidade Federal de São Paulo, São Paulo, SP, Brasil.
Autor correspondente:
Mayara Mytzi de Aquino Silva
Rua Napoleão de Barros, 740 - 2º andar - Vila Clementino
São Paulo, SP, Brasil - CEP 04023-062
E-mail: mmytzi@yahoo.com.br
Artigo submetido: 12/10/2016.
Artigo aceito: 10/7/2017.
Conflitos de interesse: não há.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter