

Original Article - Year 2018 - Volume 33 -
Reconstrução mamária em decúbito único lateral com retalho miocutâneo do músculo grande dorsal e implante de silicone: sistematização e série de casos
Breast reconstruction with latissimus dorsi myocutaneous flap and silicone implant in the single lateral decubitus position: systematization and case series
RESUMO
Introdução: O câncer de mama é afecção de grande relevância para a saúde pública, sendo
que seu tratamento cirúrgico e a reconstrução mamária evoluíram bastante ao
longo do tempo. A utilização do retalho miocutâneo do grande dorsal (RMGD)
com implante mamário de silicone apresenta-se como um verdadeiro cavalo de
batalha ao cirurgião plástico em função de sua confiabilidade anatômica e
segurança. Realizar esta cirurgia em decúbito único lateral torna o
procedimento mais breve e mantém os resultados da técnica convencional. O
objetivo do estudo é apresentar a sistematização desta cirurgia em uma série
de casos.
Método: Estudo retrospectivo realizado por análise de prontuários e documentação
fotográfica de 29 pacientes operadas pelo autor e submetidas à reconstrução
mamária com RMGD e implante de silicone em decúbito único lateral.
Resultados: Houve um caso de extrusão do implante de silicone por seroma e infecção no
sítio receptor (3,5%). Uma paciente cursou com seroma no dorso (3,5%). Um
caso de necrose parcial da ilha de pele do retalho (3,5%) e dois casos de
sofrimento do envelope cutâneo da mastectomia (7,0%). Uma paciente
necessitou retirada do implante de silicone por extensa recidiva local
(3,5%). Um caso de contratura capsular Baker III após radioterapia adjuvante
(3,5%). Quatro pacientes tiveram suas cicatrizes revisadas (14%). Três
pacientes tiveram limitação de movimentos (10,5%). Os resultados
mostraram-se compatíveis com os apresentados para a técnica convencional na
literatura vigente.
Conclusão: A sistematização desta técnica dispensa mudança de decúbito e torna o
procedimento mais breve, mantendo sua segurança e confiabilidade.
Palavras-chave: Neoplasias da mama; Mastectomia; Implante mamário; Mama
ABSTRACT
Introduction: Breast cancer is an important public health
condition, and its surgical treatment and the subsequent breast
reconstruction has evolved significantly over time. The use of the
latissimus dorsi myocutaneous flap (LDMF) with silicone breast
implants is a mainstay of plastic surgeons due to the anatomical
reliability and safety. Performing this surgery in the single lateral
decubitus position makes the procedure shorter and maintains the
results of the conventional technique. The objective of this study
was to present a systematization of this surgery from a series of
cases.
Method: Retrospective study using medical records and
photographic documentation of 29 patients operated on by the
author and submitted to breast reconstruction with a LDMF
and silicone implant in a lateral decubitus position.
Results: Silicone implant extrusion due to seroma and infection at the
receptor site was noted in one patient (3.5%). One patient had
a seroma on the back (3.5%); there was one patient with partial
necrosis of the skin island of the flap (3.5%), and two patients with
mastectomy skin envelope (7.0%). One patient required removal
of the silicone implant due to extensive local recurrence (3.5%)
while another patient showed Baker III capsular contracture
after adjuvant radiotherapy (3.5%). Four patients had scar
review (14%), and three patients showed limitation of movement
(10.5%). The results were comparable to those reported for the
conventional technique.
Conclusion: The systematization of this
technique requires no change of the decubitus position and makes
the procedure shorter, while maintaining safety and reliability.
Keywords: Breast cancer; Mastectomy; Breast Implant; Breast
INTRODUÇÃO
O câncer de mama é afecção de grande relevância para a saúde pública. Configura-se como o câncer de maior prevalência no sexo feminino, desde que excluídos os cânceres de pele do tipo não melanoma, além de representar a segunda causa de morte por câncer em mulheres, estando atrás apenas do câncer de pulmão.
De acordo com a American Cancer Society, para o ano de 2017, eram estimados 316.120 casos novos de câncer de mama nos Estados Unidos1. No Brasil, de acordo com dados do Instituto Nacional do Câncer, foram estimados 57.960 novos casos no ano de 20162.
A taxa de mortalidade tem se mostrado estável em mulheres com menos de 50 anos, todavia, vem caindo naquelas com mais idade; acredita-se que em função do maior acesso à informação por parte da população, do diagnóstico mais precoce e da melhoria nas modalidades de tratamento3.
A cirurgia de mastectomia é parte fundamental do tratamento e restaurar a mama por meio de cirurgia plástica ajuda as mulheres acometidas a preservarem melhor sua autoestima, além de ser um direito garantido por lei no Brasil desde 19994. A reconstrução mamária não atrapalha as etapas sequenciais do tratamento e não compromete a detecção de recidivas locais5. Diversas técnicas de reconstrução mamária estão descritas na literatura, todavia, uma avaliação individualizada irá definir a técnica melhor indicada para cada paciente.
A utilização do retalho miocutâneo do músculo grande dorsal (RMGD) para a cobertura de defeitos causados pela mastectomia foi inicialmente descrita por Tansini, no ano de 1906. Entretanto, apenas em 1978, com Bostwick, é que se utilizou este retalho com a finalidade de se reconstruir a mama6.
Desde então, esta técnica vem sendo utilizada como um verdadeiro cavalo de batalha na cirurgia plástica. A utilização do implante mamário de silicone ajudou a restaurar o volume da neomama, uma vez que o retalho em si costuma não prover partes moles suficientes para recriar o monte mamário. Como o músculo grande dorsal situa-se na porção posterior do tronco, sua utilização para reconstrução mamária pode demandar mudança de decúbito durante o procedimento, o que aumenta o tempo cirúrgico com suas implicações.
A realização desta cirurgia em decúbito lateral tem a vantagem de dispensar a mudança de decúbito, tornando o procedimento mais breve, porém exige familiarização anatômica por parte do cirurgião, não só com relação às estruturas a serem dissecadas, como também com relação à posição em que o retalho será suturado ao sítio receptor e à adequação para melhor customização do envelope cutâneo mamário remanescente.
A sistematização deste procedimento em decúbito lateral envolve elementos que vão desde o posicionamento da paciente na mesa de cirurgia até a descrição dos detalhes de dissecção e customização da ilha e do envelope cutâneos, configurando uma sequência pré- determinada que, juntamente à falta de necessidade de mudança de decúbito, tornam o ato cirúrgico mais breve e sem prejuízos ao resultado final.
OBJETIVO
O objetivo do estudo é apresentar tal sistematização com a exposição de uma série de casos.
MÉTODO
Trata-se de estudo primário retrospectivo realizado por meio de análise de prontuários e documentação fotográfica de pacientes submetidas à reconstrução mamária com utilização do retalho miocutâneo do músculo grande dorsal com implante de silicone em decúbito lateral entre outubro de 2015 e abril de 2017, operadas pelo autor, em clínica privada e dois serviços públicos nos quais atua como cirurgião plástico (Hospital Napoleão Laureano-PB e Hospital das Clínicas-PE). Os princípios da Declaração de Helsinki, revisada em 2000, e da Resolução 196/96 do Conselho Nacional de Saúde foram devidamente seguidos.
Critérios de inclusão
Pacientes mastectomizadas por câncer de mama submetidas à reconstrução mamária imediata ou tardia através da utilização do retalho miocutâneo do músculo grande dorsal com implante de silicone em decúbito único lateral entre outubro de 2015 e abril de 2017, operadas pelo autor.
Critérios de exclusão
Pacientes tabagistas, com Índice de Massa Corporal maior ou igual a 30kg/m2 e/ou que perderam o seguimento mínimo de três meses de pós-operatório.
Sistematização cirúrgica
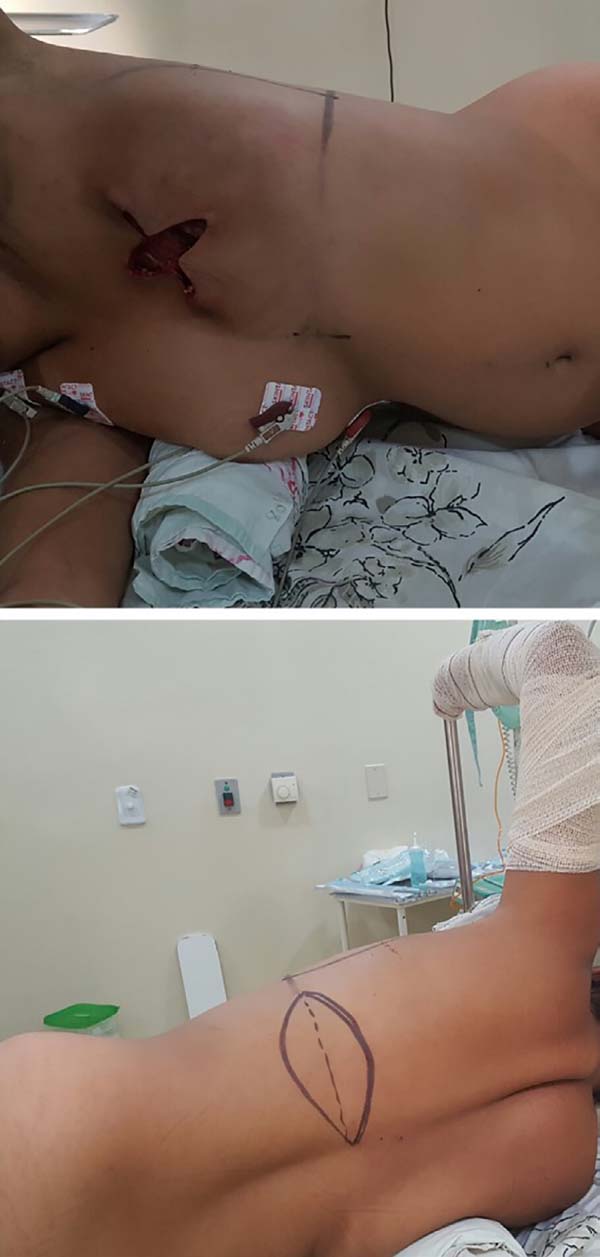
A paciente deve ser posicionada em decúbito lateral, com o membro ipsilateral abduzido a 90 graus e fixado a um arco revestido por tecido através de atadura. Um pequeno coxim deve ficar abaixo do tórax, bem como entre os joelhos e apoiando a cabeça. O quadril deve ficar estabilizado à mesa cirúrgica come esparadrapo largo ou faixa apropriada para cirurgias em decúbito lateral. Mantas térmicas e perneiras de compressão pneumática gradual são recomendadas. A ilha de pele no dorso é marcada transversalmente, com seu eixo seguindo a projeção do sulco inframamário correspondente, o que garante que a cicatriz final fique escondida na alça posterior do sutiã (Figura 1).
Outras orientações da ilha de pele podem ser projetadas a depender da localização do defeito no tórax anterior. As dimensões costumam medir 17x7 centímetros. Caso a reconstrução seja tardia, inicia-se a cirurgia com a retirada da cicatriz prévia de mastectomia e dissecção do sítio receptor em nível junto à fáscia do músculo peitoral maior, inferiormente até a projeção do sulco inframamário prévio, superiormente até cerca de 3cm da clavícula, medialmente até 1,5cm da borda esternal e lateralmente até a projeção da linha axilar média.
Nos casos de reconstrução imediata a cirurgia inicia-se com a incisão da ilha de pele, preservando um pouco da fáscia de Scarpa superiormente e inferiormente a ela, passando então a dissecção ao plano rente ao músculo grande dorsal. Medialmente, a dissecção deve estender-se até a palpação dos processos transversos vertebrais, lateralmente até um pouco além do limite entre os músculos grande dorsal e serrátil anterior, inferiormente até a identificação da expansão aponeurótica do músculo grande dorsal junto à crista ilíaca.
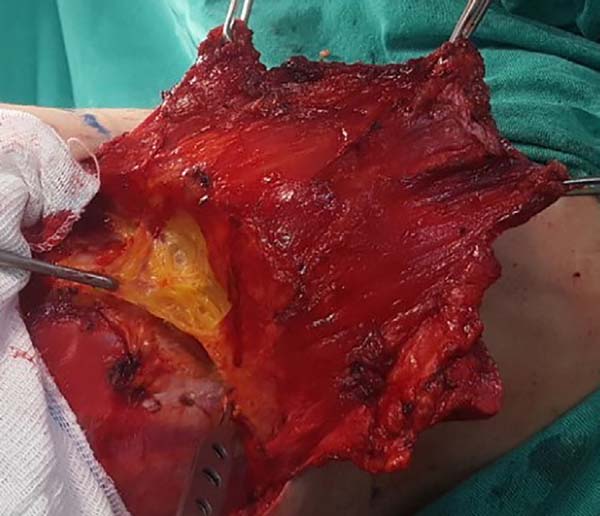
A dissecção superior é realizada mais adiante. Com o auxílio de uma pinça de Nelson e do bisturi elétrico, é possível liberar toda a inserção lateral do músculo grande dorsal nos limites já dissecados, prosseguindo-se para a liberação no limite inferior e, ao se erguer o músculo liberado, torna-se fácil incisar sua origem junto à coluna vertebral. Neste momento o músculo mostra-se plano, largo e com sua espessura mediana característica.
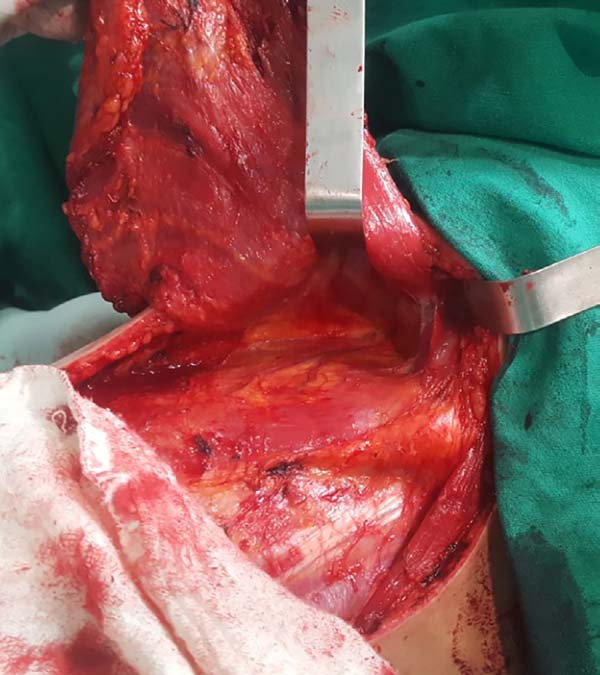
Ao ascender com a dissecção é importante identificar e preservar no sítio doador estruturas que não são necessárias à reconstrução, a exemplo da fáscia gordurosa subjacente ao músculo grande dorsal e a porção do músculo trapézio que se sobrepõe medialmente (Figura 2). Preservadas estas estruturas, a dissecção sobre o músculo grande dorsal deve ser complementada até próximo de sua inserção no úmero, sendo a liberação da mesma opcional, havendo risco de torção do pedículo em determinados casos; sua vantagem, todavia, é diminuir o volume final de tecidos na região axilar.
Neste momento o músculo já deve estar completamente liberado em suas porções inferior e medial, restando complementar a liberação lateral, que deve ser cuidadosa junto à região axilar, uma vez que o pedículo com os vasos toracodorsais encontra-se nesta região. O detalhe anatômico é que esta liberação deve ocorrer por sobre o músculo, uma vez que o pedículo penetra o mesmo através de sua superfície profunda, sendo que a dissecção neste plano profundo poderá se estender até um pouco além do achado anatômico vascular denominado “pata de ganso”, que contém ramos destinados ao músculo serrátil anterior e denota proximidade ao pedículo toracodorsal (Figura 3).
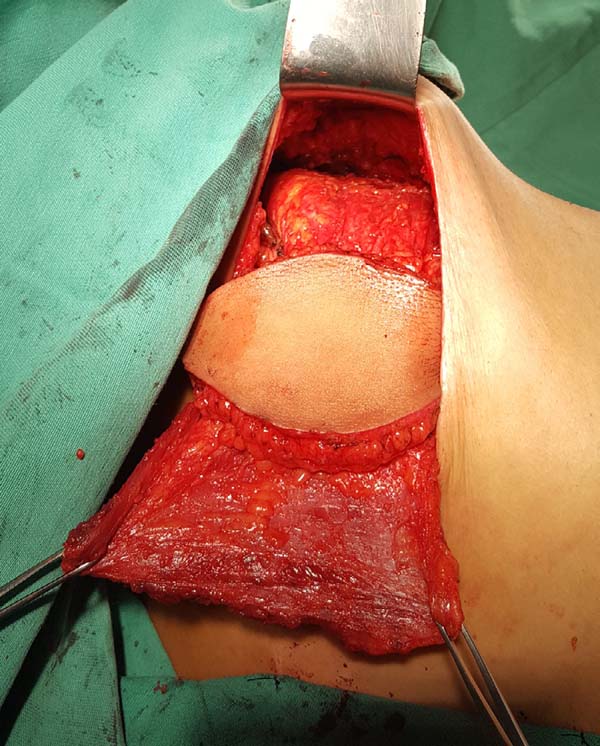
Estando o músculo dissecado, deve-se confeccionar um túnel através da fáscia axilar de cerca de 6cm de largura, aproximadamente na altura da linha de implantação dos pelos axilares (Figura 4). Com cuidado para não torcer o músculo, o mesmo é rotacionado para o sítio receptor através de tração anterior com uma pinça Allis (Figura 5).
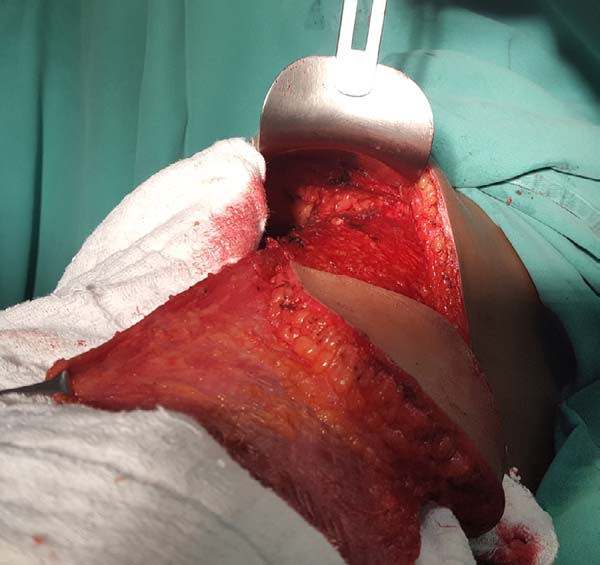
Neste momento pode-se proceder à síntese do sítio doador através da associação de pontos de adesão com vicryl 2.0 e drenagem aspirativa com drenos de calibre 4.8. Confecciona-se a bolsa para o implante mamário fixando-se o músculo aos limites dissecados com uso de nylon 2.0.
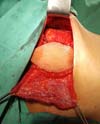
O implante é banhado em solução antibiótica de cefazolina 1 grama e gentamicina 80 miligramas e então posicionado na bolsa, concluindo-se a sutura da mesma. A ilha de pele e o envelope cutâneo mamário remanescente devem ser customizados para que a neomama tenha uma leve ptose, o que confere maior naturalidade ao resultado (Figura 6). O sítio receptor também deve ser drenado, neste caso com dreno aspirativo de calibre 6.4. Os drenos são removidos no pós-operatório ao atingirem débito diário inferior a 40 mililitros.
RESULTADOS
Foram operadas 29 pacientes no período do estudo, com acompanhamento pós-operatório mínimo de três meses. A média de idade foi de 47,22 anos, sendo a mais jovem paciente de 28 anos e a mais idosa de 76 anos (Tabela 1).
| Variável | Maior valor | Menor valor | Média |
|---|---|---|---|
| Idade | 76 anos | 28 anos | 47,22 anos |
| Implante mamário | 390 cc | 280 cc | 318 cc |
Não houve pacientes que se submeteram a quimioterapia neoadjuvante. Com relação às comorbidades encontradas houve 3 casos de hipertensão arterial sistêmica e 1 caso de fibromialgia (Tabela 2).
| Variável | Número absoluto | Indice relativo |
|---|---|---|
| Hipertensão arterial | 3 | 10,5% |
| Fibromialgia | 1 | 3,556 |
O momento da cirurgia reconstrutora foi decidido em conjunto com a equipe de mastologistas, sendo 26 reconstruções imediatas e 3 reconstruções tardias. Não houve reconstruções bilaterais. Os implantes mamários utilizados foram de formato redondo em 28 casos e anatômico em 1. Os volumes variaram de 260cc a 390cc, com média de 318cc. O tempo médio de cirurgia foi de 1h45m (Tabela 1).
O período de internação hospitalar foi uniforme, com alta no segundo dia de pós-operatório. Os drenos foram retirados quando o débito diário ficou abaixo de 40 mililitros, com média de 10 dias de pós-operatório, todavia, não ultrapassando 14 dias.
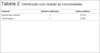
Com relação às complicações, houve um caso de seroma no sítio receptor (3,5%), que cursou também com infecção local sem sucesso à antibioticoterapia, resultando em extrusão do implante mamário.
Uma paciente (3,5%) teve necrose parcial da ilha de pele do retalho e celulite local, com resolução após desbridamento, antibioticoterapia e curativos. A causa da necrose pode ser atribuída ao pequeno segmento cutâneo descolado do músculo para melhor se adaptar ao defeito no sítio receptor. Duas pacientes (7,0%) tiveram sofrimento do envelope cutâneo remanescente da mama, sem maiores repercussões clínicas. Nestes três casos as medidas conservadoras foram suficientes, uma vez que o implante mamário, nesta técnica, fica completamente coberto pelo músculo grande dorsal, fornecendo proteção em casos de necrose cutânea e evitando contaminação externa.
Uma paciente (3,5%) teve extensa recidiva local e seu implante foi retirado por solicitação da equipe de radioterapia em função de protocolo terapêutico de resgate. Uma paciente (3,5%) submetida à radioterapia adjuvante cursou com contratura capsular do tipo Baker III após 18 meses da reconstrução mamária.
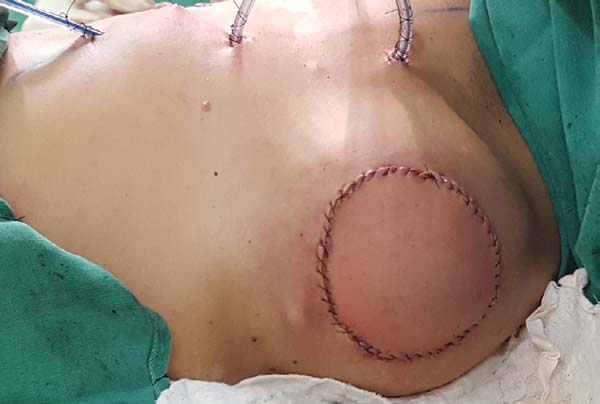
Quatro pacientes (14%) foram submetidas a revisões de suas cicatrizes.
Ao exame clínico, uma paciente (3,5%) cursou com seroma no dorso, tendo se resolvido com punções aspirativas. Exames de imagem não foram solicitados rotineiramente para avaliar esta condição.
Três pacientes (10,5%) ficaram com limitação funcional à abdução na articulação do ombro ipsilateral, sendo uma delas diagnosticada com escápula alada; as mesmas foram encaminhadas para acompanhamento com fisioterapeuta (Tabela 3).
| Variável | Número absoluto | Indice relativo |
|---|---|---|
| Infecção | 2 | 7,0% |
| Necrose cutânea | 3 | 10,5% |
| Extrusão do implante | 1 | 3,5% |
| Remoção do implante | 1 | 3,5% |
| Seroma no sitio receptor | 1 | 3,5% |
| Seroma no sitio doador | 1 | 3,5% |
| Contratura capsular | 1 | 3,5% |
| Revisão de cicatriz | 4 | 14% |
| Déficit articular funcional | 3 | 10,5% |
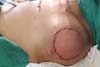
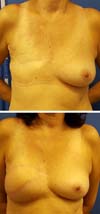
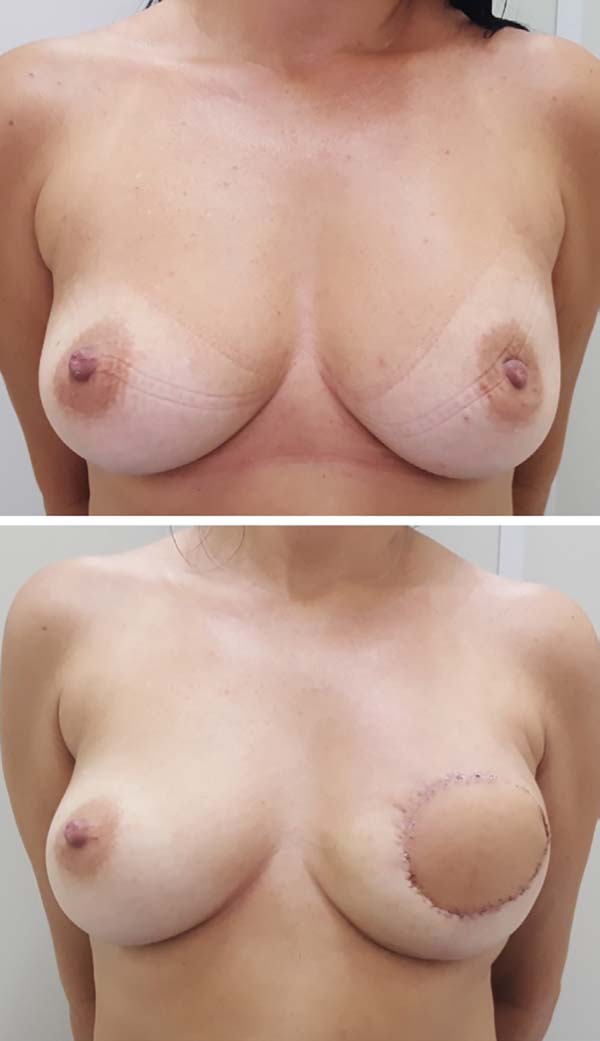
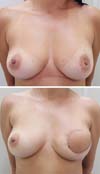
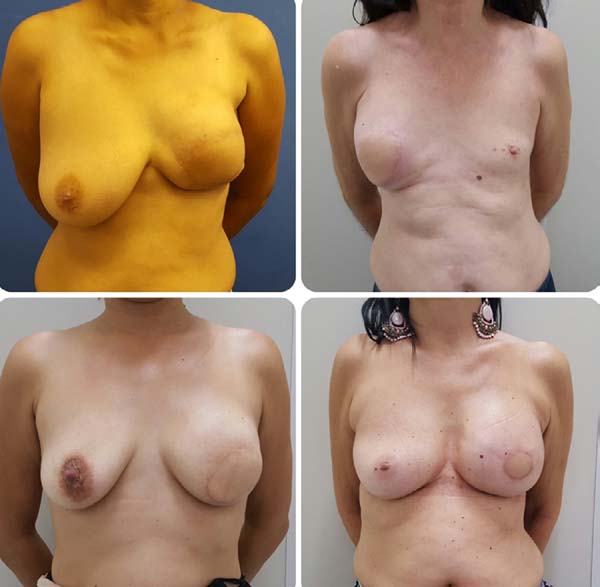
Resultados pós-operatórios podem ser vistos nas Figuras de 7 a 9.
DISCUSSÃO
O tratamento cirúrgico do câncer de mama evoluiu ao longo do tempo. Em 1894, Halsted descreveu o primeiro tratamento eficaz para o câncer de mama com a mastectomia radical clássica. No ano de 1948, Patey, por meio de estudos comparativos, notou que a preservação do músculo peitoral maior não comprometia o controle local do tumor, surgindo então o termo mastectomia radical modificada.
À medida que o tratamento sistêmico adjuvante ganhou importância, houve a possibilidade de cirurgias conservadoras da mama, preservando linfonodos e até mesmo segmentos do parênquima mamário6. Assim também ocorreu com a reconstrução mamária. Apesar de descrito em 1906, por Tansini, apenas na década de 1970 que cirurgiões como Schneider e Bostwick descreveram o retalho miocutâneo do músculo grande dorsal com a finalidade de reconstruir a mama.
Neste meio tempo o retalho foi utilizado para a cobertura de defeitos na parede torácica, seja para cobrir defeitos da extirpação cirúrgica da mama, seja para tratar sequelas causadas pela radioterapia. O advento dos implantes mamários entre as décadas de 60 e 70 ajudou a recuperar o volume mamário perdido quando associado ao RMGD. Técnicas que se valem exclusivamente de tecidos autólogos, a exemplo do uso do retalho transverso do músculo reto abdominal (TRAM) e retalhos microcirúrgicos, bem como outras que usam apenas o material aloplástico posicionado por baixo dos músculos da região torácica anterior, foram descritas por cirurgiões que visavam alternativas que pudessem se adaptar a cada caso.
O RMGD não só resistiu ao longo do tempo, como também ganhou popularidade e é utilizado como um verdadeiro cavalo de batalha por um grande número de cirurgiões plásticos. A anatomia tem poucas variações descritas, com pedículo de calibre confiável e largura muscular ampla, que permite total cobertura de implantes mamários, mesmo que volumosos. Além disso, a morbidade na área doadora é pequena, como déficit funcional na articulação do ombro, seromas ou dor persistente no dorso.
A aplicabilidade do RMGD é vasta; situações como cobertura fina de partes moles na região da mama, parede torácica anterior irradiada, ressecção prévia do peitoral maior, mama contralateral ptótica ou de tamanho pequeno a moderado, reconstrução prévia sem sucesso com implante mamário exclusivo, cirurgias prévias no abdome ou falta de experiência em técnicas microcirúrgicas são situações em que o RMGD pode ser utilizado.
A ilha de pele no dorso pode ser ampla, todavia, para fechamento primário a largura pode chegar até 9cm e comprimento de 18cm. Retalhos de 17x7cm costumam ser suficientes. Compartimentos gordurosos no dorso foram descritos na década de 90 por Delay et al.7, com o objetivo de incorporar maior quantidade de fáscia gordurosa ao retalho e reconstruir mamas de tamanho pequeno a médio sem a necessidade de implantes, todavia, defeitos de contorno e formação de seroma na área doadora fizeram diminuir o interesse por esta técnica8.
Quantidades moderadas desta fáscia gordurosa podem ser mobilizadas com o RMGD com o objetivo de melhorar a consistência e o contorno da neomama, permitindo uma transição mais suave e menos marcada em seu polo superior, conforme descrito por Tavares-Filho et al.9. Novas gerações de implantes mamários, com gel de alta coesividade, conferem maior estabilidade ao formato mamário e melhor consistência ao toque, acarretando bom resultado estético à reconstrução associada ao RMGD, mesmo sem coleta excessiva de fáscia gordurosa10.
A reconstrução mamária com o RMGD pode ser feita tanto de forma tardia quanto imediata (no mesmo momento da mastectomia). O decúbito para esta cirurgia pode variar. Para os cirurgiões que optam por realizar colher o RMGD em decúbito ventral, há a necessidade de mudar a posição da paciente pelo menos uma vez em casos de reconstrução tardia ou mesmo duas vezes nos casos de reconstrução imediata.
Ao optar pelo decúbito lateral, esta mudança ocorre apenas uma vez nas reconstruções imediatas e torna-se desnecessária nas reconstruções tardias. Mudanças de decúbito trazem o risco de lesões articulares, ligamentares ou mesmo nervosas; além disso, demandam maior quantidade de material cirúrgico (novos campos estéreis) e aumentam o tempo total da cirurgia, com todas as suas potenciais implicações mórbidas (infecção, eventos tromboembólicos, hipotermia, etc) e financeiras (tempo de sala cirúrgica e medicações anestésicas, por exemplo), sendo necessários estudos específicos para quantificar tais variáveis.
A sistematização da técnica cirúrgica permite ao cirurgião seguir uma sequência determinada que resulta em minimização da perda de tempo. A mesma inicia-se com a orientação e treinamento dos auxiliares de enfermagem que irão posicionar a paciente, tornando este momento dinâmico, breve e seguro. O ato cirúrgico segue o passo-a-passo descrito, de modo que o cirurgião auxiliar e o instrumentador sabem exatamente a sequência de apresentações e instrumentais utilizados.
Como desvantagem, é possível citar que alguns cirurgiões podem demorar a se familiarizar com a dissecção em posicionamento diferente do habitual decúbito dorsal, além de dificuldades em customizar adequadamente a ilha de pele e o envelope cutâneo mamário remanescente, que se apresentam levemente pendentes para medial. O resultado final pode ser uma neomama de volume satisfatório, todavia, com ptose excessiva e/ou posicionamento acentuadamente excêntrico da ilha de pele.
A literatura mostra que o índice de complicações para esta cirurgia é baixo. Seroma no sítio doador costuma ser complicação razoavelmente comum, com trabalhos mostrando índices que variam de 16% a 79%11. A associação de pontos de adesão e drenos aspirativos pode ter justificado o baixo índice de seroma observado, o que corrobora os dados apresentados por Cammarota et al. em sua publicação de 201612.
Outras complicações são descritas com índices menores: 3,3% de infecções cutâneas, 1,3% de necrose do retalho, 0,6% de deiscência da ferida operatória e 3,2% de complicações clínicas12. Uma casuística maior poderia mostrar melhor aproximação do índice de complicações observado àqueles publicados na literatura.
Os índices de contratura capsular são variáveis, oscilando de 6% até 68%13,14. Seguimento mais prolongado é necessário para que a amostra apresentada tenha seu real índice de contratura avaliado. A radioterapia adjuvante sabidamente está associada a aumento nos índices desta complicação, configurando a chamada contratura capsular actínica15.
Uma alternativa para as pacientes que sabidamente necessitarão radioterapia adjuvante é a associação do RMGD com expansor tecidual mamário, havendo a troca para implante de silicone apenas após plena expansão tecidual e conclusão do tratamento radioterápico, momento em que é possível ajustar o formato da neomama e tratar com capsulotomia ou capsulectomia possíveis estigmas de contratura16,17.
A cirurgia plástica tem evoluído no sentido da utilização de opções com menos morbidade aos pacientes. A utilização de retalhos microcirúrgicos ou de implantes mamários associados a matrizes dérmicas têm despontado nos últimos anos nas publicações especializadas como alternativas de baixa morbidade e bons resultados4,18.
Todavia, os primeiros demandam treinamento cirúrgico específico prolongado, já as segundas ainda são pouco factíveis no Brasil em virtude do alto custo do material. Desta forma, o RMGD associado a implantes de silicone continua sendo uma excelente opção aos cirurgiões plásticos.
CONCLUSÃO
A sistematização da reconstrução mamária utilizando RMGD associado a implantes mamários de silicone em decúbito lateral mostra-se como uma alternativa não apenas segura ao cirurgião plástico, mas também rápida e de resultados consistentes. A familiarização com a cirurgia neste posicionamento é necessária para a plena obtenção destas vantagens.
REFERÊNCIAS
1. American Cancer Society. How Common Is Breast Cancer? [acesso 2017 Jun 1]. Disponível em: https://www.cancer.org/cancer/breast-cancer/about/how-common-is-breast-cancer.html
2. Brasil. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Câncer de Mama. Estimativa de novos casos. [acesso 2017 Jun 1]. Disponível em: http://www2.inca.gov.br/wps/wcm/connect/tiposdecancer/site/home/mama/cancer_mama++
3. Secretaria de Comunicação Social do Senado Federal. Lei Garante Reconstrução da Mama em Seguida à Retirada de Câncer. [acesso 2017 Jun 1]. Disponível em: http://www12.senado.leg.br/noticias/materias/2013/05/07/lei-garante-reconstrucao-da-mama-em-seguida-a-retirada-de-cancer
4. Macadam SA, Bovill ES, Buchel EW, Lennox PA. Evidence-Based Medicine: Autologous Breast Reconstruction. Plast Reconstr Surg. 2017;139(1):204e-29e. DOI: http://dx.doi.org/10.1097/PRS.0000000000002855
5. Wei FC, Mardini S. Retalhos e cirurgia plástica reconstrutora. Rio de Janeiro: Di Livros; 2012. p. 343-64.
6. Gabka CJ, Bohmert H. Cirurgia plástica e reconstrutiva da mama. 2ª ed. Porto Alegre: Artmed; 2010.
7. Delay E, Gounot N, Bouillot A, Zlatoff P, Rivoire M. Autologous latissimus breast reconstruction: a 3-year clinical experience with 100 patients. Plast Reconstr Surg. 1998;102(5):1461-78. PMID: 9774000 DOI: http://dx.doi.org/10.1097/00006534-199810000-00020
8. Heitmann C, Pelzer M, Kuentscher M, Menke H, Germann G. The extended latissimus dorsi flap revisited. Plast Reconstr Surg. 2003;111(5):1697-701. PMID: 12655217 DOI: http://dx.doi.org/10.1097/01.PRS.0000055444.84307.75
9. Tavares-Filho JM, Franco D, Moreto L, Porchat C, Franco T. Utilização do retalho miocutâneo de grande dorsal, com extensão adiposa, nas reconstruções mamárias: uma opção para preenchimento do polo superior. Rev Bras Cir Plást. 2015;30(3):423-8.
10. D'Alessandro GS, Povedano A, Santos LKIL, Santos RA, Góes JCS. Reconstrução mamária imediata com retalho do músculo grande dorsal e implante de silicone. Rev Bras Cir Plást. 2015;30(2):163-71.
11. Roy MK, Shrotia S, Holcombe C, Webster DJ, Hughes LE, Mansel RE. Complications of latissimus dorsi myocutaneous flap breast reconstruction. Eur J Surg Oncol. 1998;24(3):162-5. PMID: 9630851 DOI: http://dx.doi.org/10.1016/S0748-7983(98)92810-4
12. Cammarota MC, Ribeiro Junior I, Lima RQ, Almeida CM, Moura LG, Daher LMC, et al. Estudo do uso de pontos de adesão para minimizar a formação de seroma após mastectomia com reconstrução imediata. Rev Bras Cir Plást. 2016;31(2):158-65.
13. Gart MS, Smetona JT, Hanwright PJ, Fine NA, Bethke KP, Khan SA, et al. Autologous options for postmastectomy breast reconstruction: a comparison of outcomes based on the American College of Surgeons National Surgical Quality Improvement Program. J Am Coll Surg. 2013;216(2):229-38.
14. Perdikis G, Koonce S, Collis G, Eck D. Latissimus dorsi myocutaneous flap for breast reconstruction: bad rap or good flap? Eplasty. 2011;11e39.
15. McCarthy CM, Pusic AL, Disa JJ, McCormick BL, Montgomery LL, Cordeiro PG. Unilateral postoperative chest wall radiotherapy in bilateral tissue expander/implant reconstruction patients: a prospective outcomes analysis. Plast Reconstr Surg. 2005;116(6):1642-7. PMID: 16267426
16. Losken A, Nicholas CS, Pineel XA, Carlson GW. Outcomes evaluation following breast reconstruction using latissimus dorsi myocutaneous flaps. Ann Plast Surg. 2010;65(1):17-22.
17. Lennox PA, Bovill ES, Macadam AS. Evidence-Based Medicine: Alloplastic Breast Reconstruction. Plast Reconstr Surg. 2017;140(1):94e-108e.
18. Qureshi AA, Broderick KP, Belz J, Funk S, Reaven N, Brandt KE, et al. Uneventful versus Successful Reconstruction and Outcome Pathways in Implant-Based Breast Reconstruction with Acellular Dermal Matrices. Plast Reconstr Surg. 2016;138(2):173e- 83e.
1. Hospital Napoleão Laureano, João Pessoa, PB,
Brasil
2. Hospital das Clínicas, Recife, PE,
Brasil.
3. Sociedade Brasileira de Cirurgia Plástica, São
Paulo, SP, Brasil.
Autor correspondente: Igor Chaves Gomes Luna, Rua Reinaldo Tavares de Melo, 142 - Manaíra - João Pessoa, PB, Brasil. CEP 58038-300. E-mail: igorluna_med@hotmail.com
Artigo submetido: 10/6/2017.
Artigo aceito: 18/9/2017.
Conflitos de interesse: não há.





 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter