

Special Article - Year 2019 - Volume 34 -
Ritidoplastia e paralisia facial: como lidar?
Facelift and Facial nerve injury: how to deal with?
RESUMO
Não é novidade para os cirurgiões plásticos, especialmente aos que se dedicam à cirurgia de face, que o nervo facial pode ser lesado virtualmente em qualquer cirurgia de ritidoplastia. Porém, apesar da importância contida nesse tema, não é tarefa simples encontrar na literatura artigos que abordem de forma objetiva a correlação entre lesão do nervo facial e cirurgia facial. Paralisias faciais, sejam elas completas ou não, podem se tornar situações potencialmente conflituosas na relação médicopaciente. Este artigo, portanto, visa propor de forma clara e sucinta, baseada na experiência dos autores, um guia de como evitar, identificar e tratar uma potencial lesão do nervo facial no contexto de uma cirurgia de face, em especial a ritidoplastia.
Palavras-chave: Ritidoplastia; Nervo facial; Paralisia facial; Modalidades de fisioterapia; Procedimentos cirúrgicos reconstrutivos
ABSTRACT
Is largely known that the facial nerve virtually can be injured in every facial lift. Even though its importance, it is difficult to find in the literature articles related to this theme. Complete or incomplete facial paralysis after a facial procedures, may become a very uncomfortable situation between the patient and the surgeon, that is why we propose in this article a guide which intends to help avoid, identify and manage a facial nerve injury in the event of a face lift. Identifying Facial palsy before the surgery: Intending to make the pre-op facial assessment as simple as possible, we suggest a systematic approach examination. Avoiding facial nerve injury during face lifting: Several technical details are discussed along the text aiming to minimize the risk of nerve damage during the surgical procedure. What to in the event of a post-operative facial palsy: The authors propose a logical approach to the facial palsy, suggesting a planning for diagnosis, classification of the lesion and a rational treatment for the injury. Conclusion: This article presents a guide showing some safe technical options to avoid nerve damage during rythidoplasty, how to identify the lesion and treat it if necessary.
Keywords: Rhytidoplasty; Facial nerve; Facial paralysis; Physical therapy modalities; Reconstructive surgical procedures
INTRODUÇÃO
É amplamente sabido que o nervo facial pode ser lesado em virtualmente cada ritidoplastia. Apesar de sua importância, é difícil encontrar na literatura artigos relacionados com este tema. A maioria dos artigos que se referem à lesão do nervo facial e ritidoplastia são do início dos anos 70 até final dos anos 80, e concentrando-se quase exclusivamente em como evitar lesões do nervo facial através de dissecções anatômicas. Só muito poucos trabalhos abordam a gestão da lesão do nervo e, quando o fazem, referem basicamente o tratamento completo de transecção do nervo, que estatisticamente falando, corresponde apenas a 2,6% dos casos operados. É também surpreendente que quando se utiliza os descritores “face lift/lifting + facial palsy (FP)” ou “ rhitydoplasty/ rhitydectomy + facial palsy”, no PubMed, não há artigos que atendam os critérios da pesquisa1,2.
Atualmente, não há dados concisos sobre a incidência da lesão parcial ou total do nervo facial durante procedimentos faciais cosméticas, uma vez que são provavelmente sub-reportados. A paralisia facial completa ou incompleta após procedimentos faciais pode-se tornar numa situação muito incômoda entre o paciente e o cirurgião, por isso propomos neste artigo um guia que visa ajudar a evitar, identificar e controlar uma lesão do nervo facial em caso de uma ritidoplastia.
DISCUSSÃO
Avaliação - Paralisia Facial antes da cirurgia? Exame clínico pré-operatório.
Apesar dos nossos maiores esforços para evitar uma lesão nervosa durante o procedimento de uma ritidoplastia, isso pode ocorrer. Mas é importante ressaltar que num número não negligenciável de casos, os pacientes já têm um certo grau de paralisia facial ou fraqueza pré-operatório que passa despercebido na nossa consulta de rotina. É bastante complicado identificar os sinais de uma paralisia muito leve se o cirurgião não está familiarizado ao tratamento de tais casos regularmente. Mesmo os pacientes por vezes não notam ter qualquer grau de assimetria até que o cirurgião o identifica. Mas eles certamente o referirão numa situação de pós-operatório.
Com o objetivo de fazer uma avaliação facial pré-operatória o mais simples possível, sugerimos uma abordagem sistemática no exame. Devemos lembrar que uma história estruturada e o exame clínico do paciente permite o planejamento preciso do tratamento e a antecipação de problemas que podem ser agravados pela cirurgia3.
A avaliação da assimetria e espontaneidade do movimento facial pode ser realizada enquanto se obtém uma anamnese pré-operatória normal. Em relação ao histórico funcional, uma abordagem “top-down” é utilizada de forma sistemática, começando com a testa. Uma história oftálmica e nasal básica é adquirida, e o paciente é questionado quanto à continência oral e fala. O cirurgião deve estar sempre atento para incluir nos prontuários a história de paralisia de Bell do paciente. Uma recorrência da paralisia ou até mesmo um novo início é raro e indesejável, mas verdadeiramente possível, em nossa experiência geralmente de três a cinco semanas após a operação.
O exame físico também é realizado a partir da testa para baixo. A ausência de rítides e o grau de ptose da testa são avaliados. Com tempo, a ptose assimétrica da testa é uma condição comum e fotos mostram-no muito claramente. A pálpebra superior também é examinada para a presença de dermatocálase e retração da pálpebra. O paciente é solicitado a fechar os olhos, qualquer lagoftalmo é medido. A posição da pálpebra inferior é avaliada quanto ao ectrópio e um teste de pressão é realizado3.
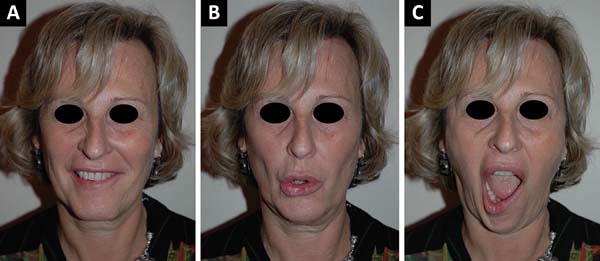
O nariz é examinado para excluir uma obstrução nasal fixo e o teste de Cottle é realizado para determinar o colapso da válvula nasal4. Ptose da face média e assimetria do sulco nasolabial são avaliados. A boca é examinada em repouso, com o grau de queda da comissura labial e o desvio do filtro labial para o lado contralateral é medido, se presente. A excursão da comissura também é quantificada, e o grau de dentição e a forma do sorriso são anotados5-7. O lábio inferior é avaliado se o músculo depressor do ângulo da boca apresenta uma função frouxa, indicando comprometimento da divisão mandibular8. Tirar fotografias sequenciais também é muito importante, em repouso e em movimento, antes e após a cirurgia, havendo ou não complicações (Figura 1).
Como evitar a lesão do nervo facial durante a ritidoplastia?
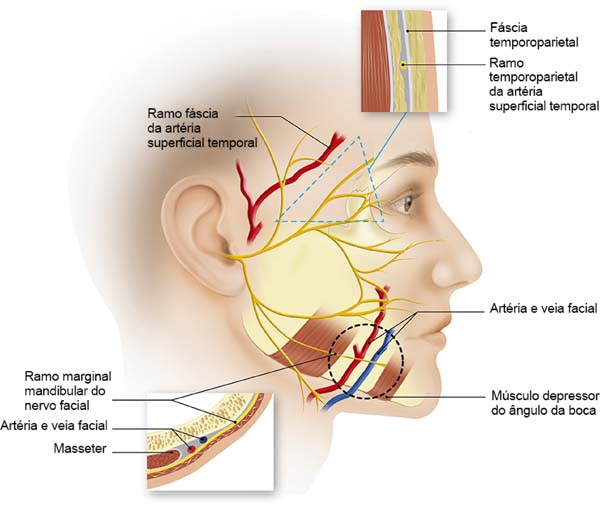
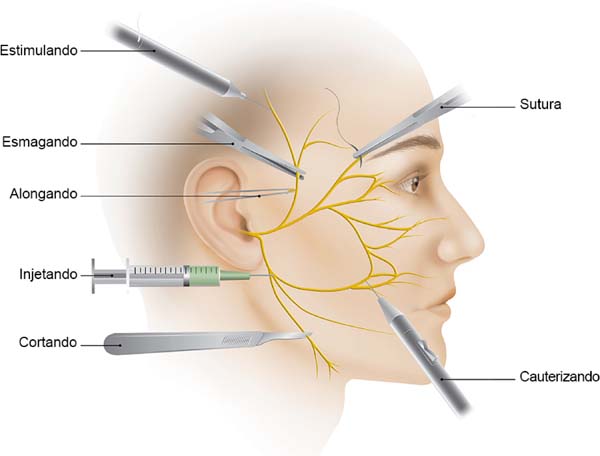
Vários artigos têm sido publicados sobre este tema em particular. É claro que, para nós, um profundo conhecimento da estratigrafia do rosto e a anatomia do nervo facial é fundamental. Sobre este assunto, um artigo publicado no final da década de 70 por Baker2 e o livro de Brook Seckel: Zonas Faciais de Perigo (Figura 2)9, são fundamentais para o cirurgião que executa ritidoplastias. Mesmo com um domínio da anatomia, devemos sempre preparar uma dissecção meticulosa, porque a anatomia das áreas de alto risco são muito variáveis e não pode ser invocado de paciente para paciente2,10.
Atenção para com detalhes mínimos é tão importante quanto a própria dissecação. Injete as soluções com cuidado, usando agulhas finas ou cânulas pequenas. Somos muito permissivos com o volume injetado, usando cerca de 200 cc de uma solução de 1: 500.000 de adrenalina. Evitamos soluções anestésicas intra-operatórias. Acreditamos que a hidrodissecção facilita o enfraquecimento do tecido, evitando dissecções agudas desnecessárias e implicando, em última instância, menor risco de lesões inadvertidas e formação de hematoma. Uma dissecção romba deve ser preferido especialmente para técnicas sub sistema musculoaponeurótico superficial (SMAS). Utilizamos rotineiramente o Trepsat dissectors (Pouret medical), tanto para as abordagens faciais como do pescoço, tornando virtualmente impossível uma transecção do nervo (Figura 3).
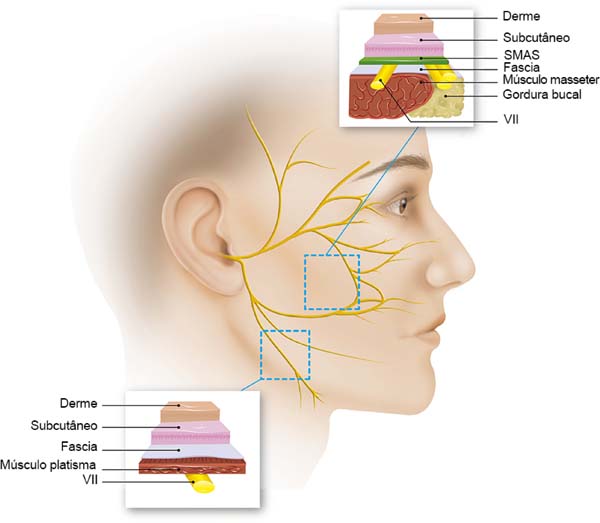
A hemostasia e sutura também merecem atenção. Evite colocar suturas profundas no SMAS, colocando-os preferencialmente ao longo do eixo dos principais ramos do nervo facial. O cirurgião também deve evitar o excesso de tração e alongamento indevido2. Durante a hemostasia, é aconselhável não usar grandes pinças ou fórceps, mas sim um cautério bipolar, o que minimiza o trauma da eletrocoagulação (Figura 4). Mas se tivermos alguma dúvida sobre a lesão de ramo do nervo, um neuroestimulador deve estar prontamente disponível na sala de operação, para dissipar qualquer suspeita. Note que o paciente não deve ser curarizado.
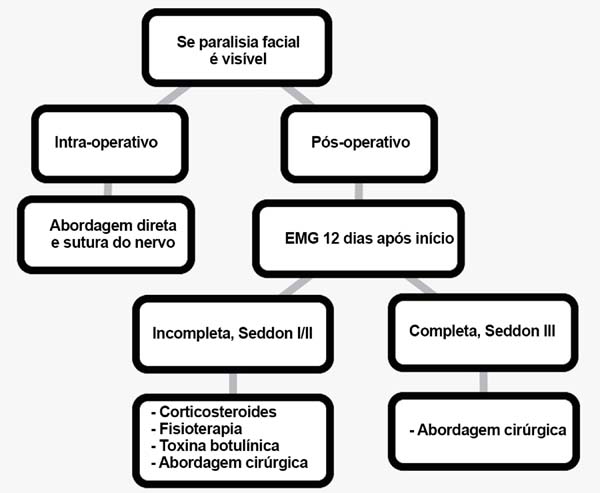
Se a secção do nervo é visível per-operatoriamente
Ocasionalmente, o cirurgião será capaz de identificar o ramo danificada do nervo facial. No entanto, à medida que as dissecções vão em direção ao sulco nasolabial, menos espessos são os nervos, dificultando a identificação da anatomia correta a olho nu. Vários estudos têm sido publicados definindo marcos anatômicos correlacionando às divisões do nervo12-14. Mas a lógica de intervenção é testar o ramo danificado e os circundantes com um neuroestimulador para assegurar não efetuar conexões erradas mais tarde.
Cumprida essa fase, procedemos à sutura do nervo. Sempre sob ampliação, vamos começar por dissecar as extremidades proximal e distal do nervo, verificar se não há nenhuma perda de substância e realizar a sutura epineural com suturas não-absorvíveis nylon 9.0 ou 10. No caso de tração do nervo, defendemos o uso de enxertos de nervos, normalmente colhido do grande nervo auricular ou do nervo sural15.
Se PF pós-operatória ocorreu: o que fazer agora?
Diagnóstico
Na grande maioria dos casos, o cirurgião irá enfrentar o início da paralisia no pós-operatório. A avaliação dos músculos mímicos da face logo após o final da cirurgia, sempre que possível, é uma boa maneira de diferenciar os traumas cirúrgicos de outras causas que poderiam chegar tardiamente no pós-operatório, como a paralisia de Bell. Vale a pena lembrar-se de efetuar um acompanhamento muito rigoroso das fotos, tirando fotos de cada contato com o paciente.
Vários sistemas de pontuação permitem avaliar clinicamente a gravidade da paralisia dos nervos faciais periféricas. Em nossa opinião, o mais adequado sistema de classificação do nervo facial é o Teste Muscular de Freys (Quadro 1). Esta escala permite avaliar a função de cada músculo separadamente, em contraste com outros sistemas, como a escala de House-Brackmann, que avalia os grupos de músculos faciais em conjunto. O sistema baseia-se na avaliação do grau de excursão voluntário dos músculos faciais, avaliando dez grupos musculares e atribuindo-lhes valores de 0 a 3, para cada músculo, obtendo uma pontuação total que varia de 0 a 3016. Geralmente limitamos a nossa avaliação de dois ou três músculos, de acordo com o ramo do nervo lesado.
| Dez músculos faciais | Pontuação | Contração muscular | |
|---|---|---|---|
| Frontalis | Enruga a testa e levanta as sobrancelhas | 0 | Sem contração |
| Corrugador Supercili | Puxa as sobrancelhas medialmente e para Baixo | 1 | Contração mínima |
| Orbicularis ocular | Fecha as pálpebras | 2 | Grande Excursão Mas contração fraca |
| Prócero | Puxa o ângulo medial da sobrancelha para baixo, produzindo rugas sobre a ponte do nariz | 3 | Contração Normal |
| Dilatador Naris músculo | Expande as narinas | ||
| Orbicularis oris | Fecha e projeta os lábios | Pontuação Total (0-30) | Grau de paralisia facial |
| Risório | Puxa o canto da boca lateral | 20-30 | Ligeiro |
| Zigomático maior | Puxa o canto da boca para cima e lado | 10-20 | Leve |
| Bucinador | Comprime a bochecha contra os dentes | 0-10 | Grave |
| Mentual | Deprime o lábio inferior e enruga a pele do queixo | 0 | Total |
A paralisia do nervo facial também pode ser categorizada como completo se houver incapacidade em contrair voluntariamente os músculos faciais, ou incompleta (parcial). O grau de lesão do nervo também pode ser avaliado por estudos de condução nervosa do nervo facial (electromiografia-EMG). Uma redução do potencial de ação muscular composto sugere degeneração axonal enquanto um aumento na latência sugere desmielinização do nervo17.
A paralisia do nervo facial é uma situação assustadora para o paciente. Provavelmente as perguntas mais frequentes colocadas por estes pacientes são se sua função facial retornará ao normal um dia e quanto tempo isso vai levar.
Da grande variedade de exames prognósticos, discutido por Hughes18, a EMG parece ser o teste mais confiável para prever o prognóstico do paciente19. Uma avaliação racional da lesão seria pedir uma EMG no início do pós-operatório, entre o dia 4 e 6, embora não haja nenhuma regra para este primeiro exame, porque nesta fase inicial, a eletromiografia é usada para avaliar a restante atividade voluntária. Se forem detectados potenciais voluntários, a paralisia é rotulada como incompleta. Somente em caso de eletromiografia totalmente silenciosa a paralisia é considerada completa19.
Um diagnóstico de acordo com a classificação de Sunderland e Seddon (Quadro 2) pode não ser feito nessa fase, porque a atividade patológica espontânea como um sinal de degeneração neural não ocorre antes dos 10 a 14 dias após o início da paralisia. Este teste destina-se principalmente a classificar a gravidade da paralisia de um indivíduo e não fornece informações prognósticas confiáveis20,21.
| Sunderland | Seddon | Prejuízo | Potencial recuperação |
|---|---|---|---|
| I | Neurapraxia I | Interrupção da condução nervosa, mas a estrutura do nervo e axônio permanecem intactos. | Completo (até 12 semanas) |
| II | Axonotmese II | Interrupção da condução nervosa e degeneração axonal, mas mantendo a estrutura do nervo intacta. | Completo (1mm/dia) |
| III | Axonotmese II | Ruptura do endoneuro, mas o perineuro e epineuro permanecem intactos. | Completo (1mm/dia) |
| IV | Axonotmese II | Ruptura do endoneuro e perineuro, mas o epineuro permanece intacto. | Pobre a nenhum |
| V | Neurotmese III | Transecção Total da fibra nervosa. | Nenhum |
Um segundo exame deve ser realizado não antes dos 10 a 14 dias após o início da paralisia. Após este período, todos os critérios diagnósticos podem existir para estabelecer um diagnóstico segundo Seddon, que implica um prognóstico sobre a esperada evolução clínica19,20.
Steinner afirma em seu artigo que quando uma fibrilação é detectada na EMG após os 10 a 14 dias, o paciente tem 80% de chance de evoluir para um resultado desfavorável, mas, por outro lado, a ausência desses sinais implica cerca de 93% de chance de recuperação total20.
Tratamento
Proteção para os olhos
Um dos problemas mais graves com a paralisia facial da face superior é o envolvimento do olho se a comissura da pálpebra permanecer aberta. Neste caso, os cuidados com os olhos focam na proteção da córnea da desidratação, secagem ou escoriações devido ao fechamento insuficiente da pálpebra ou de lágrima. Pomada ocular é proposta durante o dia e noite sustentada por óculos de proteção durante o dia22.
Fisioterapia
Existem poucos ensaios clínicos controlados disponíveis sobre a eficácia da fisioterapia para paralisias faciais. Num estudo randomizado com 50 pacientes com paralisia de Bell e grau IV da escala de House Brackmann, a terapia com mímica, terapia da fala, incluindo massagem automática, exercícios de relaxamento, inibição de sincinesia, exercícios de coordenação ou expressão emocional, resultaram em melhora da rigidez facial, motilidade labial e os índices físicos e sociais do índice de incapacidade facial23. Uma técnica simples e reprodutível tem sido usada e é aconselhada por nós: a terapia de feedback do espelho. Basicamente consiste em treinar o lado paralisado para reproduzir movimentos simétricos do lado não afetado, à frente de um espelho. Blanchin et al.24, em 2013, publicaram um artigo demonstrando que a terapia de espelho aplicada a pacientes com paralisia facial de longa data, submetidos à técnica de reanimação facial de Labbe, é mais eficaz na recuperação do sorriso espontâneo do que as terapias convencionais.
Corticosteroides
Até à data, do nosso conhecimento não há nenhum estudo que discuta trauma do nervo facial e o uso de esteroides para seu tratamento. Mas, uma vez que sabemos que a inflamação (principalmente edema) do nervo facial é chave na patogênese de outro tipos de paralisia facial, tais como a paralisia de Bell, provavelmente podemos extrapolar o conceito, aplicando ao trauma cirúrgico, uma vez que a grande maioria dos casos são constituídas de lesões parciais.
O poderoso efeito anti-inflamatório dos corticosteroides tem sido usado há muito tempo no distúrbio de paralisia de Bell e tem sido recentemente fundamentado por uma base de evidências crescente e bem projetada. Uma revisão da Cochrane incluiu 1569 pacientes de oito ensaios clínicos randomizados de qualidade adequada, e demonstrou benefício na melhora da recuperação facial e também uma redução significativa na sincinesia motora no grupo de esteroides25. Outra revisão sistemática de alto nível publicada no Journal of American Medical Association (JAMA) concluiu que os corticosteroides usados isoladamente produziram um risco reduzido de recuperação insatisfatória26.
Embora as revisões apoiam o uso de corticosteroides na paralisia facial, não são claras na proposta de um esquema de utilização. Há inúmeros autores com protocolos mais criativas. Propomos os aplicados nas revisões mais alargadas:
- O protocolo de Sullivan27: Prednisolona 25mg, via oral (PO), duas vezes ao dia, durante 10 dias, com início máximo até 72h do início da paralisia.
- O protocolo de Engström28: Prednisolona 60mg via oral (PO) por 5 dias e, em seguida, a dose é reduzida em 10mg por dia durante 5 dias, começando também antes de 72h do início da paralisia.
- O protocolo de Lagalla29: Prednisona 1g, via intravenosa (IV), por 3 dias, depois 0,5 g IV por 3 dias.
- O protocolo de Stennert (Tabela 1)30.
| Dias de tratamento | Cortisona - Prednisolona (dose equivalente - mg/dia) | Dextrano 40 com sorbitol ou manitol 5-10%c (ml) | Pentoxifilina (Trental) (mL) | ||||
|---|---|---|---|---|---|---|---|
| <70kg | >70kg | ||||||
| Internação | 1 | Infusãoa | 200 | 250 | 500 | 5 | |
| 2 | 200 | 250 | 500 | 10 | |||
| 3 | 150 | 500 | 15 | ||||
| 4 | 150 | 500 | 15 | ||||
| 5 | 100 | 500 | 15 | ||||
| 6 | 100 | 500 | 15 | ||||
| 7 | 75 | 500 | 15 | ||||
| 8 | 50 | 500 | 15 | ||||
| 9 | Oral circadianob | 40 | 500 | 15 | |||
| 10 | 20 | 500 | 15 | ||||
| Ambulatório | 11 | (6-8 da manhã) | 15 | ||||
| 12 | 12,5 | ||||||
| 13 | 10 | ||||||
| 14 | 7,5 | ||||||
| 15 | 5 | ||||||
| 16 | 2,5 | ||||||
| 17 | 2,5 | ||||||
| 18 | 2,5 | ||||||
Stennert30 propôs um protocolo baseado no pressuposto de que o dano neural é causada por edema e isquemia primária e secundária. Com a intenção de reduzir a reação edematosa e flogística, propôs o uso de corticosteroides. Secundariamente, tentou aumentar a perfusão do nervo periférico, associando a pentoxifilina e o dextrano à infusão intravenosa.
A eficácia da pentoxifilina sobre a recuperação de paralisia de Bell foi testada somente em conjunto com outras drogas, em particular esteroides e dextrano de baixo peso molecular. Os estudos mostraram um efeito benéfico desta combinação terapêutica, mas não se sabe qual destes fármacos é realmente responsável pelo efeito benéfico16,28.
Toxina botulínica
Quando injetada nos músculos faciais, a toxina botulínica reduz a assimetria facial em pacientes portadores de paralisia facial e tem sido usada para tratar sincinesia, hiperlacrimação, hipercinesia9. O que a maioria das pessoas negligenciam é o efeito “fisioterapêutico” da toxina. Quando aplicada no lado sadio, a toxina modera os movimentos, obrigando o paciente a exercer o lado afetado, o que ajuda o músculo a recuperar, e estimular novas conexões neurais. Por isso, pensamos que deve ser utilizada mesmo na ausência de hipercinesia, após a confirmação do diagnóstico, por volta de 12 dias após a cirurgia (início da paralisia facial) e a EMG.
CONCLUSÃO
Não é sempre clara quais as medidas que deve tomar em caso de lesão neural acidental, por isso propomos um guia mostrando algumas opções técnicas seguras para evitar lesões aos nervos, como identificar e tratar, se necessário. As condutas aqui apresentadas foram baseadas na nossa própria experiência no tratamento da paralisia facial e estudos publicados na literatura. Mesmo que pareça difícil lidar com tais casos, devemos ter em conta que, em geral, os pacientes com lesão parcial do nervo têm um excelente prognóstico, com uma taxa de recuperação variando de 90 a 94%20, principalmente quando as decisões certas são tomadas na hora certa. Apresentamos um fluxograma de decisão para ajudar a tomar decisões clínicas (Figura 5).
COLABORAÇÕES
|
FSR |
Análise e/ou interpretação dos dados, aprovação final do manuscrito, coleta de dados, concepção e desenho do estudo, gerenciamento do projeto, metodologia, redação - preparação do original, redação - revisão e edição, supervisão, visualização. |
|
CMR |
Coleta de dados, redação - revisão e edição, supervisão, visualização. |
|
FV |
Redação - revisão e edição, supervisão. |
|
DL |
Análise e/ou interpretação dos dados, aprovação final do manuscrito, coleta de dados, concepção e desenho do estudo, gerenciamento do projeto, metodologia, supervisão. |
REFERÊNCIAS
1. Castañares S. Facial nerve paralyses coincident with, or subsequent to, Rhytidectomy. Plast Reconstr Surg. 1974;54(6):637-43.
2. Baker DC, Conley J. Avoiding facial nerve injuries in rhytidectomy. Anatomical variations and pitfalls. Plast Reconstr Surg. 1979;64(6):781-95.
3. Fattah A, Borschel GH, Manktelow RT, Bezuhly M, Zuker RM. Facial Palsy and Reconstruction. Plast Reconstr Surg. 2012;129(2):340e-52e.
4. Howard BK, Rohrich RJ. Understanding the nasal airway: principles and practice. Plast Reconstr Surg. 2002;109(3):1128-46.
5. Manktelow RT, Zuker RM, Tomat LR. Facial paralysis measurement with a handheld ruler. Plast Reconstr Surg. 2008;121(2):435-42.
6. Paletz JL, Manktelow RT, Chaban R. The shape of a normal smile: implications for facial paralysis reconstruction. Plast Reconstr Surg. 1994;93(4):784-9.
7. Rubin LR. The anatomy of a smile: its importance in the treatment of facial paralysis. Plast Reconstr Surg. 1974;53(4):384-7.
8. de Maio M, Bento RF. Botulinum toxin in facial palsy: an effective treatment for contralateral hyperkinesis. Plast Reconstr Surg. 2007;120(4):917-27.
9. Seckel BR. Facial danger zones: avoiding nerve injury in facial plastic surgery. 1a ed. St Louis: Quality Medical Publishing; 1994.
10. Roostaeian J, Rohrich RJ, Stuzin JM. Anatomical considerations to prevent facial nerve injury. Plast Reconstr Surg. 2015;135(5):1318-27.
11. May M, Schaitkin BM. The facial nerve. New York: Thieme; 2000.
12. Chatellier A, Labbé D, Salamé E, Bénateau H. Skin reference point for the zygomatic branch of the facial nerve innervating the orbicularis oculi muscle (anatomical study). Surg Radiol Anat. 2013;35(3):259-62.
13. Stuzin JM, Wagstrom L, Kawamoto HK, Wolfe SA. Anatomy of the frontal branch of the facial nerve: the significance of the temporal fat pad. Plast Reconstr Surg. 1989;83(2):265-71.
14. Dorafshar AH, Borsuk DE, Bojovic B, Brown EN, Manktelow RT, Zuker RM, et al. Surface anatomy of the middle division of the facial nerve: Zuker’s point. Plast Reconstr Surg. 2013;131(2):253-7.
15. Sameem M, Wood TJ, Bain JR. A systematic review on the use of fibrin glue for peripheral nerve repair. Plast Reconstr Surg. 2011;127(6):2381-90.
16. Dubreuil C, Charachon R. Clinique: la paralysie faciale peripherique. In: Charachon R, Bebear JP, Sterkers O, Magnan J, Soudant J, eds. La paralysie faciale. Le spasme hemifacial. Paris: Société Française D’oto-Rhino-Laryngologie et de Pathologie Cervico-Faciale / L’européenne D’éditions; 1997. p. 135-57.
17. Finsterer J. Management of peripheral facial nerve palsy. Eur Arch Otorhinolaryngol. 2008;265(7):743-52.
18. Hughes GB. Prognostic tests in acute facial palsy. Am J Otol. 1989;10(4):304-11.
19. Grosheva M, Wittekindt C, Guntinas-Lichius O. Prognostic value of electroneurography and electromyography in facial palsy. Laryngoscope. 2008;118(3):394-7.
20. Sittel C, Stennert E. Prognostic value of electromyography in acute peripheral facial nerve palsy. Otol Neurotol. 2001;22(1):100-4.
21. Chhabra A, Ahlawat S, Belzberg A, Andreseik G. Peripheral nerve injury grading simplified on MR neurography: As referenced to Seddon and Sunderland classifications. Indian J Radiol Imaging. 2014;24(3):217-24.
22. Holland NJ, Weiner GM. Recent developments in Bell’s palsy. BMJ. 2004;329(7465):553-7.
23. Beurskens CH, Heymans PG. Positive effects of mime therapy on sequelae of facial paralysis: stiffness, lip mobility, and social and physical aspects of facial disability. Otol Neurotol. 2003;24(4):677-81.
24. Blanchin T, Martin F, Labbe D. Rééducation des paralysies faciales après myoplastie d’allongement du muscle temporal. Intérêt du protocole « effet-miroir ». Ann Chir Plast Esthet. 2013;58(6):632-7.
25. Salinas RA, Alvarez G, Daly F, Ferreira J. Corticosteroids for Bell’s palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 2010;(3):CD001942. DOI: 10.1002/14651858.CD001942.pub4
26. de Almeida JR, Al Khabori M, Guyatt GH, Witterick IJ, Lin VY, Nedzelski JM, et al. Combined corticosteroid and antiviral treatment for Bell palsy: a systematic review and meta-analysis. JAMA. 2009;302(9):985-93.
27. Sullivan FM, Swan IR, Donnan PT, Morrison JM, Smith BH, McKinstry B, et al. Early treatment with prednisolone or acyclovir in Bell’s palsy. N Engl J Med. 2007;357(16):1598-607.
28. Engström M, Berg T, Stjernquist-Desatnik A, Axelsson S, Pitkäranta A, Hultcrantz M, et al. Prednisolone and valaciclovir in Bell’s palsy: a randomised, double-blind, placebo-controlled, multicentre trial. Lancet Neurol. 2008;7(11):993-1000.
29. Lagalla G, Logullo F, Di Bella P, Provinciali L, Ceravolo MG. Influence of early high-dose steroid treatment on Bell’s palsy evolution. Neurol Sci. 2002;23(3):107-12.
30. Stennert E. New concepts in the treatment of Bell’s palsy. In: Malcolm D, House G, House WF, eds. Disorders of the facial nerve. New York: Raven Press; 1981. p. 313-8.
1. Clínica Cirurgia Plástica Beauté, Belém, PA,
Brasil.
2. Universidade Estadual de Botucatu, Botucatu,
SP, Brasil.
3. Clínica Particular, Caen, Normandia,
França.
Autor correspondente: Franklin de Souza Rocha, Travessa Dom Romualdo de Seixas 1560, Belém, Brasil. CEP: 66055-028. E-mail: franklinrocha1@hotmail.com
Artigo submetido: 02/03/2018.
Artigo aceito: 16/04/2019.
Conflitos de interesse: não há.







 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter