
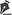
Original Article - Year 2020 - Volume 35 -
Reconstrução mamária com implante: confecção de bolsa com retalho reverso de músculo serrátil anterior
Breast reconstruction with implant: creating a pocket with a reverse serratus anterior muscle flap
RESUMO
Introdução: A reconstrução mamária imediata desempenha papel importante no tratamento do câncer de mama, permitindo uma recuperação emocional e física, ainda que parcial, das pacientes. Nas reconstruções mamárias em único estágio, baseada em implante permanente, pode ser difícil cobrir toda a prótese com retalho muscular. O objetivo do estudo é apresentar a realização de uma bolsa muscular para implante através do retalho reverso do músculo serrátil anterior associada à dissecção submuscular do músculo peitoral maior.
Métodos: Foi realizado um estudo prospectivo com 61 pacientes submetidas à mastectomia seguida de reconstrução imediata (74 reconstruções) com implante e retalho reverso do músculo serrátil anterior associado à dissecção submuscular do peitoral, entre janeiro de 2017 e julho de 2018. Foram analisados a idade, terapia adjuvante e neoadjuvante, volume do implante, tempo de internação hospitalar, seguimento e complicações, incluindo déficit funcional e falha na reconstrução.
Resultados: 74 pacientes foram operadas pela técnica descrita com idade média de 49,2 anos. O volume do implante variou de 200 a 500cc e o tempo médio de proservação foi de 14,9 meses. 14 pacientes (18,9%) apresentaram complicações como hematoma, deiscência de sutura, necrose de retalho cutâneo e extrusão do implante.
Conclusão: A reconstrução mamária com retalho reverso do músculo serrátil anterior associado à dissecção submuscular do peitoral maior permite, na grande maioria dos casos, cobertura muscular completa do implante, redução de complicações cirúrgicas maiores e bom aspecto estético.
Palavras-chave: Cirurgia plástica; Neoplasias da mama; Mastectomia; Reconstrução; Implante mamário
ABSTRACT
Introduction: Immediate breast reconstruction plays an important role in the treatment of breast cancer and relatively promotes patients' emotional and physical recovery. It may be difficult to cover the entire prosthesis with a muscle flap in single-stage breast reconstructions based on a permanent implant. This study aimed to present a muscle pocket for the implant using a reverse anterior serratus muscle flap associated with submuscular dissection of the pectoralis major muscle.
Methods: This was a prospective study comprising 61 patients undergoing mastectomy followed by immediate reconstruction (74 reconstructions) with implant and anterior serratus muscle reverse flap associated with submuscular pectoralis dissection between January 2017 and July 2018. In this study, age, adjuvant and neoadjuvant therapies, implant volume, length of hospital stay, follow-up, and complications, including functional deficit and reconstruction failure, were analyzed.
Results: The technique described was used to operate 74 patients with a mean age of 49.2 years. The volume of the implant varied from 200 to 500 cc, and the mean follow-up time was 14.9 months. Complications such as hematoma, suture dehiscence, skin flap necrosis, and implant extrusion were observed in 14 patients (18.9%).
Conclusion: In most cases, breast reconstruction with an anterior serratus muscle reverse flap associated with submuscular dissection of the pectoralis major muscle allows the complete muscle coverage of the implant, reduces the occurrence of major surgical complications, and has a good aesthetic result.
Keywords: Surgery, Plastic; Breast neoplasms; Mastectomy; Reconstruction; Breast implants.
INTRODUÇÃO
A reconstrução mamária imediata desempenha papel importante no tratamento do câncer de mama, permitindo uma recuperação emocional e física, ainda que parcial, das pacientes1,2.
As opções de reconstrução mamária incluem colocação de implantes e/ou uso de tecido autólogo. O uso de implante, seja permanente ou expansor, é amplamente aceito e cada vez mais indicado, principalmente com o aumento das mastectomias poupadoras de pele e do complexo areolopapilar (CAP)3.
Na reconstrução em único estágio baseada em implante permanente, pode ser difícil conseguir boa cobertura da prótese com retalho muscular ou de fáscia.
Este estudo apresenta a técnica para confecção de uma bolsa muscular para o implante, através do retalho reverso do músculo serrátil anterior em associação com a dissecção submuscular do peitoral maior.
OBJETIVO
Apresentar uma técnica de confecção de bolsa muscular com retalho reverso de musculo serrátil anterior para cobertura do implante, em reconstrução mamária imediata.
MÉTODOS
Trata-se de estudo prospectivo, descritivo e analítico. Foram seguidos os princípios da Declaração de Helsinki revisada em 2000 e da Resolução 196/96 do Conselho Nacional de Saúde. O projeto foi submetido e aprovado pelo Comitê de Ética em Pesquisa do Hospital Felício Rocho (CAAE 94178618.0.0000.5125), sob parecer número 2.947.562. Os pacientes analisados preencheram o Termo de Consentimento Livre e Esclarecido. Não foram observados conflitos de interesse e não existiram fontes de financiamento.
Entre janeiro de 2017 e julho de 2018, 61 pacientes foram submetidas à mastectomia pela Clínica de Mastologia do Hospital Felício Rocho (Belo Horizonte/MG, Brasil). Desse total, 13 mastectomias foram bilaterais, resultando em 74 reconstruções mamárias imediatas com implante permanente. As reconstruções foram realizadas pela Clínica de Cirurgia Plástica da mesma Instituição. As próteses foram incluídas em bolsa formada pelo retalho reverso do músculo serrátil anterior e pela dissecção submuscular do peitoral maior.
Os critérios de inclusão foram: pacientes submetidas à mastectomia poupadora de pele ou do CAP, com indicação de reconstrução imediata unilateral ou bilateral, com implante permanente.
Os critérios de não inclusão foram: mastectomia previa remota, câncer de mama inflamatório, pacientes com grandes resseções de pele (com indicação de retalho musculocutâneo ou expansor). Os critérios de exclusão foram pacientes que não fizeram proservação adequada no pós-operatório.
As variáveis estudadas foram idade, terapias adjuvante e neoadjuvante, volume do implante, tempo de internação hospitalar, proservação e complicações, incluindo déficit funcional e falha na reconstrução.
A avaliação do déficit funcional, principalmente escápula alada, foi realizada através da manobra de Hoppenfeld4, em que se pede ao paciente que fique em pé, flexione o ombro a 90º, coloque as mãos espalmadas na parede (ombros próximos às mãos), estenda os cotovelos, empurrando o corpo para trás. Durante a execução desse teste, a metade medial da escápula fica evidente na presença da escápula alada, quando comparada ao lado não afetado5.
Falha na reconstrução foi considerada nos pacientes em que, no período de proservação houve necessidade de reoperação para troca ou retirada do implante permanente ou necessidade de operação de resgate com retalho musculocutâneo.
Os dados foram inseridos para análise estatística em planilhas do software Microsoft Office Excel. A literatura relacionada foi revista e as bases de dados consultadas foram PubMed e LILACS.
Técnica cirúrgica
Define-se o tamanho do implante permanente a ser utilizado, pela avaliação de medidas da mama em consulta pré-operatória, utilizando-se conchas plásticas de volumes pré-determinados (Mamasize®). No intraoperatório, o volume da mama removida é estimulado pelo método de Arquimedes6, com a imersão total da peça cirúrgica em recipiente preenchido com solução salina a 0,9%. A solução extravasada é recolhida num segundo recipiente, localizado imediatamente abaixo do primeiro e medida com precisão, através de aspiração com seringa de 60ml.
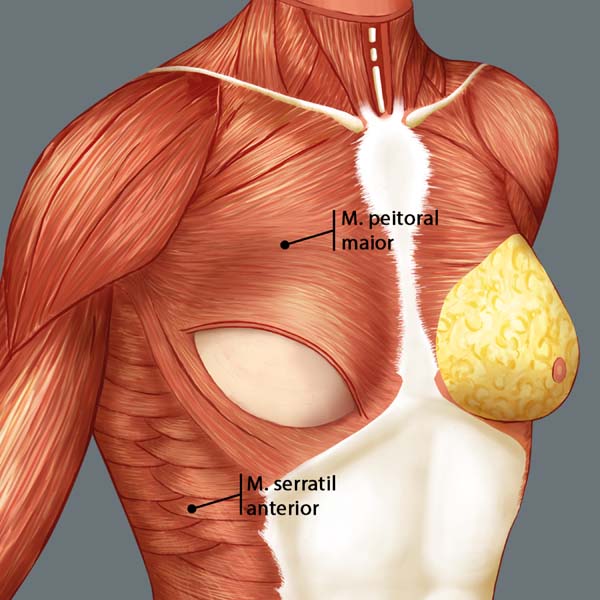
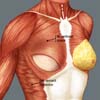
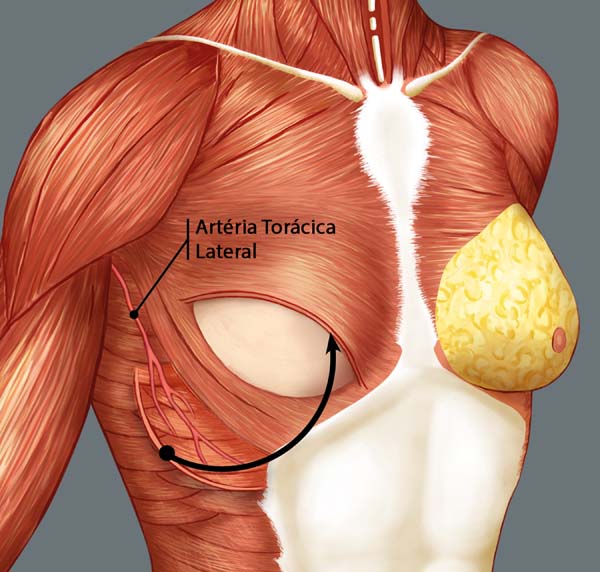
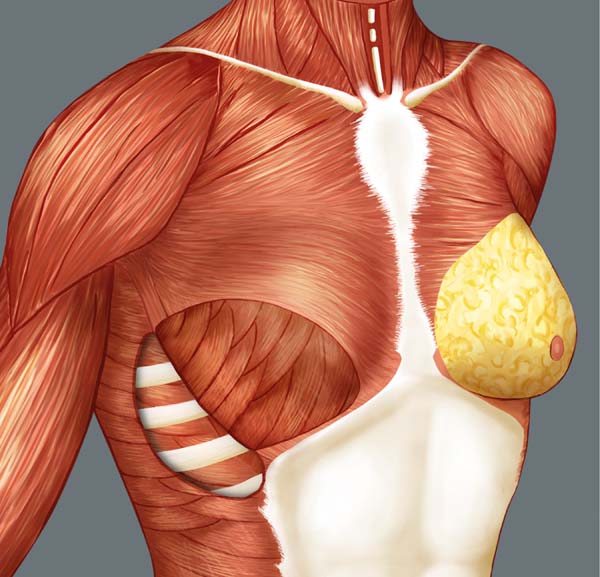
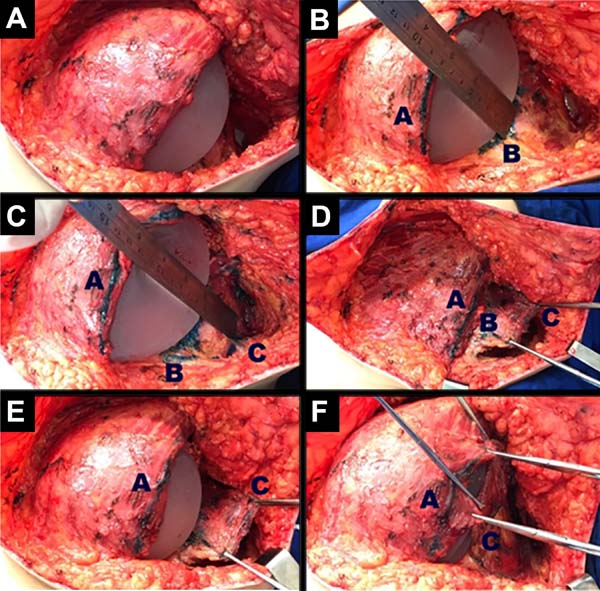
A reconstrução mamária inicia-se com descolamento do músculo peitoral maior, a partir de sua margem lateral, até sua origem esternal, com eletrocautério. Inferiormente, a dissecção avança pelo menos 2cm na bainha do músculo reto do abdome, ultrapassando o sulco inframamário. Acomoda-se o implante permanente escolhido em loja subpeitoral (Figura 1) e realiza-se uma marcação para confecção da bolsa com retalho reverso de músculo serrátil anterior. Define-se como linha A, a margem lateral do peitoral maior; linha B, a base do implante permanente na parede torácica; e, linha C, a transferência da distância entre a linha A e linha B. A largura necessária do retalho reverso do musculo serrátil anterior deverá ser adequada para cobertura muscular inferolateral do material aloplástico (Figura 2). As linhas A e C são aproximadas e suturadas com pontos separados de poliglactina 2 (Vicryl®) representadas nas Figuras 3 e 4. Finaliza-se procedimento com colocação do dreno de sucção e síntese da ferida operatória por planos (Figura 5).
RESULTADOS
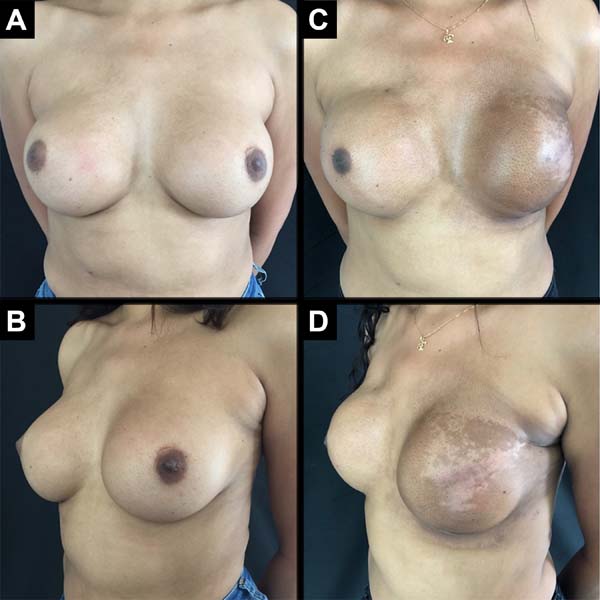
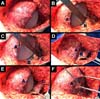
Foram operadas 61 pacientes. Em 13 pacientes, a reconstrução foi bilateral, totalizando 74 mamas reconstruídas imediatamente, pela técnica descrita (Figuras 6 a 8).
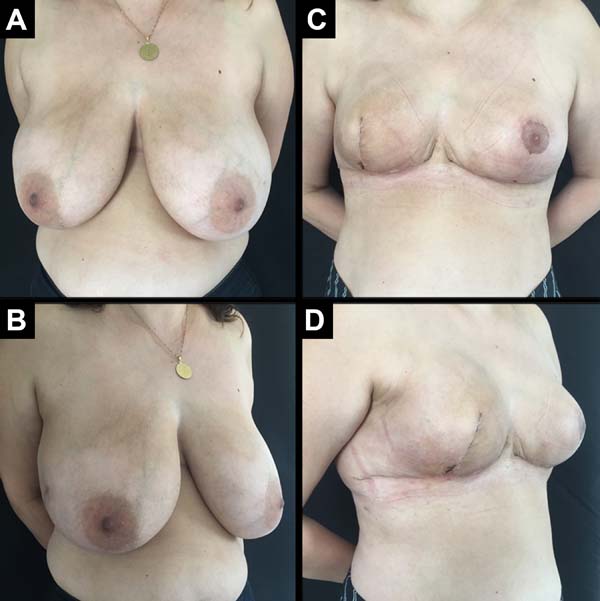
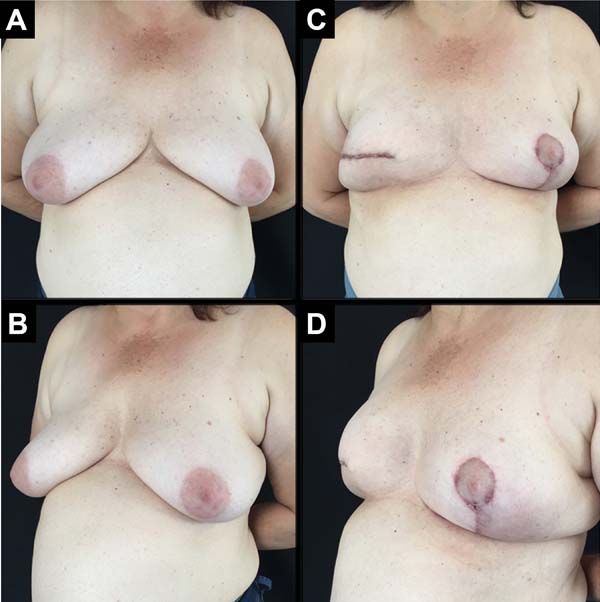
A idade das pacientes variou de 32 a 82 anos, com média de 49,2 anos. O volume dos implantes variou de 200 a 500cc, com volume médio de 344,5ml. O período de internação foi de 24 horas para 46 pacientes (75,4%) e de 48 horas para 15 pacientes (24,6%).
As pacientes foram acompanhadas em pós-operatório por períodos variados, com tempo mínimo de oito meses e máximo de 24 meses, com média de 14,9 meses.
Treze pacientes (21,3%) possuíam história de quimioterapia neoadjuvante como tratamento complementar. Nove pacientes (14,7%) foram submetidas à radioterapia adjuvante e quatro pacientes (6,5%) à quimioterapia adjuvante.
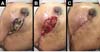
As complicações foram: dois (2,7%) casos de seroma persistente após a retirada de dreno de sucção, tratados com aspiração; cinco (6,75%) casos de hematoma drenados nas primeiras 24 horas de pós-operatório; 2 casos (2,7%) de infecção de ferida operatória tratados com antibioticoterapia oral, ambos com boa evolução. Com relação a necroses: cinco (6,75%) casos tiveram necrose parcial do retalho com boa evolução após tratamento conservador com desbridamento da necrose e manutenção do implante (Figura 9); dois casos (2,7%) apresentaram extrusão do implante e remoção do mesmo, seguido de operação de resgate com retalho do músculo latíssimo do dorso.
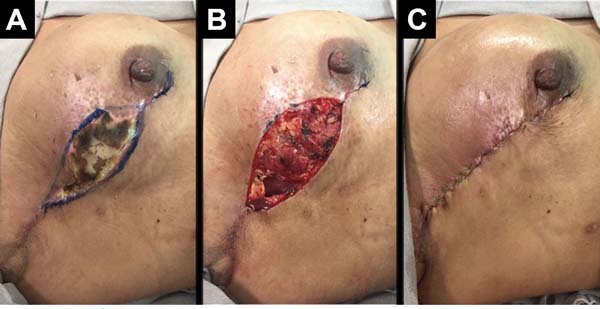
A incidência geral de complicações foi de 18,9% (14 casos). A maioria consistiu de complicações menores e 2,7 % (2 casos) de complicações maiores, em que ocorreram falhas da reconstrução. Não houve queixas de dor intensa e limitações funcionais significativas durante a proservação.
DISCUSSÃO
Com o avanço da oncologia mamária, dos tratamentos complementares e melhoria da triagem, a mastectomia total com a preservação de pele e CAP aumentou suas indicações, aumentando as reconstruções com uso de implantes7,8.
A reconstrução mamária com implantes e a reconstrução imediata aumentou respectivamente 11% e 5% ao ano. A indicação de realizá-la ou não, e a escolha da técnica são decisões individuais que devem levar em consideração fatores da equipe médica e da paciente9.
O músculo serrátil anterior apresenta um contorno denteado, muito semelhante à borda da lâmina de uma serra, dando origem ao nome (L., serratus, serra). Situa-se na parte lateroposterior do tórax com origem nas partes laterais da primeira à décima costelas. Suas fibras cursam posteriormente para se fixarem na face anterior da margem medial da escápula, incluindo seu ângulo inferior. Apresenta três porções: a primeira consiste em fibras musculares da 1ª e 2ª costelas; a segunda porção da 2ª a 4ª costelas; e, a terceira porção da 5ª a 10ª costelas. A ação principal do músculo é protrair e rodar a escápula e mantê-la contra a parede torácica10,11.
Sua inervação principal é pelo nervo torácico longo (nervo de Bell), que se origina das raízes nervosas espinhas (C5 a C7). Inicia-se seu trajeto superiormente anteromedial, passa pelo oblíquo até cruzar o pedículo vascular. Em todo o percurso, o tronco principal do nervo emite vários ramos. Com isso, em dissecções do músculo serrátil anterior, pode-se obter longos retalhos preservando-se a inervação do músculo remanescente. Com isso evita-se a formação da escápula alada11,12.
O retalho do musculo serrátil anterior é classificado como grupo III de Mathes e Nahai, em 199713, com uma rica vascularização pelos pedículos vasculares dominantes (ramos da artéria torácica lateral e artéria toracodorsal). Apresenta também vascularização colateral pelos ramos perfurantes laterais das artérias intercostais, que são amplamente anastomosados com ramificações da artéria toracodorsal e formam uma importante e constante fonte de nutrição arterial13,14.
O uso do músculo serrátil anterior na cirurgia reconstrutora é amplamente descrito na literatura. É utilizado como retalho livre, retalho muscular pediculado ou miofasciocutâneo15-17. A técnica cirúrgica proposta do retalho reverso de músculo serrátil anterior pode contribuir para evolução e melhoria na reconstrução mamária com implante.
Na reconstrução mamária imediata com retalhos musculares regionais mais usuais, o implante definitivo permanece recoberto pelo músculo peitoral geralmente nos dois terços superiores. O terço inferior e lateral fica desprotegido. O retalho reverso do músculo serrátil anterior permite, na maioria dos casos, cobertura muscular completa do implante. Em alguns casos pode-se levar em conjunto com o serrátil parte do musculo oblíquo externo para melhor cobertura do implante18. A completa cobertura da prótese é importante nos casos de retalhos cutâneos finos. A técnica proposta, recria a prega lateral, propiciando contenção do implante e resultados estéticos satisfatórios.
Em relação à mastectomia poupadora de pele ou CAP, a possibilidade de necrose da pele é sempre uma preocupação e varia na literatura com taxas de zero a 21,6%19-21. A cobertura muscular do implante, especialmente em retalhos cutâneos finos, diminui a tensão exercida sobre a pele. O implante se torna menos perceptível à palpação e, em casos de deiscência da ferida operatória ou pequenas necroses de pele não ocorre extrusão.
Um posicionamento submuscular completo do implante pode causar sua elevação no polo superior da mama reconstruída, com deslocamento para cima do sulco inframamário22. Por esse motivo, a dissecção na técnica apresentada avança pelo menos 2cm na bainha do músculo reto abdominal, ultrapassando o sulco inframamário.
Tanto o retalho muscular proposto como a matriz dérmica acelular (MDA) têm por objetivo o suporte da parte inferolateral na reconstrução mamária imediata e cobertura total do implante. As vantagens do MDA estão relacionadas a um tempo de operação curto e fácil técnica cirúrgica. Por outro lado, o custo é significativamente mais elevado23-25.
Uma metanálise recente sugere que a MDA tem uma maior taxa de complicações que a reconstrução submuscular, como: infecção e seroma26.
A reconstrução da mama com o uso de expansores salinos apresenta algumas desvantagens, incluindo múltiplos retornos para expansão gradual, dor após a expansão e a necessidade de uma segunda operação para a troca por implante definitivo, com aumento dos custos27,28.
Nesta casuística não ocorreram sequelas funcionais importantes, como escápula alada. A emissão de múltiplos ramos pelo nervo torácico longo permite uma inervação efetiva do músculo serrátil anterior remanescente. A porção superior do músculo serrátil anterior, poupada durante a confecção do retalho, aliado à ação do trapézio promovem a estabilização da escapula.
Todos os pacientes foram acompanhadas pela equipe de Fisioterapia Especializada da Clínica de Oncologia da mesma Instituição.
Treze pacientes (21,3%) foram submetidas à quimioterapia neoadjuvante. As evidências científicas atualmente disponíveis afirmam que a reconstrução mamária imediata é segura neste grupo de pacientes e estatisticamente não há aumento significativo no número de complicações pós-operatórias29,30. Em todos os pacientes a operação foi realizada, pelo menos 15 dias após o término da terapia complementar.
O tratamento adjuvante com radioterapia é uma prática cada vez mais indicada no câncer de mama. Tem seus efeitos oncológicos benéficos, mas os danos colaterais à parede torácica e à qualidade da pele da mama afeta negativamente a reconstrução mamária, com taxas relativamente altas de complicações31. Estudo recente sobre a morbidade pós-operatória associado à radioterapia em reconstrução com implantes mostram taxas de complicações de 45,3% e falha de reconstrução de 29,4%32. O presente estudo apresentou incidência de complicações abaixo da literatura: 18,9% de complicações gerais e 2,7% de falha da reconstrução. As pacientes devem ser aconselhadas adequadamente sobre essas possíveis complicações para que possam ser tomadas decisões compartilhadas.
Nove pacientes (14,7%) foram submetidas à radioterapia adjuvante, não sendo identificada contratura capsular graus III e IV de Baker33. Seguimento em longo prazo desse grupo de pacientes e a inclusão de mais pacientes submetidas à radioterapia adjuvante podem aumentar a incidência dessa complicação.
Apesar das muitas vantagens, o estudo incluiu um tamanho de amostra relativamente pequeno e um curto período de acompanhamento. Aumentando o número de pacientes e segui-los por um período mais longo pode fornecer informações mais valiosas. Em pacientes com necessidade de grandes volumes de implantes que apresentem um tecido muscular menos desenvolvido, pode haver dificuldade para cobertura total do implante, mas não torna impeditiva a realização da técnica.
CONCLUSÃO
O retalho muscular serrátil anterior reverso é uma abordagem útil na reconstrução mamária imediata com implante.
COLABORAÇÕES
|
ACMA |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Coleta de Dados, Concepção e desenho do estudo, Gerenciamento do Projeto, Metodologia, Realização das operações e/ou experimentos, Redação - Preparação do original, Redação - Revisão e Edição, Supervisão |
|
AFSF |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Conceitualização, Concepção e desenho do estudo, Gerenciamento do Projeto, Investigação, Metodologia, Realização das operações e/ou experimentos, Redação - Preparação do original, Redação - Revisão e Edição, Supervisão, Validação |
|
RSR |
Análise e/ou interpretação dos dados, Análise estatística, Aprovação final do manuscrito, Coleta de Dados, Investigação, Redação - Preparação do original, Redação - Revisão e Edição |
|
NAP |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Realização das operações e/ou experimentos, Redação - Preparação do original, Redação - Revisão e Edição, Validação, Visualização |
|
RPLF |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Realização das operações e/ou experimentos, Redação - Revisão e Edição, Validação, Visualização |
|
EHP |
Análise e/ou interpretação dos dados, Análise estatística, Aprovação final do manuscrito, Realização das operações e/ou experimentos, Redação - Preparação do original, Redação - Revisão e Edição, Validação, Visualização |
|
RSOF |
Aprovação final do manuscrito, Redação - Revisão e Edição, Validação, Visualização |
|
JCRRA |
Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Redação - Revisão e Edição, Supervisão, Validação, Visualização |
REFERÊNCIAS
1. Dean C, Chetty U, Forrest AP. Effects of immediate breast reconstruction on psychosocial morbidity after mastectomy. Lancet. 1983;26(1):459-62.
2. Stevens LA, McGrath MH, Druss RG, Kister SJ, Gump FE, Forde KA. The psychological impact of immediate breast reconstruction for women with early breast cancer. Plast Reconstr Surg. 1984;73(4):619-28.
3. Cemal Y, Albornoz CR, Disa JJ, McCarthy CM, Mehrara BJ, Pusic AL, et al. A paradigm shift in U.S. breast reconstruction: Part 2. The influence of changing mastectomy patterns on reconstructive rate and method. Plast Reconstr Surg. 2013;131(3):320-6.
4. Hoppenfeld S. Propedêutica ortopédica: coluna e extremidades. Rio de Janeiro: Atheneu; 1996.
5. Mastrella AS, Freitas Junior R, Paulinelli RR, Soares LR. Escapula alada pós-linfadenectomia no tratamento do câncer de mama. Rev Bras Cancerol. 2009;55(4):397-404.
6. Webster R, Machado DP, Milani A, Ely PB. Aperfeiçoando a mensuração do volume mamário na reconstrução imediata com expansores permanentes. Rev Bras Cir Plást. 2013;28(1):72-7.
7. Isken T, Onyedi M, Izmirli H, Alagoz S, Katz R. Abdominal fascial flaps for providing total implant coverage in one-stage breast reconstruction: an autologous solution. Aesthetic Plast Surg. 2009;33(6):853-8.
8. Roostaeian J, Pavone L, Da Lio A, Lipa J, Festekjian J, Crisera C. Immediate placement of implants in breast reconstruction: patient selection and outcomes. Plast Reconstr Surg. 2011;127(4):1407-16.
9. Albornoz CR, Bach PB, Mehrara BJ, Disa JJ, Pusic AL, McCarthy CM, et al. A paradigm shift in U.S. breast reconstruction: increasing implant rates. Plast Reconstr Surg. 2013;131(1):15-23.
10. Cuadros CL, Driscoll CL, Rothkopf DM. The anatomy of the lower serratus anterior muscle: a fresh cadaver study. Plast Reconstr Surg. 1995;95(1):93-7.
11. Vu P, Guedon C, Gehanno P, Andreassian B. Anatomic basis of serratus anterior muscle flap transposition. Surg Radiol Anatom. 1988;10(3):173-85.
12. Moore KL, Dalley AF. Anatomia orientada para a clínica. 5ª ed. Rio de Janeiro: Guanabara Koogan; 2007.
13. Mathes SJ, Nahai F. Reconstructive surgery: principles, anatomy, and technique. New York: Churchill Livingstone; 1997.
14. Yii NW, Cronin K. Vascular anatomy of the serratus anterior muscle. Plast Reconstr Surg. 2005;116(2):680-2.
15. Takayanagi S, Tsukie T. Free serratus anterior muscle and myocutaneous flaps. Ann Plast Surg. 1982;8(4):277-83.
16. Arnold PG, Pairolero PC, Waldorf JC. The serratus anterior muscle: intrathoracic and extrathoracic utilization. Plast Reconstr Surg. 1984;73(2):240-8.
17. Inoue T, Ueda K, Hatoko M, Harashina T. The pedicled extended serratus anterior myocutaneous flap for head and neck reconstruction. Br J Plast Surg. 1991;44(4):259- 65.
18. Tostes ROG, Andrade Júnior JCCG, Silva KDA, Couto AO, Ribeiro GVC, Avelar LET. Reconstrução imediata de mama com prótese de silicone retromuscular: padronização de retalhos musculares. Rev Bras Cir Plást. 2005;20(4):213-9.
19. Carlson GW, Bostwick J, Styblo TM, Moore B, Bried JT, Murray DR, et al. Skin-sparing mastectomy. Oncologic and reconstructive considerations. Ann Surg. 1997;225(5):570-5.
20. Mosahebi A, Ramakrishnan V, Gittos M, Collier DS. Envelope mastectomy and immediate reconstruction (EMIR), improving outcome without oncological compromise. J Plast Reconstr Aesthet Surg. 2006;59(10):1025-30.
21. Toth BA, Forley BG, Calabria R. Retrospective study of the skin-sparing mastectomy in breast reconstruction. Plast Reconstr Surg. 1999;104(1):77-84.
22. Isken T, Onyedi M, Izmirli H, Alagoz S, Katz R. Abdominal fascial flaps for providing total implant coverage in one-stage breast reconstruction: an autologous solution. Aesthetic Plast Surg. 2009;33(6):853-8.
23. Salzberg CA, Dunavant C, Nocera N. Immediate breast reconstruction using porcine acellular dermal matrix (StratticeTM): long-term outcomes and complications. J Plast Reconstr Aesthet Surg. 2013;66(3):323-8.
24. Nguyen TJ, Carey JN, Wong AK. Use of human acellular dermal matrix in implant-based breast reconstruction: evaluating the evidence. J Plast Reconstr Aesthet Surg. 2011;64(12):1553-61.
25. Vardanian AJ, Clayton JL, Roostaeian J, Shirvanian V, Da Lio A, Lipa JE, et al. Comparison of implant bases immediate breast reconstruction with and without acellular dermal matrix. Plast Reconstr Surg. 2011;128(5):403e-10e.
26. Kim JY, Davila AA, Persing S, Connor CM, Jovanovic B, Khan SA, et al. A meta-analysis of human cellular dermis and submuscular tissue expander breast reconstruction. Plast Reconstr Surg. 2012;129(1):28-41.
27. Bordoni D, Cadenelli P, Rocco N, Tessone A, Falco G, Magalotti C. Serratus anterior fascia flap versus muscular flap for expander coverage in two-stage breast reconstruction following mastectomy: early post-operative outcomes. Aesthetic Plast Surg. 2017;41(1):26-30.
28. Roostaeian J, Sanchez I, Vardanian A, Herrera F, Galanis C, Da Lio A, et al. Comparison of immediate implant placement versus the staged tissue expander technique in breast reconstruction. Plast Reconstr Surg. 2012;129(6):909e-18e.
29. Cassidy MR, Zabor EC, Stempel M, Mehrara B, Gemignani ML. Does response to neo-adjuvant chemotherapy impact breast reconstruction?. Breast J. 2018;24(4):567-73.
30. Bowen ME, Mone MC, Buys SS, Sheng X, Nelson EW. Surgical outcomes for mastectomy patients receiving neoadjuvant chemotherapy: a propensity-matched analysis. Ann Surg. 2017;265(3):448-56.
31. Momoh AO, Ahmed R, Kelley BP, Aliu O, Kidwell KM, Kozlow JH, et al. A systematic review of complications of implant-based breast reconstruction with prereconstruction and postreconstruction radiotherapy. Ann Surg Oncol. 2014;21(1):118-24.
32. Chetta MD, Aliu O, Zhong L, Sears ED, Waljee JF, Chung KC, et al. Reconstruction of the irradiated breast: a national claims-based assessment of postoperative morbidity. Plast Reconstr Surg. 2017;139(4):783-92.
33. Baker Junior JL, Chandler ML, LeVier RR. Occurrence and activity of myofibroblasts in human capsular tissue surrounding mammary implants. Plast Reconstr Surg. 1981;68(6):905-12.
1. Hospital Felício Rocho, Belo Horizonte, MG, Brasil.
2. Instituto de Cirurgia Plástica Avançada, Belo Horizonte, MG, Brasil.
3. Sociedade Brasileira de Cirurgia Plástica, São Paulo, SP, Brasil.
4. Universidade Federal de São Paulo, São Paulo, SP Brasil.
Autor correspondente: Augusto César de Melo Almeida Rua Santa Catarina, 996/701, Lourdes, Belo Horizonte, MG, Brasil. CEP: 30170084. E-mail: contato@draugustoalmeida.com.br
Artigo submetido: 17/6/2019.
Artigo aceito: 21/10/2019.
Conflitos de interesse: não há.






 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter