
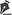
Original Article - Year 2022 - Volume 37 -
Pioderma gangrenoso: atualização e orientação
Pyoderma gangrenosum: update and guidance
RESUMO
Introdução: O pioderma gangrenoso (PG) é uma doença neutrofílica, rara, porém de consequências danosas. O Capítulo de Feridas da Sociedade Brasileira de Cirurgia Plástica (SBCP) foi instado a compilar as melhores práticas, tanto diagnósticas como terapêuticas, junto às Sociedades Brasileiras de Dermatologia e Reumatologia para um melhor esclarecimento dos seus membros.
Métodos: Ampla revisão de artigos publicados na literatura médica e compilação das novas diretrizes de diagnóstico e tratamento por dois membros indicados por cada uma das Sociedades Brasileiras de Cirurgia Plástica, Dermatologia e Reumatologia.
Resultados: O PG deixou de ser uma doença de exclusão, tendo os critérios diagnósticos bem definidos e a orientação terapêutica delineada pelos autores, incluindo o uso de terapia biológica.
Conclusão: O PG permanece desafiador, mas sistematizar a investigação e o uso dos novos medicamentos, bem como o manejo das feridas, abre novas perspectivas, interferindo na fisiopatologia de modo positivo, com maior precocidade e menos efeitos colaterais do que a terapia imunossupressora de forma isolada.
Palavras-chave: Pioderma gangrenoso; Pioderma; Dermatopatias; Autoimunidade; Neutrófilos; Sociedades médicas.
ABSTRACT
Introduction: The pyoderma gangrenosum (PG) is a neutrophilic disease, rare but with a poor outcome. The Capitulum of Wound treatment of the Brazilian Society of Plastic Surgery (SBCP) promoted a discussion with the Brazilian societies of Dermatology and Rheumatology to extract the best procedures in diagnostic and treatment.
Methods: Broad review of published articles related to the subject and compilation of guidelines of diagnostic and treatment by two advisors of each involved society, plastic surgery, dermatology and rheumatology.
Results: The PG is not an exclusion disease anymore, with well defined criteria for its diagnostic and literature based treatment, refined by the authors, including the use of biological therapies.
Conclusion: The PG remains challenging, but systematizing the investigation and the use of new drugs has opened a new horizon of treatments, interfering in the pathophysiology in a positive manner with fewer side effects than immunosuppressive therapy alone.
Keywords: Pyoderma gangrenosum; Pyoderma; Skin diseases; Autoimmunity; Neutrophils; Societies, medical.
INTRODUÇÃO
Pioderma gangrenoso e o espectro das dermatoses neutrofílicas
O pioderma gangrenoso (PG) pertence a um grupo de condições caracterizadas por manifestações cutâneas polimorfas que incluem pústulas, bolhas, abscessos, pápulas, nódulos, placas e úlceras, cujo substrato histopatológico mostra intenso infiltrado inflamatório com predominância de neutrófilos, sendo por isso denominadas dermatoses neutrofílicas1. Em razão da possível ocorrência de manifestações extracutâneas e infiltração neutrofílica em diferentes órgãos e sistemas, seriam mais adequadamente definidas como doenças neutrofílicas2.
Além do PG, as doenças neutrofílicas compreendem a dermatose neutrofílica aguda febril (síndrome de Sweet), o eritema elevado diuturno, a hidradenite écrina neutrofílica, a dermatose pustulosa subcórnea, o pênfigo por IgA, a pustulose amicrobiana das dobras e a doença de Behçet, entre outras1,3. Em geral, essas doenças se manifestam isoladamente, porém não é de surpreender que alguns desses quadros, eventualmente, ocorram concomitantemente ou sequencialmente, considerando que compartilham o mesmo tipo de infiltrado inflamatório e costumam estar associados às mesmas doenças sistêmicas4.
Há ainda a possível associação com várias condições sistêmicas, como doenças inflamatórias intestinais, doenças hematológicas, doenças reumatológicas, infecções de vias aéreas superiores e do trato gastrointestinal e reações medicamentosas. As doenças neutrofílicas compartilham peculiaridades clínicas e anatomopatológicas com as chamadas doenças autoinflamatórias, caracterizadas por episódios recorrentes de inflamação nos órgãos afetados, na ausência de infecção, alergia ou autoimunidade1,3.
Patergia
O fenômeno da patergia refere-se a uma condição de reatividade tecidual exagerada que ocorre em resposta a mínimos traumas e leva ao surgimento de novas lesões ou agravamento de lesões prévias. É mais comumente observado no pioderma gangrenoso e eventualmente na síndrome de Sweet. Geralmente, a patergia é provocada por biópsias, injeções, venopunturas, acessos vasculares, desbridamentos cirúrgicos e cirurgias diversas, mas traumas menores causados por escoriações, picadas de insetos e remoção de adesivos da pele também podem desencadear reações de patergia5.
Esse fenômeno também é observado e utilizado no diagnóstico da doença de Behçet por meio de injúria cutânea provocada com agulha, o chamado teste da patergia6.
Ainda que não seja conhecido o mecanismo preciso desse fenômeno, admite-se que a resposta inflamatória anormal desencadeada pela injúria tecidual seja decorrente da liberação exagerada de citocinas pró-inflamatórias e quimiocinas pelos ceratinócitos e por outras células presentes na epiderme e derme, resultando em intenso infiltrado inflamatório perivascular de polimorfonucleares, observado ao exame histopatológico7.
Epidemiologia
O PG é raro, com prevalência estimada de 58 casos/1 milhão de adultos, na população estadunidense, e incidência de 6,3 casos/1 milhão de indivíduos/ano, de acordo com estudo britânico8,9.
A doença é ainda mais rara em crianças, acomete indivíduos principalmente ao redor dos 50 anos de idade, com leve predominância do sexo feminino, sendo de 44,6 anos (±19,7) a média de idade de instalação da doença10,11.
Também é maior a mortalidade em pacientes de PG, com risco três vezes maior quando comparados a controles pareados por sexo e idade9. No entanto, faltam estudos para entender a razão dessa mortalidade aumentada e quanto ela poderia ser atribuída a comorbidades associadas, imunossupressão, infecções e eventos iatrogênicos12.
Uma enquete realizada na Alemanha com especialistas em tratamento de feridas, que incluiu 31.619 pacientes com úlceras crônicas de perna, demonstrou que o PG respondia por 3% do total de casos13.
Quadro clínico
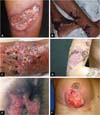
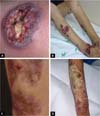
A forma clássica e predominante de PG se inicia com pápula eritematosa ou pústula que evolui com ulceração dolorosa de progressão rápida, com características típicas, de bordas violáceas descoladas e com eritema ao redor. A úlcera pode atingir grandes dimensões e aprofundar-se até o tecido subcutâneo, menos frequentemente atingindo a fáscia e expondo músculos e tendões. O leito da úlcera pode ser exsudativo, purulento, necrótico ou apresentar exuberante tecido de granulação. As úlceras geralmente surgem em áreas de trauma, mais frequentemente nos membros inferiores, são solitárias ou múltiplas, podendo confluir, e tendem a resolver com cicatrizes atróficas do tipo “papel de cigarro” ou cribriformes.
A forma clássica do PG pode estar associada a doença inflamatória intestinal, a malignidades hematológicas, artropatias inflamatórias e gamopatias monoclonais. Os tipos sindrômicos de PG relacionados às doenças autoinflamatórias também se manifestam com a forma ulcerosa da doença14-16. Além da apresentação clássica de PG, temos outras formas que se fazem necessárias conhecer (Quadro 1 e Figuras 1 e 2)1.
| Variante | Apresentação clínica | Locais comuns | Doenças sistêmicas associadas |
|---|---|---|---|
| Ulcerativa | Pústulas ou nódulos inflamatórios que rapidamente evoluem para úlceras necróticas com bordas subminadas violáceas com eritema circundante | Locais de trauma | Doença inflamatória intestinal Malignidades hematológicas Artrite reumatoide Artrite soronegativa Gamopatia monoclonal |
| Face anterior dos membros inferiores | |||
| Bolhosa | Bolha dolorosa que pode evoluir para erosão e/ou úlcera de evolução rápida | Face | Desordens mieloproliferativas ex. leucemia mieloide aguda, doença inflamatória intestinal |
| Membros superiores e inferiores | |||
| Pustulosa | Pústulas com bordas eritematosas e simétricas | Membros inferiores | Doença inflamatória intestinal |
| Tronco | |||
| Vegetativa | Variante menos dolorosa | Tronco | Nenhum inflamatória intestinal |
| Crescimento lento | |||
| Não purulento | |||
| Úlcera superficial única, bordas não subminadas e menos violáceas | |||
| Responde rapidamente à terapêutica | |||
| Periostomal | Pápulas que evoluem em úlceras com bordas subminadas | Imediatamente adjacente ao estoma | Malignidade entérica |
| Difícil distinguir de outras lesões erosivas periostomais | Doença do tecido conectivo Gamopatia monoclonal | ||
| Pós-operatório | Eritema no sítio cirúrgico seguido de úlcera por decência OU ulcerações que coalescem | Sítio cirúrgico | Comumente associado às cirurgias de tórax e abdômen |
| Dor desproporcionalmente aumentada |
PAPA - pyogenic arthritis, pyoderma gangrenosum , acne; PAPASH - pyogenic arthritis, pyoderma gangrenosum, acne e hidradenitis suppurativa; PASH - pyoderma gangrenosum, acne , hidradenitis suppurativa; PG - Pioderma gangrenoso; SAPHO - synovitis, acne, pustulosis, hyperostosis e osteitis; PASS - pyoderma gangrenosum, acne conglobata, suppurative hidradenitis e axial spondyloarthritis; PsAPASH - pyoderma gangrenosum, acne, suppurative hidradenitis e psoriatic arthritis.
O PG pode evoluir com instalação abrupta e rápida progressão das lesões, quando costuma apresentar dor intensa e manifestações gerais de febre, adinamia, mialgias e artralgias, ou seguir um curso indolente, com progressão gradual das lesões, geralmente sem apresentar manifestações gerais. Linfangite e linfadenite geralmente não estão presentes17.
Raramente, alguns pacientes podem apresentar infiltração neutrofílica extracutânea, assintomática ou acompanhada de manifestações clínicas, a depender do órgão afetado. Pode ocorrer tanto em pacientes com comorbidades hematológicas, intestinais ou reumáticas quanto naqueles sem doença sistêmica associada. Manifestações extracutâneas são mais comuns em pulmões e olhos, menos comuns em rins, baço e ossos, e mais raras em músculos, mucosas (bucal, língua, faringe, laringe e genitália)4, no sistema nervoso central, no sistema cardiovascular e no trato gastrointestinal18.
Associações clínicas
Doenças sistêmicas são frequentemente observadas em pacientes com PG, mas a frequência é bem variável nas diferentes séries publicadas na literatura (33-78%)9,11,19-21. Em revisão sistemática da literatura e em estudo multicêntrico que avaliou grande número de pacientes com PG, as principais doenças sistêmicas associadas ao PG foram doença inflamatória intestinal, artropatias inflamatórias, tumores sólidos e doenças hematológicas malignas e não malignas (Quadro 2)21,22. Em grande estudo que avaliou PG em 56.097 pacientes com doença inflamatória intestinal, a frequência de PG foi de 0,5% e esta manifestação foi mais frequentemente associada à doença de Crohn em comparação à retocolite ulcerativa23. O PG pode ocorrer de forma concomitante ao diagnóstico da doença sistêmica ou pode ocorrer de forma independente da atividade da doença associada24.
| Grupos | Frequência | Doenças |
|---|---|---|
| Doença inflamatória intestinal | 41,0% | Doença de Crohn |
| Retocolite ulcerativa | ||
| Artrite reumatóide | ||
| Artropatias inflamatórias | 20,5% | Artropatia enteropática |
| Artrite psoriásica | ||
| Espondilite anquilosante | ||
| Artrite não especificada | ||
| Neoplasias hematológicas | 5,9% | Linfoma não Hodgkin |
| Leucemia mieloide aguda | ||
| Leucemia mielomonocítica crônica | ||
| Leucemia linfocítica de grandes células granulares | ||
| Doenças hematológicas não malignas | 4,8% | Mielofibrose |
| Síndrome mielodisplásica | ||
| Gamopatia monoclonal de origem indeterminada | ||
| Policitemia vera | ||
| Neoplasias de órgãos sólidos | 6,5% | -- |
O PG pode ocorrer ainda como manifestação de diferentes síndromes autoinflamatórias, também referidas como síndromes relacionadas às dermatites neutrofílicas. Essas síndromes autoinflamatórias monogênicas apresentam PG como parte de suas manifestações clínicas e, também, variantes em genes classicamente autoinflamatórios são observadas em pacientes com dermatites neutrofílicas, o que chama a atenção para essa manifestação clínica, como parte do espectro de condições autoinflamatórias poligênicas16. O Quadro 3 descreve as principais síndromes autoinflamatórias associadas às manifestações de PG, manifestações clínicas e os genes relacionados. Na maioria das síndromes há mutação do gene PSTPIP1 que codifica a proteína ligante do CD2, o que leva à menor inibição do inflamossoma, com maior produção de IL-1 e IL-18 e a ativação neutrofílica25. A associação ao PG é observada em duas outras síndromes: a síndrome PASS (pyoderma gangrenosum, acne conglobata, suppurative hidradenitis e axial spondyloarthritis) e a síndrome PsAPASH (pyoderma gangrenosum, acne, suppurative hidradenitis e psoriatic arthritis), mas não há variantes genéticas conhecidas em associação26.
| Síndromes autoinflamatórias | Principais manifestações clínicas | Genes |
|---|---|---|
| Síndrome PAPA | PG, acne e artrite piogênica estéril | PSTPIP1 |
| Síndrome PASH | PG, acne e hidradenite supurativa | MEFV, NOD2, NLRP3, PSMB8, NCSTN |
| Síndrome PAPASH | Artrite piogênica, PG, acne e hidradenite supurativa | PSTPIP1, IL1RN, MEFV |
| Síndrome SAPHO | Sinovite, acne, pustulose, hiperostose e osteíte | PSTPIP2, LPIN2, NOD2 |
| Síndrome PASS | Espondiloartrite axial, PG, acne conglobata e hidradenite supurativa | -- |
| Síndrome PsAPASH | Artrite psoriática, PG, hidradenite supurativa e acne | -- |
Diagnóstico
O diagnóstico do PG é desafiador e tido como diagnóstico de exclusão, visto que inexistem aspectos clínicos e marcadores laboratoriais específicos da doença. Por conseguinte, todos os diagnósticos diferenciais, a princípio, deveriam ser sistematicamente afastados. É amplo o espectro de condições que merecem ser discriminadas do PG, o que reforça a complexidade do seu diagnóstico e justifica a alta frequência de retardo e erro diagnósticos, geralmente expondo os pacientes a riscos relacionados a tratamentos14,25,27.
O Quadro 4 relaciona os principais diagnósticos diferenciais do PG, em especial da forma clássica. A forma bolhosa deve ser diferenciada, em particular, das dermatoses bolhosas autoimunes, do eritema multiforme e das dermatites disidrosiformes, enquanto a forma pustulosa merece distinção, essencialmente, das piodermites bacterianas, da psoríase pustulosa, da dermatose pustulosa subcórnea e das erupções pustulosas causadas por drogas.
| Infecções | |
|---|---|
| Virais (herpes simples crônico, citomegalovirose) | |
| Bacterianas (ectima, ectima gangrenoso, tuberculose, micobacterioses atípicas, fasciite necrosante) | |
| Parasitárias (amebíase, leishmaniose tegumentar) | |
| Fúngicas (esporotricose, paracoccidioidomicose, criptococose, histoplasmose, aspergilose) | |
| Vasculites e vasculopatias | |
| Doença de Behçet | |
| Vasculites cutâneas e sistêmicas (vasculite leucocitoclásica, granulomatose com poliangiite, poliarterite nodosa) | |
| Vasculopatia livedoide Crioglobulinemia | |
| Síndrome do anticorpo antifosfolípide | |
| Doenças do colágeno (lúpus eritematoso sistêmico, esclerose sistêmica) | |
| Doença vascular oclusiva e doença venosa | |
| Úlcera venosa | |
| Úlcera hipertensiva | |
| Úlcera da doença falciforme | |
| Doença arterial obstrutiva periférica | |
| Úlceras tróficas (neuropáticas) | |
| Neoplasias | |
| Leucemia cutânea | |
| Linfomas cutâneos | |
| Carcinoma basocelular | |
| Carcinomas espinocelular | |
| Miscelânea | |
| Dermatite factícia | |
| Lesões por uso injetável de drogas ilícitas | |
| Halogenoderma | |
| Loxoscelismo | |
| Calcifilaxia | |
Sendo historicamente considerado diagnóstico de exclusão, implicaria que fossem descartadas todas as possíveis causas de úlceras cutâneas, antes de se confirmar o diagnóstico de PG, estratégia impraticável e onerosa na atualidade16. Com o intuito de resolver esse impasse, surgiram propostas de validação de instrumentos diagnósticos de modo a refinar a acurácia diagnóstica. Em 2004, Su et al.28 foram os primeiros a propor um guia de critérios diagnósticos para o PG, mas que mantém a exigência da exclusão de outras causas de ulceração cutânea.
Um instrumento diagnóstico mais completo, proposto por um painel internacional de especialistas, foi resultado de consenso pelo método Delphi e é apresentado no Quadro 5. Esse instrumento pontua igualmente os critérios enquadrados em quatro categorias (histologia, história, exame clínico e resposta terapêutica), e garantiu sensibilidade de 86% e especificidade de 90%, podendo servir de guia diagnóstico aos clínicos, de modo a reduzir a ocorrência de erros diagnósticos e melhorar a seleção de pacientes para ensaios clínicos29.
| Critério maior |
|---|
| Biopsia de borda de úlcera mostrando infiltrado neutrofílico |
| Critérios menores |
| Histologia |
| Exclusão de infecção (colorações especiais e culturas de tecido) |
| História |
| Patergia (ocorrência de úlceras em locais de trauma) |
| História pessoal de doença inflamatória intestinal ou artrite inflamatória História de pápula, pústula ou vesícula com evolução rápida para ulceração |
| Exame físico (ou registro fotográfico) |
| Eritema periférico, borda descolada, hipersensibilidade no local de ulceração Múltiplas úlceras (ao menos uma em região anterior da perna) |
| Cicatriz cribriforme ou “em papel amassado” após resolução das úlceras |
| Tratamento |
| Redução na dimensão da úlcera após um mês de tratamento imunossupressor |
Diagnóstico de PG = critério maior + 4 critérios menores
* Proposto por consenso com o método Delphi (Maverakis et al.29).
Avaliação laboratorial
A primeira providência frente a um caso suspeito de PG é efetuar uma biópsia incisional profunda, da borda da úlcera, incluindo o tecido adiposo. Não sendo possível, deve-se utilizar punch de 4mm para a biópsia. A amostra retirada deve ser dividida em dois fragmentos, um destinado à execução de culturas para bactérias, micobactérias e fungos, e o outro fixado em formol para processamento histológico. Além da hematoxilina-eosina, devem ser feitas colorações especiais para bactérias, micobactérias, fungos e protozoários, como Gram, Fite, PAS e Giemsa, ou correspondentes30.
Os achados histopatológicos não são diagnósticos, no entanto, além de auxiliar na exclusão de diagnósticos diferenciais do PG, costumam ser bastante sugestivos, mostrando edema, intenso infiltrado de neutrófilos, com formação de microabscessos, hemorragia e necrose na derme, que podem se estender à hipoderme, geralmente sem a presença de vasculite e leucocitoclasia. As colorações específicas para micro-organismos resultam negativas no PG15.
Ainda que não haja uma orientação padronizada de avaliação laboratorial dos casos suspeitos de PG, uma série de exames preliminares pode ser recomendada, com o objetivo de descartar potenciais diagnósticos diferenciais, assim como de averiguar a presença de possíveis condições associadas. Podem ser incluídos hemograma, velocidade de hemossedimentação, proteína C reativa, função hepática, função renal, eletroforese das proteínas séricas, crioglobulinas, VDRL, pesquisa de autoanticorpos (antinucleares, anticitoplasmáticos de neutrófilos, antifosfolípides), fator reumatoide, urina rotina e radiografia do tórax16.
Dependendo de eventuais manifestações clínicas associadas ao quadro suspeito de PG, a investigação laboratorial deve ser estendida com a solicitação de exames específicos, que podem incluir ecoDoppler vascular, colonoscopia, imagens radiográficas de articulações afetadas, esfregaço de sangue, mielograma, imunoeletroforese, provas de coagulação, ultrassom abdominal e tomografia do tórax, entre outros. Rastreamento de neoplasias malignas é recomendado de acordo com a idade do paciente, considerando que o PG pode ser manifestação paraneoplásica12,30.
Tratamento
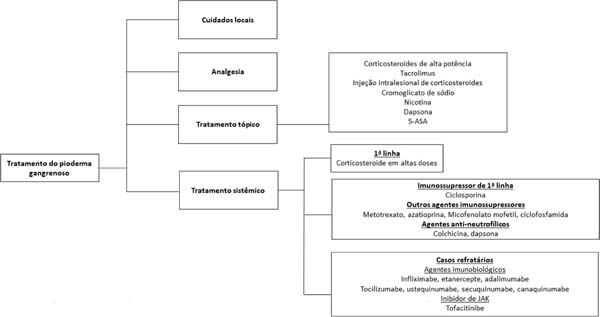
O tratamento do pioderma gangrenoso deve basear-se nas características da lesão (localização, número, tamanho), nas manifestações extracutâneas, de doenças associadas ao pioderma, na presença de comorbidades25, e na gravidade do quadro31. Inclui desde cuidados locais, analgesia, medicamentos tópicos, tratamento sistêmico, agentes imunossupressores, até o uso de agentes imunobiológicos25,31,32 (Figura 3).
O tratamento tópico está indicado nos casos de lesões pequenas ou pioderma localizado25,32, e pode ser feito com corticosteroide tópico de alta potência, injeção intralesional nas bordas ativas da lesão, ou tacrolimus25,31,32. Outras opções para uso tópico incluem cromoglicato de sódio, nicotina, dapsona, e ácido 5-aminosalicílico (5-ASA)25,31.
O tratamento sistêmico deve ser reservado aos casos mais graves, e é realizado com corticosteroide, na dose de 0,5 a 1,0mg/kg/dia de prednisolona ou equivalente, como droga de primeira linha25,31. Pulsoterapia por via endovenosa com metilprednisolona (1g/dia, 2 a 3 dias)25 pode ser prescrita como medida de resposta rápida, em associação com imunossupressores31, tais como metotrexato (2,5-25mg/semana)25, ciclofosfamida (0,5-1,0g/dia)25, azatioprina (50-100mg/2xs dia)25, micofenolato mofetila (1,0-1,5g/2xs dia)25 ou imunoglobulina EV (2,0-3,0g/kg)25.
A ciclosporina (2,5-5,0mg/kg/dia)25 pode ser utilizada isoladamente ou como agente poupador de corticosteroide, especialmente nos casos em que houver a necessidade de tratamento prolongado31. Antibióticos tópico ou sistêmico e agentes antineutrofílicos, como dapsona (100mg/dia) e colchicina (0,5-1,0mg/dia), podem ser benéficos. Os agentes antineutrofílicos apresentam efeitos anti-inflamatórios e profiláticos contra infecção por Pneumocystis jiroveci32.
Vários agentes imunobiológicos têm sido propostos para o tratamento do PG, sendo os agentes antiTNF alfa os mais estudados32. Ben Abdallah et al.33, em uma revisão semissistemática de 222 artigos, incluindo 356 pacientes, demonstraram significativa eficácia destes agentes em indivíduos adultos, sem diferença estatística significativa entre infliximabe, adalimumabe ou etanercepte. As doses preconizadas são: infliximabe, 5mg/kg, EV25; adalimumabe, 40mg a cada duas semanas, SC25; etanercepte, 50mg/semana, SC34.
Outras opções de terapia biológica incluem ustequinumabe (anti-IL 12/IL23)25,35, secuquinumabe (anti-IL 17)35, canaquinumabe (anti-IL 1beta)25,35, anakinra (antagonista do receptor da IL-1)25,35, tocilizumabe (antirreceptor da IL-6)25,35, tofacitinibe e ruloxitinibe (inibidores de JAK)35, e apremilaste (inibidor da fosfodiesterase 4)35.
Com relação ao ferimento, desbridamentos cirúrgicos são contraindicados assim que seja formulada a hipótese diagnóstica. A diferenciação na abordagem é crucial, pois pacientes pós-operatórios quase sempre são conduzidos como infecção de sítio cirúrgico, com uso de antibioticoterapia e manipulação agressiva da ferida, terapêutica inadequada que leva a uma piora nos casos de PG. Os cuidados devem ser centrados no uso de curativos químico-biológicos (alginato de cálcio, hidrogel, entre outros), com a mínima manipulação, dando preferência a curativos de longa duração e não aderentes. Cuidados de rotina com a pele, como higiene, hidratação e relacionados à prevenção de úlceras de pressão devem ser redobrados.
Terapia de pressão negativa pode ser utilizada, bem como a oxigenoterapia hiperbárica pode estar indicada nos intolerantes ou não responsivos à terapêutica com corticosteroides. Nos pacientes com ferimentos crônicos, o uso de matriz dérmica pode e deve ser considerado como uma alternativa para a promoção do fechamento das lesões.
CONCLUSÃO
O pioderma gangrenoso permanece como um desafio tanto em seu diagnóstico quanto tratamento. Os critérios de diagnóstico são importantes ferramentas para sistematizar a investigação de modo lógico e baseado em evidências. Por outro lado, o uso de medicamentos biológicos abriu um novo horizonte de tratamento, conseguindo interferir na fisiopatologia com melhores resultados e menos efeitos colaterais do que a terapia imunossupressora de forma isolada.
REFERÊNCIAS
1. Marzano AV, Borghi A, Wallach D, Cugno M. A Comprehensive Review of Neutrophilic Diseases. Clin Rev Allergy Immunol. 2018;54(1):114-30.
2. Wallach D, Vignon-Pennamen MD. From acute febrile neutrophilic dermatosis to neutrophilic disease: forty years of clinical research. J Am Acad Dermatol. 2006;55(6):1066-71.
3. Prat L, Bouaziz JD, Wallach D, Vignon-Pennamen MD, Bagot M. Neutrophilic dermatoses as systemic diseases. Clin Dermatol. 2014;32(3):376-88.
4. Cohen PR. Neutrophilic dermatoses: a review of current treatment options. Am J Clin Dermatol. 2009;10(5):301-12.
5. Varol A, Seifert O, Anderson CD. The skin pathergy test: innately useful? Arch Dermatol Res. 2010;302(3):155-68.
6. Sequeira FF, Daryani D. The oral and skin pathergy test. Indian J Dermatol Venereol Leprol. 2011;77(4):526-30.
7. Ergun T. Pathergy Phenomenon. Front Med (Lausanne). 2021;8:639404.
8. Xu A, Balgobind A, Strunk A, Garg A, Alloo A. Prevalence estimates for pyoderma gangrenosum in the United States: An age- and sex-adjusted population analysis. J Am Acad Dermatol. 2020;83(2):425-9.
9. Langan SM, Groves RW, Card TR, Gulliford MC. Incidence, mortality, and disease associations of pyoderma gangrenosum in the United Kingdom: a retrospective cohort study. J Invest Dermatol. 2012;132(9):2166-70.
10. Monari P, Moro R, Motolese A, Misciali C, Baraldi C, Fanti PA, et al. Epidemiology of pyoderma gangrenosum: Results from an Italian prospective multicentre study. Int Wound J. 2018;15(6):875-9.
11. Bennett ML, Jackson JM, Jorizzo JL, Fleischer AB Jr, White WL, Callen JP. Pyoderma gangrenosum. A comparison of typical and atypical forms with an emphasis on time to remission. Case review of 86 patients from 2 institutions. Medicine (Baltimore). 2000;79(1):37-46.
12. Gupta AS, Ortega-Loayza AG. Pyoderma gangrenosum: a too often overlooked facultative paraneoplastic disease. Ann Hematol. 2019;98(9):2247-8.
13. Körber A, Klode J, Al-Benna S, Wax C, Schadendorf D, Steinstraesser L, et al. Etiology of chronic leg ulcers in 31,619 patients in Germany analyzed by an expert survey. J Dtsch Dermatol Ges. 2011;9(2):116-21.
14. Ahronowitz I, Harp J, Shinkai K. Etiology and management of pyoderma gangrenosum: a comprehensive review. Am J Clin Dermatol. 2012;13(3):191-211.
15. Wallach D, Vignon-Pennamen MD. Pyoderma gangrenosum and Sweet syndrome: the prototypic neutrophilic dermatoses. Br J Dermatol. 2018;178(3):595-602.
16. Maverakis E, Marzano AV, Le ST, Callen JP, Brüggen MC, Guenova E, et al. Pyoderma gangrenosum. Nat Rev Dis Primers. 2020;6(1):81.
17. Ruocco E, Sangiuliano S, Gravina AG, Miranda A, Nicoletti G. Pyoderma gangrenosum: an updated review. J Eur Acad Dermatol Venereol. 2009;23(9):1008-17.
18. Borda LJ, Wong LL, Marzano AV, Ortega-Loayza AG. Extracutaneous involvement of pyoderma gangrenosum. Arch Dermatol Res. 2019;311(6):425-34.
19. Binus AM, Qureshi AA, Li VW, Winterfield LS. Pyoderma gangrenosum: a retrospective review of patient characteristics, comorbidities and therapy in 103 patients. Br J Dermatol. 2011;165(6):1244-50. DOI: 10.1111/j.1365-2133.2011.10565.x
20. von den Driesch P. Pyoderma gangrenosum: a report of 44 cases with follow-up. Br J Dermatol. 1997;137(6):1000-5.
21. Ashchyan HJ, Butler DC, Nelson CA, Noe MH, Tsiaras WG, Lockwood SJ, et al. The Association of Age With Clinical Presentation and Comorbidities of Pyoderma Gangrenosum. JAMA Dermatol. 2018;154(4):409-13. DOI: 10.1001/jamadermatol.2017.5978
22. DeFilippis EM, Feldman SR, Huang WW. The genetics of pyoderma gangrenosum and implications for treatment: a systematic review. Br J Dermatol. 2015;172(6):1487-97. DOI: 10.1111/bjd.13493
23. Card TR, Langan SM, Chu TP. Extra-Gastrointestinal Manifestations of Inflammatory Bowel Disease May Be Less Common Than Previously Reported. Dig Dis Sci. 2016;61(9):2619-26. DOI: 10.1007/s10620-016-4195-1
24. Callen JP, Jackson JM. Pyoderma gangrenosum: an update. Rheum Dis Clin North Am. 2007;33(4):787-802, vi. DOI: 10.1016/j.rdc.2007.07.016
25. Alavi A, French LE, Davis MD, Brassard A, Kirsner RS. Pyoderma Gangrenosum: An Update on Pathophysiology, Diagnosis and Treatment. Am J Clin Dermatol. 2017;18(3):355-72. DOI: 10.1007/s40257-017-0251-7
26. Saternus R, Schwingel J, Müller CSL, Vogt T, Reichrath J. Ancient friends, revisited: Systematic review and case report of pyoderma gangrenosum-associated autoinflammatory syndromes. J Transl Autoimmun. 2020;3:100071. DOI: 10.1016/j.jtauto.2020.100071
27. Weenig RH, Davis MD, Dahl PR, Su WP. Skin ulcers misdiagnosed as pyoderma gangrenosum. N Engl J Med. 2002;347(18):1412-8.
28. Su WP, Davis MD, Weenig RH, Powell FC, Perry HO. Pyoderma gangrenosum: clinicopathologic correlation and proposed diagnostic criteria. Int J Dermatol. 2004;43(11):790-800.
29. Maverakis E, Ma C, Shinkai K, Fiorentino D, Callen JP, Wollina U, et al. Diagnostic Criteria of Ulcerative Pyoderma Gangrenosum: A Delphi Consensus of International Experts. JAMA Dermatol. 2018;154(4):461-6.
30. Jourabchi N, Lazarus GS. Pyoderma gangrenosum. In: Kang S, Amagai M, Bruckner AL, Enk AH, Margolis DJ, Mcmichael AJ, et al, eds. Fitzpatrick’s Dermatology. 9th ed. New York: McGraw-Hill Education; 2019. p. 605-16.
31. George C, Deroide F, Rustin M. Pyoderma gangrenosum - a guide to diagnosis and management. Clin Med (Lond). 2019;19(3):224-8.
32. Fletcher J, Alhusayen R, Alavi A. Recent advances in managing and understanding pyoderma gangrenosum. F1000Res. 2019;8:F1000 Faculty Rev-2092.
33. Ben Abdallah H, Fogh K, Bech R. Pyoderma gangrenosum and tumour necrosis factor alpha inhibitors: A semi-systematic review. Int Wound J. 2019;16(2):511-21.
34. Roy DB, Conte ET, Cohen DJ. The treatment of pyoderma gangrenosum using etanercept. J Am Acad Dermatol. 2006;54(3 Suppl 2):S128-34.
35. Skopis M, Bag-Ozbek A. Pyoderma gangrenosum: a review of updates in diagnosis, pathophysiology and management. J. 2021;4(3):367-75.
1. Hospital Agamenon Magalhaes, Departamento de Cirurgia Plástica, Recife, PE, Brasil
2. Universidade Federal de São Paulo UNIFESP-EPM, Disciplina de Reumatologia, São
Paulo, SP, Brasil
3. Universidade Federal de Goiás Faculdade de Medicina Serviço de Reumatologia, Goiânia,
GO, Brasil
4. Universidade Federal de Minas Gerais, Departamento de Dermatologia, Belo Horizonte,
MG, Brasil
5. Faculdade de Medicina de Jundiaí, Departamento de Dermatologia, Jundiaí, SP, Brasil
LFDFV Análise e/ou interpretação dos dados, Aprovação final do manuscrito, Conceitualização, Concepção e desenho do estudo, Gerenciamento do Projeto, Metodologia, Redação - Revisão e Edição, Supervisão.
CLAA Análise e/ou interpretação dos dados, Investigação.
AWS Investigação, Metodologia.
JR Análise e/ou interpretação dos dados, Concepção e desenho do estudo, Investigação.
Autor correspondente: Luiz Felipe Duarte Fernandes-Vieira Av. Boa Viagem, 296/1004, Pina, Recife, PE, Brazil, CEP: 51011-000, E-mail: luizfelipedfv@gmail.com
Artigo submetido: 30/11/2021.
Artigo aceito: 07/04/2022.
Conflitos de interesse: não há.









 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter