

Original Article - Year 2023 - Volume 38 -
Curativo a vácuo simplificado: estudo de viabilidade operacional e financeira no tratamento de feridas
Simplified vacuum dressing system: operational and financial feasibility study in the management of wounds
RESUMO
Introdução: O alto custo da terapia de pressão negativa (TPN) torna o procedimento menos
acessível em instituições com recursos limitados. Para resolver o problema,
têm sido propostos os curativos a vácuo simplificados, mas a utilidade
desses equipamentos ainda é pouco estudada. O objetivo desse trabalho é
avaliar a viabilidade (operacional e financeira) de um modelo de curativo a
vácuo simplificado (MCVS).
Método: A viabilidade operacional foi avaliada por meio de estudo de tempo de
instalação e quantidade de curativos realizados; a financeira, por análise
de custos econômicos de trocas de curativos.
Resultados: Foram tratadas 50 feridas (25 em cada grupo: MCVS x hidrofibra prata). Para o
MCVS, o número de curativos por paciente foi menor, enquanto o tempo de
instalação, maior. MCVS apresentou custos maiores. O aumento de custo
associado a MCVS foi relacionado ao preço médio de comercialização do
produto e quantidade de trocas de curativos; tempo de tratamento e tempo de
instalação do MCVS não interferiram em custos. Em contraste, os custos do
MCVS se mostraram bem inferiores aos custos anunciados para a TPN
convencional.
Conclusão: MCVS foi considerado viável desde que seja feito por equipes qualificadas e
resulte em poucas trocas de curativos (< 3).
Palavras-chave: Procedimentos cirúrgicos reconstrutivos; Ferimentos e lesões; Tratamento de ferimentos com pressão negativa; Custos e análise de custo; Cicatrização
ABSTRACT
Introduction: The high cost of negative pressure wound therapy (NPWT) makes the procedure less accessible in institutions with limited resources. To solve the problem, streamlined vacuum dressings have been proposed, but the usefulness of these devices has been poorly studied. The objective of this work is to evaluate the feasibility (operational and financial) of a simplified vacuum dressing system model (SVDM).
Methods: Operational viability was assessed by studying application time and quantity of dressings performed; financial viability, by analyzing the economic costs of dressing changes.
Results: Fifty wounds were treated (25 in each group: SVDM x silver hydrofiber). For SVDM, the number of dressings per patient was lower, while the application time was higher. The SVDM showed higher costs. The increase in the expenses associated with the SVDM was related to the average selling price of the product and the number of dressing changes; treatment time and application time of the SVDM did not interfere with costs. In contrast, SVDM costs proved to be below the announced expenses for conventional NPWT.
Conclusion: SVDM was considered viable as long as qualified teams perform it and results in few dressing changes (< 3).
Keywords: Reconstructive surgical procedures; Wounds and injuries; Negativepressure wound therapy; Costs and cost analysis; Wound healing
INTRODUÇÃO
Desde a introdução há duas décadas1,2, a terapia de pressão negativa (TPN) tem se estabelecido pela eficácia em manejo de feridas agudas e crônicas3-7. No entanto, a alta tecnologia torna a TPN de elevado custo e reduz o uso em instituições com recursos escassos8. Para resolver o problema, têm sido propostos curativos a vácuo simplificados (CVS)8-12, uma vez que a TPN não exige obrigatoriamente aparato especial e é capaz de preparar feridas para tratamento cirúrgico8,12-14. A despeito de usar componentes elétricos e mecânicos mais simples, CVS conservam atributos de segurança indispensáveis, como sucção controlada e vedação de feridas1,8,10,15,16.
Características operacionais de CVS têm sido pouco avaliadas e, ocasionalmente, seriamente criticadas3,16. A maioria de estudos disponíveis não são controlados e utilizam metodologias limitadas, merecendo, assim, avaliações adicionais8,10,11,15,17,18. As principais deficiências apontadas são o uso de insumos rudimentares, dificuldade de selamento de lesões e incapacidade de manter pressões subatmosféricas8,15,16,19. As deficiências resultam em acúmulos de exsudatos, trocas de curativos e manipulação repetida de feridas. Além de enfadonhas, manipulações aumentam riscos de agravar lesões. Em feridas pouco exsudativas, selamentos inadequados podem ocasionar circulação perilesional de ar, resultando em ressecamentos, hemorragias e necrose progressiva de tecidos1,19-21.
A decisão de usar um curativo específico deve ser guiada não apenas por eficácia potencial, ocorrência de efeitos adversos, localização e sintomas de lesões (dor, exsudato etc.), mas também por experiência clínica, preferência de pacientes, frequência de trocas e custos22-24. Mesmo quando o valor econômico não é problema, o melhor tratamento pode ser difícil de implementar ou pode não estar disponível, de modo que se torna importante conhecer alternativas eficientes de segunda linha22.
OBJETIVO
O objetivo do estudo foi avaliar a viabilidade (operacional e financeira) de um modelo de CVS (MCVS).
MÉTODO
Estudo viabilidade feito a partir de ensaio clínico randomizado de superioridade, cego, com dois braços paralelos, realizado entre 1º de janeiro de 2017 e 1º de maio de 2020 no Hospital Roberto Santos (HRS; hospital-escola, multidisciplinar, 640 leitos - Salvador, BA). O ensaio foi cadastrado no Registro Brasileiro de Ensaios Clínicos (RBR-5c8y6v) e seguiu recomendações CONSORT 201025. A pesquisa foi aprovada pelo Conselho de Ética em Pesquisa do HRS (CAAE 55556816.7.0000.5028) e realizada de acordo com a Declaração de Helsinque. Um Termo de Consentimento Livre e Esclarecido foi obtido dos pacientes participantes.
Uma amostra de 50 pacientes foi calculada com uso de programa estatístico R (R Core Team, 2018) admitindo para o grupo MCVS proporção esperada média de sucesso de 98% e para o grupo controle de 72% e com margem de superioridade de 25%. Assumiu-se poder de teste de 80% e nível de significância de 5%. Os pacientes foram admitidos sequencialmente nos grupos tratamento (MCVS) e controle (hidrofibra prata - HFP, Aquacel Ag+ Extra™ - Convatec Inc., ER Squibb & Sons, North Caroline - USA) seguindo lista de números aleatórios gerados no programa estatístico citado. A análise estatística utilizada foi por protocolo de tratamento.
Foram incluídos pacientes adultos hospitalizados em decorrência de feridas agudas (< 3 meses) ou crônicas (≥ 3 meses). Não foram incluídos indivíduos com desordens sistêmicas descompensadas (cardíaca, tireoideana, renal, pulmonar, hepática, hipertensão arterial, anemia grave, desnutrição severa e coagulopatias). Feridas dolorosas ou infectadas, feridas associadas a dermatoses perilesionais, reações alérgicas, neoplasias, exposição de vasos, nervos ou vísceras também não foram incluídas. Desenvolvimento de complicações graves (por exemplo, hemorragia, reações alérgicas, sepse, necrose extensa, dor intensa), descompensação de distúrbios sistêmicos previamente controlados e óbitos não atribuíveis ao uso de curativos foram critérios de exclusão utilizados.
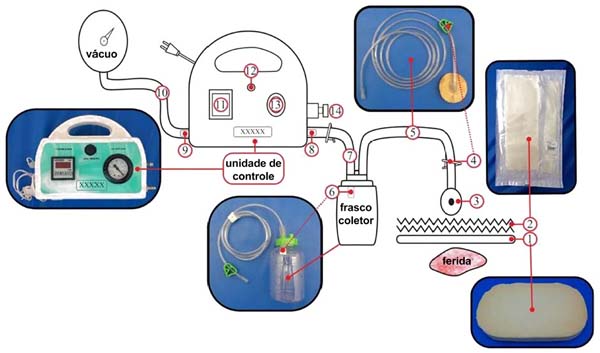
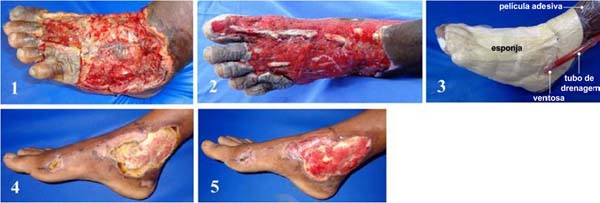
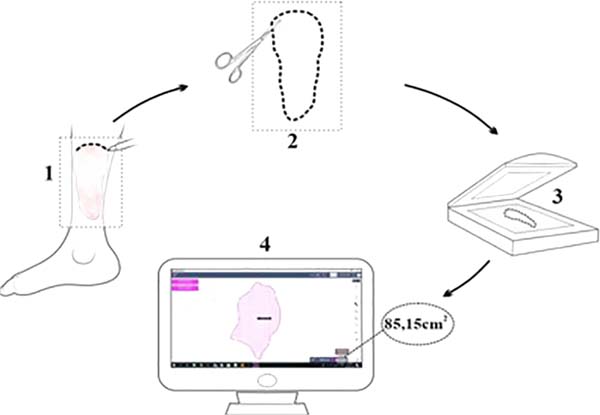
Áreas feridas foram calculadas com uso do aplicativo SketchandCalc (www.sketchandcalc.com - Figura 1). Instalação, MCVS e exemplos clínicos estão representados nas Figuras 2 a 4. MCVS foi regulado com pressão - 125mmHg. O primeiro curativo era usado em sucção contínua e os demais, em sucção intermitente (5 minutos de vácuo e 2 minutos sem vácuo)2,26.
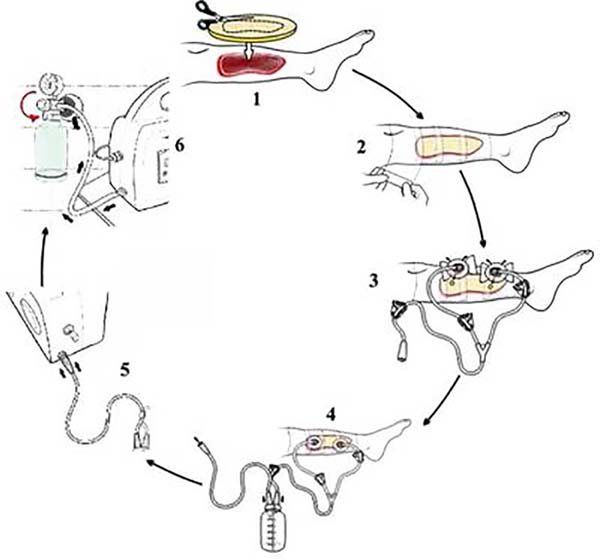
Em ambos os grupos, desbridamentos foram realizados para remoção de tecidos desvitalizados ocasionalmente presentes em feridas. Trocas foram feitas diante de ≥ 50% de saturação de curativos para evitar odor desagradável27. Pacientes foram seguidos por período de 14 dias ou até a ferida granular (≥ 75% do leito cruento coberto por tecido de granulação de aspecto saudável).
Foram avaliadas viabilidades operacional (facilidade de instalação e de uso) e financeira (custos de trocas de curativos) do MCVS. Para viabilidade operacional, desfechos analisados foram tempo de instalação e quantidade de curativos; para viabilidade financeira, custos econômicos totais e custo de trocas de curativos. Devido à assimetria de variáveis de estudo, análises estatísticas descritivas de viabilidade foram efetivadas com uso de mediana, intervalo interquartílico e diferença padronizada bivariada em comparação de tipos de curativos.
Critérios de qualificação de diferenças padronizada (Dp) foram: [0-0,2]: ausente; (0,2-0,5]: pequena; (0,5-0,8]: moderada; [> 0,8]: grande (Cohen, 1988). Valores de p calculados a partir do mesmo teste foram ajustados para quatro comparações múltiplas sob condição de dependência pelo método de Benjamini & Yekutieli28. Para estimativas de custo ajustadas por tempo de instalação de curativo, número de curativos e tempo de tratamento, empregou-se o modelo de regressão robusta com τ = 0,5 (mediana)29. Assumiu-se o erro α global de 0,05 para todo o estudo.
RESULTADOS
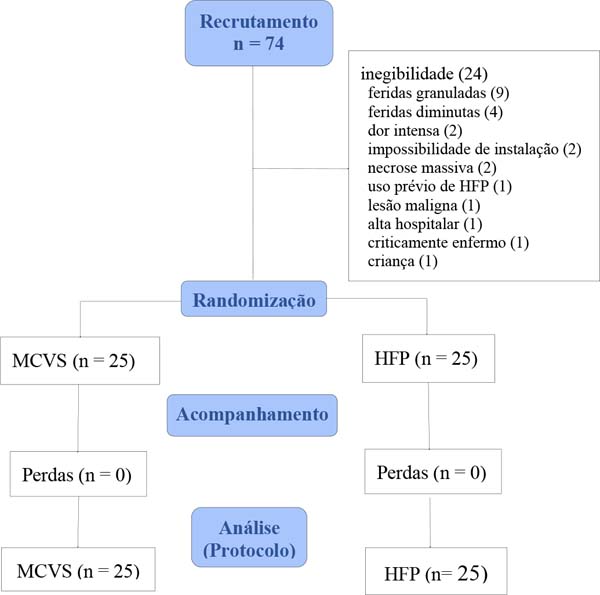
De 74 pacientes avaliados, 24 não foram incluídos por não atender a critérios de inclusão (Figura 5). Pacientes estudados foram, sobretudo, homens MCVS: 52% x HFP: 68%), mestiços (MCVS: 72% x HFP: 84%), não obesos (88%, ambos os grupos) e com idade média na faixa de 6ª década (MCVS: 55 anos x HFP: 50 anos - Tabela 1). Somando resultados de ambos os grupos, foram aplicados 270 curativos durante um período de 589 dias de tratamento.
| Variável | MCVS (n=25) | HFP (n=25) | ||
|---|---|---|---|---|
| Média (DP) (CV%) | Mín/Máx | Média (DP) (CV%) | Mín/Máx | |
| Idade (anos) | 55 (14) (25) | 29/85 | 50 (16) (32) | 15/79 |
| Peso (Kg) | 67 (16) (23,9) | 47/108 | 68 (15) (21,8) | 43/103 |
| Altura (cm) | 164 (11) (6,9) | 145/184 | 166 (12) (6,9) | 154/180 |
| n | % | n | % | |
| Sexo | ||||
| Masculino | 13 | 52 | 17 | 68 |
| Feminino | 12 | 48 | 8 | 32 |
| Pele | ||||
| Parda | 18 | 72 | 21 | 84 |
| Negra | 5 | 20 | 2 | 8 |
| Branca | 2 | 8 | 2 | 8 |
| IMC | ||||
| Baixo peso | 2 | 8 | 3 | 12 |
| Normal | 10 | 40 | 11 | 44 |
| Sobrepeso | 10 | 40 | 8 | 32 |
| Obesidade | 3 | 12 | 3 | 12 |
DP: desvio padrão; CV%: coeficiente de variação percentual; IMC: índice de massa corporal (Kg/cm2); Máx: máxima; Mín: Mínima.
O tempo mediano de instalação do MCVS foi cerca de 6 vezes maior do que o de HFP (22,7 min x 4,0 min; Dp = 0,84; p=0,0008). O MCVS apresentou, para menos, uma diferença de 4 dias de tratamento (3 dias x 7 dias; Dp=0,57; p=0,0028) e de trocas de curativos (3 curativos x 7 curativos; Dp=0,85; p<0,0027) (Tabela 2).
| Variável | MCVS (n = 25) | HFP (n= 25) | ||||||
|---|---|---|---|---|---|---|---|---|
| Md(IIQ) | Mín/Máx | CVMd% | Md(IIQ) | Mín/Máx | CVMd% | Dp | p* | |
| Tempo de instalação do curativo (min) |
22,71 (10,0) | 16,5/38,7 | 44,0 | 4,0(3,0) | 2,2/10,4 | 75,6 | 0,84 | 0,0008 |
| Tempo de tratamento (dias) | 10(5) | 3/15 | 50,0 | 14(0) | 7/15 | 0,0 | 0,57 | 0,0028 |
| Curativos/paciente | 3(1) | 1/4 | 33,3 | 7(2) | 6/14 | 28,6 | 0,85 | 0,0027 |
Máx: máxima; Mín: Mínima; Md(IIQ): mediana (intervalo interquartil); CVMd%: coeficiente de variação percentual de mediana; Dp: diferença padronizada (medida de associação estatística): critério de Cohen30 para Dp: [0-0,2]: ausente; (0,2-0,5]: pequena; (0,5-0,8]: moderada; >0,8: grande;
* valor de p ajustado para comparações múltiplas sob relações de dependência28.
A Tabela 3 (viabilidade financeira) apresenta estimativas de custos ajustadas por tempo de instalação por curativo, número de curativos e tempo de tratamento através de modelo de regressão robusta com τ = 0,5 (mediana). No modelo bruto (que contém apenas tipo do curativo como variável independente), a diferença em custo predito de MCVS em relação à HFP foi de apenas R$ 31,19, porém, ao acrescentar demais variáveis citadas (covariáveis), a diferença passou a ser R$ 1.112,96 (modelo ajustado 1). Houve, assim, grande alteração ao se levar em conta todas covariáveis e, assim, o modelo bruto se mostrou insatisfatório para predição de diferença de custo entre curativos.
| Variável | Modelo bruto |
Modelo ajustado 1 |
Modelo ajustado 2 |
Modelo saturado |
Modelo ajustado final |
||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Custo (R$) | pB | Custo (R$) | pAj1 | VIF | Custo (R$) | pAj2 | Custo (R$) | pS | Custo (R$) | pAjf | |
| Intercepto (β0) | 931,26 | < 0,0001 |
-1139,05 | < 0,0001 | - | -1269,37 | < 0,0001 | -894,75 | 0,1960 | -1270,55 | < 0,0001 |
| MCVS (β1) | -31,19 | 0,8470 | 1112,96 | 0,0001 | 2,10 | 1275,15 | < 0,0001 | 890,53 | 0,1978 | 1282,82 | < 0,0001 |
| Tempo de instalação por - curativo (min) (β2) |
- | - | 0,74 | 0,7080 | 2,52 | 0,31 | 0,9138 | - | - | - | - |
| Número de curativos (β3) | - | - | 246,00 | 0,0017 | 55,89 | 297,17 | < 0,0001 | 245,92 | 0,0137 | 297,48 | < 0,0001 |
| Tempo de tratamento (dias) (β4) |
- | - | 17,03 | 0,4032 | 47,72 | - | - | - | - | - | - |
| MCVS
(β1) x número de curativos (β3) |
- | - | - | - | - | - | - | 58,20 | 0,5462 | - | - |
Custo: custo mediano predito; pB: valor de p do modelo bruto; pAj1: valor de p do modelo ajustado 1; VIF: variance inflaction factor (fator de inflação da variância) - VIF aceitável: ≥ 10; pAj2: valor de p do modelo ajustado 2; pS: valor de p do modelo saturado; pAjf: valor de p do modelo ajustado final.
O modelo ajustado 1 mostrou forte correlação (multicolinearidade) entre número de curativos e tempo de tratamento, com valores de fator de inflação de variância (VIF) superiores a dez31. Por conseguinte, estas covariáveis não podem permanecer juntas no modelo para evitar vieses. Como número de curativos foi a covariável que apresentou maior diferença em custo, a covariável tempo de tratamento foi excluída do modelo.
No modelo ajustado 2, a covariável tempo de instalação não contribuiu para o custo predito (R$ 0,31; p=0,9138), sendo retirada do modelo.
No modelo ajustado 2, covariáveis que contribuíram para estimativas de custo mediano foram tipo do curativo e número de curativos e, após avaliação de possível interação entre estas covariáveis em modelo saturado com termo de interação, evidenciou-se sua provável ausência (p=0,5462).
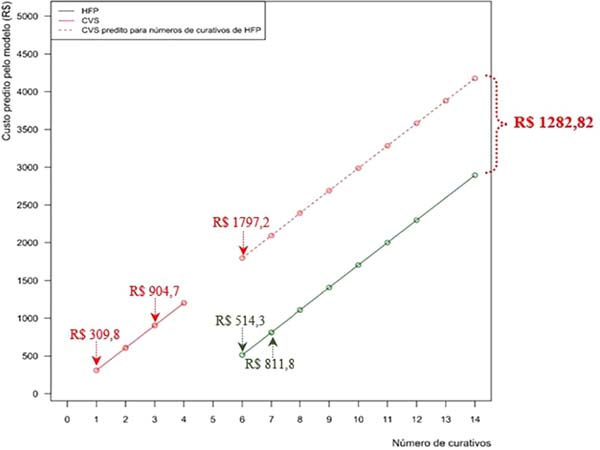
O modelo final ajustado mostra que a diferença estimada de custo entre MCVS e HFP foi de R$ 1.282,82 (p<0,0001). Em outras palavras, custos seriam bem maiores para MCVS se o grupo exigisse mesmo número de curativos que HFP. Uma vez que foram trocados mais curativos HFP (HFP = 7 x MCVS: 3), foi representado na Figura 6 tanto a diferença de custo encontrada diretamente no estudo (retas contínuas) como a diferença se os grupos apresentassem mesmo número de curativos (reta tracejada).
A figura mostra, por exemplo, que custos estimados para 6 curativos (número mínimo de curativos realizados no grupo HFP) foram: MCVS: R$ 1.797,20 x HFP: R$ 514,33; custos estimados para número mediano de curativos realizados em cada grupo foram MCVS (3 curativos): R$ 904,71 x HFP (7 curativos): R$ 811,81 (correspondente a R$ 92,91/paciente); por fim, o custo estimado para 1 MCVS foi de R$ 309,75, o que corresponde a custo estimado para 5,31 HFP. Por conseguinte, o custo estimado MCVS foi superior ao custo estimado HFP em todos os itens avaliados.
DISCUSSÃO
CVS reduzem recursos tecnológicos para facilitar manuseio e minimizar custos, porém, a simplificação não deve comprometer a confiabilidade do produto8,11,16. Para garantir a segurança, recomenda-se que os dispositivos disponham de mecanismos de controle de pressão para evitar variações de pressão subatmosférica e, em casos de pressões intensas, prevenir exsanguinação através das feridas3.
MCVS, além de conter esses elementos de segurança, incluindo manômetro pneumático, foi dotado de filtro especializado (polietileno de alto peso molecular - Figura 3) que, ao entrar em contato com exsudatos, bloqueia efluxos além do frasco coletor. Por fim, foram utilizadas esponjas de coloração clara para facilitar observação de seu grau de saturação e de retenção de debris. TPN convencional utiliza esponjas pretas, que impossibilitam observações. A transparência de um curativo possibilita monitorização contínua de leitos feridos e de pele perilesional sem necessidade de violar o curativo, reduzindo trocas e custos32.
Poucos dados estão disponíveis sobre operacionalidade de curativos a vácuo, o que dificulta discussões detalhadas. Em uma revisão sistemática, o modo de instalação foi descrito sumariamente sem ilustrações26. Em concordância com a corrente pesquisa, um estudo comparativo de tratamento de feridas crônicas usando um CVS de sucção hospitalar também descreveu seis etapas para instalação do curativo a vácuo13. Exceto por esses trabalhos e daquilo que está registrado no manual de fabricação de TPN convencionais, descrições sobre etapas de colocação não têm sido feitas em revisões sobre o assunto3,4,33.
O maior tempo de instalação para MCVS (22,71 min x 3,98 min) foi atribuído à maior complexidade de uso do dispositivo e, desse modo, de necessidade de treinamento para domínio do procedimento. A complexidade se deveu a múltiplas etapas necessárias para colocação do MCVS (6 etapas x 2 etapas), ao maior cuidado exigido para selamento de curativos (Figura 2, etapa 2) e ao tempo extra necessário para remoção de esponjas aderidas a feridas.
Em referências pesquisadas, apenas um ensaio randomizado utilizando um modelo de CVS (também suprido por vácuo hospitalar) forneceu resultados, com tempo médio de instalação de 19 minutos34. Comparado com o presente estudo, a diferença de pouco menos de quatro minutos por troca de curativo (22,71 min x 19 min) foi considerada pouco importante. Os dados sugerem que a complexidade de instalação do MCVS pode ser similar à de outros modelos de curativos simplificados.
A complexidade de instalação também é problema relacionado à TPN convencional1,3,6, sobretudo em feridas situadas em zonas contornadas (exemplo: pescoço, mãos e pés), em locais com reentrâncias (exemplo: entre dedos, sulco interglúteo), em regiões próximas a orifícios naturais (exemplo: períneo) ou quando pele perilesional estiver continuamente úmida (exemplo, dermatoses)1,3,6,13,35. A complexidade é tão significativa que TPN convencional é feita por equipes de enfermagem treinadas e não pertencentes à unidade hospitalar, o que gera dificuldade de acesso dessas equipes, especialmente em períodos noturnos, finais de semana, unidades de terapia intensiva e centros cirúrgicos. Além disso, obter e manter a vedação da ferida pode ser um exercício frustrante, diminuindo ainda mais a popularidade dos curativos a vácuo36. Em contraste, curativos oclusivos como HFP são simples, diretos e rápidos de aplicar24. Ademais, TPN requerer o trabalho adicional de monitorização diária para evitar vazamentos13,14.
MCVS foram capazes de manter selamentos em feridas, controlar pressão subatmosférica e drenar exsudatos sem necessidade de trocas precoces. Como resultado, a manutenção do MCVS (3 dias) foi similar à descrita para TPN padrão ou CVS (2 a 3 dias)6,14,37. Curativos a vácuo podem ser plenamente funcionantes por até 10 dias se a película adesiva for mantida intacta13,38. Houve redução de número de curativos no grupo MCVS (3 x 7), o que foi atribuído à drenagem contínua de fluidos, o que manteve curativos insaturados e operando por mais tempo8. Esponjas usadas em TPN, graças a suas propriedades absortivas, permitem menos trocas. Para não as tornar fétidas ou aderidas, os curativos devem ser trocadas a cada dois a três dias39,40.
Acúmulos de líquido durante intermitência podem romper a película e resultar em vazamentos; consequentemente, TPN intermitente tem sido substituída por uma “TPN variável”, caracterizada por um ciclo de variação suave entre pressões menos intensas (-80 mmHg e -10 mmHg) de modo a manter ambiente subatmosférico contínuo41,42. CVS alimentado por sucção de parede, como o MCVS, pode ser desejável, pois variações pressóricas de rede hospitalar (e que são transmitidas para o equipamento) mimetizam efeitos de TPN variável.
Análises de custos são desafiadoras, pois dados disponíveis são escassos26 e, ao contrário do realizado no presente ensaio, descritos sem ajustes relativamente a covariáveis. Custos MCVS dependeram de três fatores: preço médio de comercialização (unidade MCVS: R$ 299,90 x unidade HFP 15 cm x 15 cm: R$ 108,90), número de trocas e tipo de curativo.
Resultados indicam que MCVS implica em aumento de custos tanto por paciente (R$ 92,90 a mais) quanto por troca de curativo, com uma única troca de MCVS (R$ 309,80) equivalendo ao custo aproximado de 5 trocas de HFP. No entanto, são economizados 4 curativos ao se optar por MCVS. Se o número de trocas de MCVS for semelhante ao número de trocas de HFP, a diferença de custo aumenta ainda mais (R$ 1.282,82 - Tabela 3, Figura 6). Portanto, cuidados para garantir a qualidade operacional são essenciais para que não se exceda o número mediano de trocas de curativos MCVS (três trocas), pois o resultado elevaria consideravelmente o custo final.
Custos diretos obtidos para MCVS parecem ser bem inferiores aos de TPN padrão. O custo de TPN convencional tem sido estimado entre US$ 1.750,00 a US$ 3.450,00 semanalmente, e US$ 1.286,00 e US$ 5.452,00 por paciente10,12,26,43. Em crianças, o custo mensal de vacuoterapia foi recentemente estimado em US$ 1.677/paciente44. O tratamento pode tornar-se até 20 vezes mais econômica com uso de CVS10,45. Custos de CVS podem chegar a valores tão reduzidos quanto US$ 6,40/curativo39, US$ 15,00/dia14 ou 2% do custo médio de uso do VAC System12.
Uma razão para menores custos é que CVS são supridos por sistemas de vácuo hospitalar, dispensando maquinaria especializada10. Outras razão é uso de materiais simples, de menor custo e fabricados localmente (esponjas, filmes de poliuretano, frascos, tubos feitos de plástico PVC, etc.)11. Por fim, o corrente estudo evidenciou que o custo do MCVS pode se tornar ainda menor se o número de curativos for minimizado. A diminuição de trocas é possível, pois curativos de TPN plenamente funcionantes por até dez dias têm sido descritos13,38.
CONCLUSÃO
MCVS apresentou maior complexidade operacional e custo do que o curativo convencional utilizado, mas pode ser viável desde que profissionais para instalação estejam capacitados e que não haja mais que três trocas de curativos por paciente.
REFERÊNCIAS
1. Argenta LC, Morykwas MJ. Vacuum-assisted closure: a new method for wound control and treatment: clinical experience. Ann Plast Surg. 1997;38(6):563-76.
2. Morykwas MJ, Argenta LC, Shelton-Brown EI, McGuirt W. Vacuum-assisted closure: a new method for wound control and treatment: animal studies and basic foundation. Ann Plast Surg. 1997;38(6):553-62.
3. Argenta LC, Morykwas MJ, Marks MW, DeFranzo AJ, Molnar JA, David LR. Vacuum-assisted closure: state of clinic art. Plast Reconstr Surg. 2006;117(7 Suppl):127S-42S.
4. Orgill DP, Bayer LR. Negative pressure wound therapy: past, present and future. Int Wound J. 2013;10 Suppl 1(Suppl 1):15-9.
5. Suissa D, Danino A, Nikolis A. Negative-pressure therapy versus standard wound care: a meta-analysis of randomized trials. Plast Reconstr Surg. 2011;128(5):498e-503e.
6. Huang C, Leavitt T, Bayer LR, Orgill DP. Effect of negative pressure wound therapy on wound healing. Curr Probl Surg. 2014;51(7):301-31.
7. Daigle P, Despatis MA, Grenier G. How mechanical deformations contribute to the effectiveness of negative-pressure wound therapy. Wound Repair Regen. 2013;21(4):498-502.
8. Cilindro de Souza S, Henrique Briglia C, Miranda Cavazzani R. A Simplified Vacuum Dressing System. Wounds. 2016;28(2):48-56.
9. Ferraz EM, Lira CHA, Martins JPC, Maricevich JP, Pradines SMS, Granja Filho LG. Vacuum assisted closure system in the treatment of necrotizing fasciitis of abdominal wall. Rev Col Bras Cir. 2007;34(4):264-71.
10. Teixeira Neto N, Giacchetto E, Kamamoto F, Ferreira MC. Severe infections of soft tissue: case report of face necrotizing fasciitis using vacuum dressing and literature review. Rev Bras Cir Plast. 2011;26(2):352-9.
11. Rozen WM, Shahbaz S, Morsi A. An improved alternative to vacuum-assisted closure (VAC) as a negative pressure dressing in lower limb split skin grafting: a clinical trial. J Plast Reconstr Aesthet Surg. 2008;61(3):334-7.
12. Kamamoto F, Lima ALM, Rezende MR, Mattar-Junior R, Leonhardt MC, Kojima KE, et al. A new low-cost negative-pressure wound therapy versus a commercially available therapy device widely used to treat complex traumatic injuries: a prospective, randomized, non-inferiority trial. Clinics (Sao Paulo). 2017;72(12):737-42.
13. Tauro LF, Ravikrishnan J, Rao S, Divakar SH, Shetty SR, Menezes LT. A comparative study of the efficacy of topical negative pressure moist dressings and conventional moist dressings in chronic wounds. Indian J Plast Surg. 2007;40(2):133-40.
14. Chaput B, Garrido I, Eburdery H, Grolleau JL, Chavoin JP Low-cost Negative-pressure Wound Therapy Using Wall Vacuum: A 15 Dollars by Day Alternative. Plast Reconstr Surg Glob Open. 2015;3(6):e418. DOI: 10.1097/GOX.0000000000000347
15. Li TS, Choong MY, Wu HF, Chung KC. Simplified negative-pressure wound therapy system for skin graft wounds. Plast Reconstr Surg. 2012;129(2):399e-401e.
16. Sreekar H, Lambda S, Gupta AK. Simplified negative-pressure wound therapy system for skin graft wounds. Plast Reconstr Surg. 2012;130(4):620e.
17. Smith LA, Barker DE, Chase CW, Somberg LB, Brock WB, Burns RP. Vacuum pack technique of temporary abdominal closure: a four-year experience. Am Surg. 1997;63(12):1102-7.
18. Webster R, Ely PB, Milani A, Pereira Filho G, Valiati A, Minuzzi Filho A, et al. Alternative materials in vacuum-assisted closure. Plast Reconstr Surg. 2011;128(6):784e-5e.
19. Morykwas MJ, Faler BJ, Pearce DJ, Argenta LC. Effects of varying levels of subatmospheric pressure on the rate of granulation tissue formation in experimental wounds in swine. Ann Plast Surg. 2001;47(5):547-51.
20. Morykwas MJ, David LR, Schneider AM, Whang C, Jennings DA, Canty C, et al. Use of subatmospheric pressure to prevent progression of partial-thickness burns in a swine model. J Burn Care Rehabil. 1999;20(1 Pt 1):15-21.
21. Morykwas MJ, Simpson J, Punger K, Argenta A, Kremers L, Argenta J. Vacuum-assisted closure: state of basic research and physiologic foundation. Plast Reconstr Surg. 2006;117(7 Suppl):121S-6S.
22. Westby MJ, Dumville JC, Soares MO, Stubbs N, Norman G. Dressings and topical agents for treating pressure ulcers. Cochrane Database Syst Rev. 2017;6(6):CD011947. DOI: 10.1002/14651858.CD011947.pub2/
23. Harding K, Gottrup F, Jawień A, Mikosiński J, Twardowska-Saucha K, Kaczmarek S, et al. A prospective, multi-centre, randomised, open label, parallel, comparative study to evaluate effects of AQUACEL® Ag and Urgotul® Silver dressing on healing of chronic venous leg ulcers. Int Wound J. 2012;9(3):285-94. DOI: 10.1111/j.1742-481X.2011.00881.x
24. Jurczak F, Dugré T, Johnstone A, Offori T, Vujovic Z, Hollander D; AQUACEL Ag Surgical/Trauma Wound Study Group. Randomised clinical trial of Hydrofiber dressing with silver versus povidone-iodine gauze in the management of open surgical and traumatic wounds. Int Wound J. 2007;4(1):66-76.
25. Moher D, Hopewell S, Schulz KF, Montori V, Gøtzsche PC, Devereaux PJ, et al; Consolidated Standards of Reporting Trials Group. CONSORT 2010 Explanation and Elaboration: Updated guidelines for reporting parallel group randomised trials. J Clin Epidemiol. 2010;63(8):e1-37.
26. Pham CT, Middleton P, Maddern G. Vacuum-Assisted Closure for the Management of Wounds: An Accelerated Systematic Review. ASERNIP-S Report No. 37. Adelaide: ASERNIP-S; 2003. 52 p.
27. Kuo FC, Chen B, Lee MS, Yen SH, Wang JW. AQUACEL® Ag Surgical Dressing Reduces Surgical Site Infection and Improves Patient Satisfaction in Minimally Invasive Total Knee Arthroplasty: A Prospective, Randomized, Controlled Study. Biomed Res Int. 2017;2017:1262108. DOI:10.1155/2017/1262108
28. Benjamini Y, Yekutieli D. The control of the false discovery rate in multiple testing under dependency. Ann Stat. 2001;29(4):1165-88.
29. Koenker R, Bassett Jr G. Regression quantiles. Econometrica. 1978;46(1):33-50.
30. Ferguson CJ. An effect size primer: A guide for clinicians and researchers. Pr Psyc. 2009;40(5):532-38.
31. Hair JF, Black WC, Babin BJ, Anderson RE, Tatham RL. Multivariate data analysis. Upper Saddle River: Prentice Hall; 1998.
32. Stephen-Haynes J, Callaghan R, Wibaux A, Johnson P, Carty N. Clinical evaluation of a thin absorbent skin adhesive dressing for wound management. J Wound Care. 2014;23(11):532-4.
33. Hunter JE, Teot L, Horch R, Banwell PE. Evidence-based medicine: vacuumassisted closure in wound care management. Int Wound J. 2007;4(3):256-69.
34. Dorafshar AH, Franczyk M, Gottlieb LJ, Wroblewski KE, Lohman RF. A prospective randomized trial comparing subatmospheric wound therapy with a sealed gauze dressing and the standard vacuum-assisted closure device. Ann Plast Surg. 2012;69(1):79-84.
35. Sokolov T, Valentinov B, Andonov J, Angelov S, Kosev P. Contaminated problematic skin wounds in diabetic patients treated with autologous platelet - rich plasma (PRP): a case series study. J IMAB. 2016;22(1):1067-71.
36. Masters J. Reliable, inexpensive and simple suction dressings. Br J Plast Surg. 1998;51(3):267.
37. Anghel EL, Kim PJ. Negative-Pressure Wound Therapy: A Comprehensive Review of the Evidence. Plast Reconstr Surg. 2016;138(3 Suppl):129S-37S.
38. Aldunate JLCB, Vana LPM, Fontana C, Ferreira MC. Uso de matriz dérmica associado ao curativo por pressão negativa na abordagem da contratura em pacientes queimados. Rev Bras Cir Plast. 2012;27(3):369-73.
39. Agarwal P, Kukrele R, Sharma D. Vacuum assisted closure (VAC)/negative pressure wound therapy (NPWT) for difficult wounds: A review. J Clin Orthop Trauma. 2019;10(5):845-8.
40. Ur Rashid H, Rashid M, Ur Rehman Sarwar S, Khan I, Khan N, Bibi N. Negative Pressure Wound Therapy (NPWT): Our Experience in Pakistan With Locally Made Dressing. Cureus. 2020;12(7):e9464. DOI: 10.7759/cureus.9464
41. Glass GE, Nanchahal J. The methodology of negative pressure wound therapy: separating fact from fiction. J Plast Reconstr Aesthet Surg. 2012;65(8):989-1001.
42. Birke-Sorensen H, Malmsjo M, Rome P, Hudson D, Krug E, Berg L, et al; International Expert Panel on Negative Pressure Wound Therapy [NPWT-EP]. Evidence-based recommendations for negative pressure wound therapy: treatment variables (pressure levels, wound filler and contact layer)--steps towards an international consensus. J Plast Reconstr Aesthet Surg. 2011;64 Suppl:S1-16.
43. Marston WA, Armstrong DG, Reyzelman AM, Kirsner RS. A Multicenter Randomized Controlled Trial Comparing Treatment of Venous Leg Ulcers Using Mechanically Versus Electrically Powered Negative Pressure Wound Therapy. Adv Wound Care (New Rochelle). 2015;4(2):75-82.
44. Santosa KB, Keller M, Olsen MA, Keane AM, Sears ED, Snyder-Warwick AK. Negative-Pressure Wound Therapy in Infants and Children: A Population-Based Study. J Surg Res. 2019;235:560-8.
45. Huang WS, Hsieh SC, Hsieh CS, Schoung JY, Huang T. Use of vacuum-assisted wound closure to manage limb wounds in patients suffering from acute necrotizing fasciitis. Asian J Surg. 2006;29(3):135-9.
1. Universidade Federal da Bahia, Salvador, BA,
Brasil
2. Secretaria de Saúde do Estado da Bahia,
Salvador, BA, Brasil
Autor correspondente: Sandro Cilindro de Souza Av. Reitor Miguel Calmon, sala 110, 1º andar, Vale do Canela, Salvador, BA, Brasil., CEP: 40110-902, E-mail: sandrocilin@gmail.com
Artigo submetido: 01/06/2022.
Artigo aceito: 16/11/2022.
Conflitos de interesse: não há.









 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter