

Original Article - Year 2024 - Volume 39 -
Criopreservação de células-tronco mesenquimais do tecido adiposo: Uma alternativa para lipoenxertia seriada na reconstrução mamária
Cryopreservation of adipose tissue-derived mesenchymal stem cells: An alternative to serial fat grafting in breast reconstruction
RESUMO
Introdução: A lipoenxertia é um enxerto autólogo de células do tecido celular subcutâneo, que pode ser utilizada como técnica complementar na reconstrução mamária. Diante disso, a criopreservação de células-tronco mesenquimais provenientes de tecido adiposo (CTDAs) poderia ser uma maneira de realizar a coleta em um tempo cirúrgico e após realizar a lipoenxertia de forma fracionada. O dimetilsulfóxido (DMSO) é um criopreservante utilizado em pesquisas com células, porém é potencialmente tóxico, o que impossibilitaria a utilização de CTDAs criopreservadas na prática clínica. Novos criopreservantes celulares, sem toxicidade, vêm sendo descritos na literatura científica experimental, como as substâncias L-prolina e trealose. Com isso, esse trabalho teve como objetivo avaliar a viabilidade de CTDAs criopreservadas com a combinação de L-prolina e trealose, em um período de até 90 dias.
Método: Estudo experimental, no qual foram obtidas amostras de lipoaspirado provenientes de 9 pacientes. A fração celular foi processada e congelada com L-prolina (1,5M) + trealose (0,2M), ou com DMSO + soro fetal bovino (SFB), como controle. Após 30 e 90 dias, as amostras foram descongeladas e a viabilidade celular foi avaliada pela técnica de MTT.
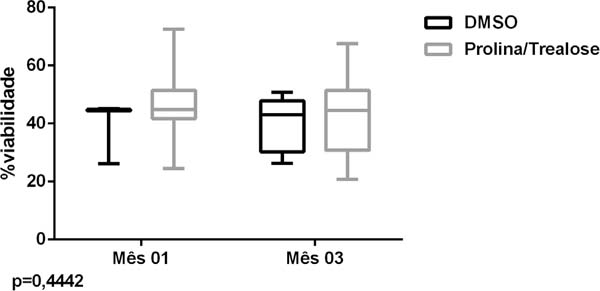
Resultados: A análise das CTDAs, após 1 e 3 meses de congelamento, indicou que as amostras tratadas com L-prolina + trealose apresentaram viabilidade semelhante àquelas preservadas com DMSO e SFB (p=0,444).
Conclusão: A associação de L-prolina e trealose manteve CTDA viáveis por 30 e 90 dias de congelamento, podendo ser uma alternativa como criopreservante celular sem toxicidade e viabilizando o uso de lipoenxertia seriada.
Palavras-chave: Trealose; Lipectomia; Neoplasias da mama; Células-tronco mesenquimais; Adipócitos. Prolina
ABSTRACT
Introduction: Fat grafting is an autologous graft of cells from subcutaneous tissue, which can be used as a complementary technique in breast reconstruction. Given this, the cryopreservation of adipose tissue-derived mesenchymal stem cells (ADMSCs) could be a way to collect them in one surgical procedure and after performing fractional fat grafting. Dimethyl sulfoxide (DMSO) is a cryopreservative used in cell research, but it is potentially toxic, which would make it impossible to use cryopreserved ADMSCs in clinical practice. New cellular cryopreservatives, without toxicity, have been described in the experimental scientific literature, such as the substances L-proline and trehalose. Therefore, this work aimed to evaluate the viability of ADMSCs cryopreserved with the combination of L-proline and trehalose over up to 90 days.
Method: Experimental study in which lipoaspirate samples were obtained from 9 patients. The cellular fraction was processed and frozen with L-proline (1.5M) + trehalose (0.2M) or with DMSO + fetal bovine serum (FBS) as control. After 30 and 90 days, the samples were thawed, and cell viability was assessed using the MTT technique.
Results: The analysis of ADMSCs, after 1 and 3 months of freezing, indicated that samples treated with L-proline + trehalose showed similar viability to those preserved with DMSO and SFB (p=0.444).
Conclusion: The association of L-proline and trehalose kept ADMSC viable for 30 and 90 days of freezing, and could be an alternative as a cellular cryopreservative without toxicity and enabling the use of serial fat grafting.
Keywords: Trehalose; Lipectomy; Breast neoplasms; Mesenchymal stem cells; Adipocytes; Proline
INTRODUÇÃO
A reconstrução cirúrgica da mama, após o tratamento locorregional de um câncer, possui relação com a qualidade de vida das pacientes1. Entretanto, em um país como o Brasil onde o acesso a esse tipo de procedimento pela grande maioria das mulheres afetadas por câncer de mama é muito limitado, considerando que, muitas vezes, são necessárias mais de uma intervenção para alcançar o resultado estético esperado.
Pensando na acessibilidade à cirurgia reparadora mamária no sistema público de saúde brasileiro, a Lei nº 9.797, de 6 de maio de 1999, definiu a obrigatoriedade desse tipo de procedimento pela rede de unidades integrantes do Sistema Único de Saúde (SUS) nos casos de mutilação decorrentes de tratamento de câncer2. Essa legislação foi modificada em 2013 (pela Lei nº 12.802), sendo estabelecido que o reparo estético deveria ser no mesmo tempo cirúrgico do tratamento do câncer, e quando fosse impossibilitado haveria a garantia da reconstrução mamária em um segundo tempo3; e pela portaria GM/MS nº 127, de fevereiro de 2023, que deliberou a instalação de estratégia excepcional de ampliação do acesso à reconstrução mamária4.
As opções de tratamento cirúrgico para o câncer de mama são inúmeras, e a técnica empregada depende de vários fatores, que incluem as características biológicas da neoplasia mamária, o volume da mama, as dimensões da lesão primária, a resposta ao tratamento sistêmico neoadjuvante e o estágio da doença no momento do diagnóstico, entre outros5. Também, com o maior acesso aos testes genéticos para verificar presença de variantes patogênicas de genes relacionados com maior predisposição de câncer de mama como BRCA1 e BRCA2, aumentou a indicação de adenomastectomias profiláticas6.
A lipoenxertia (ou lipofilling) é um enxerto autólogo de células do tecido adiposo, amplamente utilizado como método adjuvante na reconstrução mamária após cirurgia oncológica e/ou radioterapia, para corrigir o volume e irregularidades7. Recentemente, foi demostrado que o uso da lipoenxertia é seguro inclusive em cirurgias conservadoras para tratamento de câncer de mama, podendo ser empregada em mesmo tempo cirúrgico da excisão da neoplasia mamária8,9. Associada às indicações dessa técnica na área oncológica, também é empregada em inúmeros procedimentos estéticos na região da face, mamas, em remodelamento de contornos em diferentes sítios anatômicos, além da utilização na amenização de contraturas cicatriciais em grandes queimados10,11.
Este tipo de enxerto é um método complementar que permite obter grandes quantidades de células-tronco mesenquimais derivadas de tecido adiposo subcutâneo (CTDAs), que são as células responsáveis pela colonização e formação tecidual na área receptora12,13. Atualmente, as CTDAs são as mais utilizadas como estratégia de renovação celular, pois possuem capacidade semelhante às células-tronco originárias da medula óssea, além de serem obtidas através de uma técnica menos traumática e invasiva. Entretanto, o procedimento possui limitações, pois parte do volume de gordura aplicado é reabsorvido, prejudicando o resultado14.
Na reconstrução mamária, a lipoenxertia é realizada logo após a lipoaspiração de volumes pequenos de fração celular, não havendo preservação do material para enxertos posteriores, sendo o excedente descartado. Em situações em que existe a necessidade de volumes maiores de lipoenxertia, vários procedimentos sequenciais de lipoenxertia são realizados até que o resultado estético esperado seja alcançado15. Com isso, aumentam os custos operacionais, além de gerar maiores riscos cirúrgicos para a paciente.
A possibilidade de uso de técnicas de criopreservação celular poderia auxiliar nesse processo, pois as CTDAs seriam conservadas em baixas temperaturas, por tempo indeterminado e serem descongeladas de forma fracionada dependendo do planejamento cirúrgico16. A criopreservação de células busca assegurar as taxas de viabilidade celular adequadas mantendo o potencial biológico delas. Para isso, é necessária a utilização de criopreservantes durante as técnicas de congelamento, sendo o dimetilsulfóxido (DMSO) a substância mais utilizada nos protocolos convencionais em estudos experimentais, pois proporciona boa viabilidade celular após o descongelamento17. Entretanto, a utilização de criopreservação de CTDAs com DMSO, na prática clínica, é limitada, pois este solvente é toxico para as células humanas18.
Tendo em vista a importância das CTDAs na reconstrução de mama pósmastectomia, entre outras indicações em cirurgia estética, a pesquisa por criopreservantes não tóxicos e eficazes permitiria a conservação das CTDAs e, consequentemente, o planejamento de lipoenxertias seriadas.
OBJETIVO
Verificar a viabilidade celular de CTDAs após criopreservação de lipoaspirados com a combinação de L-prolina e trealose, substâncias que não possuem toxicidade celular documentada, além de terem um custo operacional baixo.
MÉTODO
Estudo descritivo transversal experimental, no qual foram coletadas amostras de tecido lipoaspirado de pacientes do sexo feminino, maiores de 18 anos, que assinaram o Termo de Consentimento Livre e Esclarecido (TCLE), que optaram em doar parte do lipoaspirado que iria ser desprezado após o procedimento de lipoaspiração estética; realizadas por 4 cirurgiões plásticos em hospitais do município de Chapecó-SC, entre junho de 2021 e março de 2022.
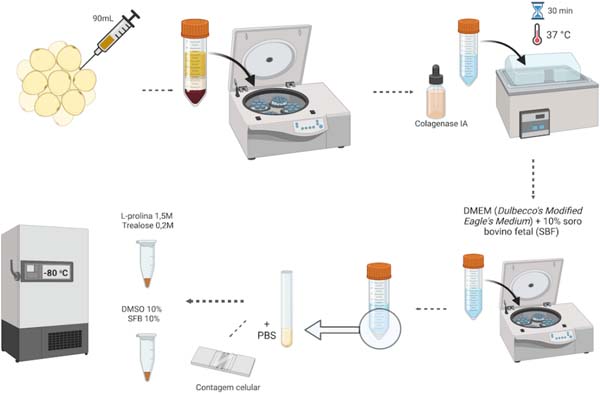
Buscando comparar a efetividade de criopreservantes frente a diferentes tempos de congelamento, foram coletados 90mL de material lipoaspirado, de cada paciente, que foram então alocados em 6 tubos Falcon® de 15mL. O material foi centrifugado a 3000rpm por 3 minutos, lavado com soro fisiológico 0,9% e novamente centrifugado com os mesmos parâmetros. Sucessivamente, foi acrescentado colagenase IA (C2674 - Sigma®) na concentração de 0,075% na proporção de 1:100, seguido de incubação em banho-maria a 37ºC por 30 minutos, com homogeneização a cada 10 minutos.
A inativação da colagenase foi realizada com a adição do meio de cultivo DMEM (Dulbecco’s Modified Eagle’s Medium) + 10% soro bovino fetal (SBF) na proporção de 1:1, sendo, então, o conteúdo centrifugado a 1600rpm por 10 minutos. O sobrenadante foi descartado e o sedimento celular (pellet) foi transferido para um novo tubo e ressuspendido em 2mL de tampão fosfato salino (PBS- Phosphate Buffered Saline) para posterior contagem de células em câmara de Neubauer. O conjunto celular foi dividido em 6 tubos, sendo que em 3 deles foram adicionados DMSO para concentração final de 10% + 10% de SFB. Nos tubos restantes foram adicionados L-prolina 1,5M e trealose 0,2M dissolvidos em tampão PBS. As amostras foram então congeladas a -80ºC (Figura 1).
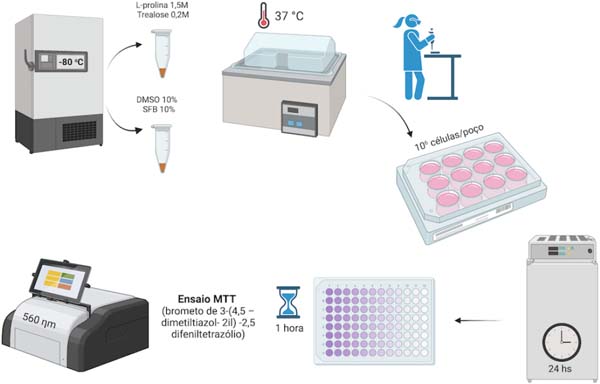
O processo de descongelamento das amostras em banho-maria a 37ºC se deu após 30 e 90 dias. Nas amostras que continham DMSO, foi realizada a remoção através de diluição e lavagem com tampão PBS. A L-prolina e a trealose não necessitaram de remoção. As amostram foram cultivadas em triplicata em placas estéreis de 12 poços na concentração de 106 células por poços. Em cada poço foram adicionados 2mL de DMEM contendo SBF 10% e penicilina 1% + estreptomicina 1%. Foi realizada a incubação das amostras em estufa sem CO2 a 37ºC por 24 horas.
A viabilidade celular foi realizada pelo ensaio com brometo de 3-(4,5 - dimetiltiazol-2il)-2,5 difeniltetrazólio (MTT). O conteúdo contido nos poços foi transferido para microtubos de 1,5mL, que foram centrifugados a 3000rpm por 15 minutos. A porção sobrenadante foi descartada e ao sedimento celular foram adicionados 300uL de PBS + 20uL de MTT e submetidos a incubação novamente a 37ºC por 1 hora. Posteriormente, as amostras foram centrifugadas com os mesmos parâmetros da etapa anterior, sendo então descartado 75uL de cada amostra para depois adicionar esse mesmo volume de DMSO. As amostras foram homogeneizadas e transferidas para uma placa de 96 poços para avaliação de absorbância por espectrofotometria em 560ηm (Figura 2).
Os dados gerados de viabilidade celular foram tabulados em planilha Microsoft® Office Excel, sendo então realizado o teste ANOVA de duas vias pelo GraphPad Prism 6.0, considerando significativos os resultados quando p<0,05.
O projeto inicial da pesquisa foi aprovado pelo Comitê de Ética em Pesquisa da Unochapecó, sob CAAE 23243519.7.0000.0116, e o parecer número 4.822.999, e pelas instituições envolvidas.
RESULTADOS
Foram processadas e congeladas amostras de 9 pacientes femininas, autodeclaradas como da raça branca e que foram submetidas a procedimento de lipoaspiração ultrassônica assistida de terceira geração (Vaser). Os lipoaspirados foram criopreservados e analisados em dois momentos, após 30 e 90 dias de congelamento. A média de idade das pacientes doadoras do lipoaspirado foi de 35,7 anos, enquanto a média do índice de massa corporal (IMC) foi de 25kg/m2.
O principal local de coleta foi na região abdominal e o número da cânula mais utilizado foi a de tamanho 3,7mm. A avaliação da viabilidade celular, após um e três meses de congelamento, indicou que as amostras criopreservadas com L-prolina + trealose apresentaram viabilidade celular semelhante àquelas que continham DMSO + SBF (p=0,4442) (Figura 3). Além disso, em relação ao tempo de congelamento, as amostras que ficaram 90 dias congeladas mantiveram CTDAs viáveis quando comparadas com as amostras descongeladas no primeiro mês (p=0,5301). constatando que, além do tipo de criopreservante, o tempo de congelamento também pareceu não interferir na viabilidade das células.
DISCUSSÃO
Vários fatores podem influenciar na viabilidade das CTDAs, dentre eles: metodologias de extração e de injeção do lipoaspirado, velocidade de centrifugação, utilização de soluções anestésicas e/ou salinas, volume de conteúdo aspirado, local e características biológicas do tecido adiposo da área doadora, entre outros12,19. Além disso, não há um consenso quanto à melhor maneira de processar a gordura para posteriormente utilizar como enxerto11,17.
Características clínicas e fenotípicas das pacientes podem influenciar na qualidade do material adiposo aspirado. Como no IMC, em que, em pacientes com valores maiores que 25kg/m2, existe uma relação indireta com a capacidade de proliferação e diferenciação celular, ou seja, o excesso de peso da paciente pode contribuir para resultados não satisfatórios na utilização de CTDAs em cirurgias reparadoras20.
A idade da paciente também é um fator relevante em função das alterações causadas pelo envelhecimento nas CTDAs. Isso se deve a diversos eventos celulares, como o encurtamento dos telômeros e enfraquecimento do sistema de proteção antioxidante associado ao estresse oxidativo e danos acumulados no sistema de reparo do DNA21,22.
No presente estudo, esses fatores provavelmente não interferiram na avaliação da viabilidade celular, pois a média dos valores encontrados para essas duas variáveis, no grupo das pacientes estudadas, estava dentro da faixa dos resultados descritos na literatura revisada19-21.
Outro aspecto verificado na literatura que poderia interferir na viabilidade celular seria o diâmetro da cânula utilizada na tanto na coleta do lipoaspirado na área doadora como na injeção da fração que contém as CTDAs na área receptora23. Em artigo de revisão, foi demostrado que a maioria dos autores usa cânulas que variam de 2mm a 6mm24, mas a viabilidade celular é maior quando o lipoaspirado for realizado com cânulas com diâmetros superiores a 3mm25. Esses resultados podem ser explicados pela obtenção de aspirados com grande quantidade de células da fração vascular do estroma, em comparação ao uso de cânulas com diâmetros menores25,26.
A maioria dos autores usam cânulas com diâmetro menor que 2mm para realizar a injeção da fração intermediária do lipoaspirado, pois diminui a chance de extravasamento do material, além de minimizar a possibilidade de injeção do conteúdo em meio intravascular27. No presente estudo, foram utilizadas amostras obtidas com cânulas de 3mm, 3,7mm, 4mm e 5mm, sendo a de 3,7mm a mais prevalente. Em nenhum dos procedimentos foi realizada lipoenxertia.
A forma de separação dos componentes do lipoaspirado pode ser via decantação ou centrifugação. A técnica de centrifugação permite concentrar gordura e aumentar o número de células por mililitro, ao mesmo tempo em que separa a gordura liquefeita e os componentes celulares sanguíneos28. Estudos indicam que as CTDAs presentes no sedimento, obtido após a lavagem do material centrifugado, apresentam maior viabilidade, uma vez que não estão contaminadas com resíduos de células sanguíneas, o que é comum em amostras tratadas apenas por decantação, além de haver maior rompimento das paredes de adipócitos e maior número de CTDAs12,29,30.
Na publicação em que comparamos diferentes velocidades de centrifugação, documentamos a metodologia descrita por Coleman (3000rpm durante três minutos) e encontramos maior manutenção das características biológicas das CTDAs, necessárias para a colonização celular nas áreas receptoras de enxerto12,29. Isso porque centrifugar as amostras faz com que as células de gordura consigam ficar mais concentradas, além de separar das células sanguíneas30.
Da mesma maneira, no presente estudo as amostras foram centrifugadas visando separar as frações de tecido em três porções bem definidas: camada inferior de células sanguíneas, camada intermediária contendo as células estromais e tecido adiposo, e camada superficial de gordura liquefeita. Com isso, não houve interferência dos restos celulares sanguíneos e da gordura liquefeita no cultivo e na criopreservação das CTDAs.
A viabilidade celular após um período de criopreservação também pode variar dependendo da quantidade de células estocadas em cada microtubo31. Goh et al.16 utilizaram quatro concentrações celulares e notaram que a concentração de 5x105 células/mL apresentou uma taxa de viabilidade de 81,10%; enquanto na concentração de 1x106 células/mL a viabilidade foi de 77,9%. Poucos estudos descritos na literatura documentaram viabilidade de CTDAs tão significativas como o publicado por De Rosa et al.32, no qual foi descrito índice de 92,5% das células viáveis; porém, a concentração celular era de 6x103 células/mL.
Para esta pesquisa, a concentração de células utilizadas em cada microtubo foi de 5x105 células/mL, e as taxas de viabilidade, nas células congeladas tanto com L-prolina e trealose como o controle DMSO, foram próximas dos 60%. Comparando esses resultados, é possível inferir que uma menor quantidade de células armazenadas em cada microtubo se relaciona com maior taxa de viabilidade, provavelmente devido ao espaço mais adequado para manutenção fisiológica das CTDAs.
Considerando a temperatura utilizada para o congelamento das amostras, mantivemos as células congeladas a temperatura de -80ºC, através da técnica de resfriamento rápido, que também foi utilizada por Ray et al.33. Entretanto, atualmente, a temperatura mais frequentemente descrita para armazenamento celular seria a -196ºC (via nitrogênio líquido), pois a utilização de freezer -80ºC estaria relacionada a maior formação de cristais de gelo, o que poderia causar dano ao material criopreservado. Porém, o uso de nitrogênio líquido é uma técnica que demanda alto custo de manutenção31,34.
Em relação aos criopreservantes, o DMSO é a substância mais utilizada em diversos protocolos para preservação celular, pois está relacionado com a manutenção da viabilidade das CTAS11. Todavia, é uma substância tóxica causando alterações negativas nos processos celulares como metabolismo, nas vias do ciclo do ácido cítrico e transporte respiratório de elétrons, metabolismo da glicose, de lipídios e lipoproteínas. Também possui relação com mudanças nas vias mitocondriais, produção de espécies reativas de oxigênio e geração de ATP celular35.
Na presente pesquisa, optou-se por utilizar dois criopreservantes naturais de custo baixo, e alternativos ao DMSO. A trealose é um dissacarídeo não redutor constituído de duas unidades de glicose, enquanto a L-prolina é um aminoácido natural formado por meio de biossíntese a partir do L-glutamato; ambos não causam toxicidade na célula e são fonte de estudos na busca de um criopreservante adequado36.
Em estudo realizado com hemácias criopreservadas com diferentes concentrações de L-prolina e trealose, foi observada manutenção da estrutura celular, além de não ter sido alterada a atividade das bombas Na +/ K +-ATPase, cuja função é manter as concentrações dos íons intracelulares, muito relevante para a transdução de sinal e o metabolismo celular, além da metilação do DNA não ser alterada22,37. Além disso, pelo fato de a L-prolina e a trealose não serem toxicas às células, não há necessidade de remoção dos crioprotetores, reduzindo a perda celular, como o realizado quando é usado o DMSO23.
Segundo estudos de Dovgan et al.38, que utilizaram um protocolo de criopreservação apenas com trealose (0,25M), houve viabilidade celular comparável do agente não tóxico em relação ao DMSO; também foi observado que as concentrações de trealose possuem correlação positiva em relação à viabilidade celular. Em outro estudo, foi demostrado que as CTDAs provenientes de lipoaspirado, quando criopreservadas por 6 meses com trealose na concentração de 0,35M, conseguem manter a atividade biológica, quase em mesmo índice que o tecido fresco39. No presente estudo, a associação de L-prolina e trealose mostrou índices de vitalidade celular equiparados ao uso de DMSO na criopreservação de CTDAs.
O tempo de criopreservação celular também vem sendo estudado31,34,40. De Rosa et al.32 mantiveram as células congeladas por até 12 meses, utilizando trealose, DMSO e SBF e encontraram dados significativos de viabilidade celular, com mais de 80% de células recuperadas. Também, já foi documentado que, ao deixar as células criopreservadas por 6 meses, o potencial de proliferação e diferenciação celular foi semelhante ao grupo de células não criopreservadas39,41. No presente estudo, foi possível demonstrar que amostras de CTDAs congeladas por 90 dias apresentaram viabilidade celular semelhante àquelas congeladas por 30 dias. Ou seja, a criopreservação por longos períodos pode ser uma metodologia factível, para uso fracionado de CTDAs em múltiplos tempos cirúrgicos com utilização de volumes suficientes para correções cirúrgicas, sejam estéticas ou de reparação.
CONCLUSÃO
A criopreservação de CTDAs com o uso combinado de L-prolina e trealose resultou em viabilidade celular equivalente ao uso de DMSO. Além disso, células congeladas por 90 dias mantiveram taxas de viabilidade semelhantes daquelas conservadas por um período menor. Considerando os dados encontrados e os revisados na literatura, o uso da combinação de L-prolina e trealose pode ser uma opção ao DMSO, evitando toxicidade celular. Essa metodologia pode ser uma alternativa para evitar múltiplas coletas de lipoaspirado em procedimentos cirúrgicos que necessitem de várias sessões de lipoenxertia, principalmente na reconstrução mamária pós-tratamento cirúrgico do câncer de mama.
AGRADECIMENTOS
A todos os colegas pesquisadores do grupo de pesquisa “Biologia Molecular e Biotecnologia em Saúde” da Universidade Comunitária da Região de Chapecó (Unochapecó) e ao grupo de pesquisa “Estudos Biológicos e Clínicos em Patologias Humanas” da Universidade Federal da Fronteira Sul (UFFS) campus Chapecó-SC. Aos cirurgiões plásticos Dr. Gustavo Colonheze, Dr. Jorge Diego Valentini, Dr. Rafael de Almeida Tirapelle e Dra. Tainara Cassol, que gentilmente aceitaram participar com o contato inicial das pacientes e receber a equipe de pesquisadores.
REFERÊNCIAS
1. Fanakidou I, Zyga S, Alikari V, Tsironi M, Stathoulis J, Theofilou P. Mental health, loneliness, and illness perception outcomes in quality of life among young breast cancer patients after mastectomy: the role of breast reconstruction. Qual Life Res. 2018;27(2):539-43.
2. Brasil. Presidência da República. Lei Nº 9.797, de 6 de maio de 1999. Dispõe sobre a obrigatoriedade da cirurgia plástica reparadora da mama pela rede de unidades integrantes do Sistema Único de Saúde - SUS nos casos de mutilação decorrentes de tratamento de câncer. Brasília: Presidência da República; 1999. [Internet]. Disponível em: https://legislacao.presidencia.gov.br/atos/?tipo=LEI&numero=9797&ano=1999&ato=b04cXRE9keNpWT174
3. Brasil. Presidência da República. Lei Nº 12.802, de 24 de abril de 2013. Altera a Lei nº 9.797, de 6 de maio de 1999, que “dispõe sobre a obrigatoriedade da cirurgia plástica reparadora da mama pela rede de unidades integrantes do sistema único de saúde - SUS nos casos de mutilação decorrentes de tratamento de câncer”, para dispor sobre o momento da reconstrução mamária. [Internet]. Brasília: Presidência da República; 2013. Disponível em: https://legislacao.presidencia.gov.br/atos/?tipo=LEI&numero=12802&ano=2013&ato=97cATRU50MVpWTabf
4. Brasil. Ministério da Saúde. Portaria GM/MS nº 127, de 13 de fevereiro de 2023. Institui estratégia excepcional de ampliação do acesso à reconstrução mamária em caso de mulheres com diagnóstico de câncer de mama, no âmbito do Sistema Único de Saúde -SUS. [Internet]. Brasília: Ministério da Saúde; 2023. Disponível em: https://www.gov.br/saude/pt-br/composicao/saes/legislacao/portaria-gm-ms-no-127-de-13-de-fevereiro-de-2023/view
5. Loibl S, Poortmans P, Morrow M, Denkert C, Curigliano G. Breast cancer. Lancet. 2021;397(10286):1750-69.
6. Petrucelli N, Daly MB, Pal T. BRCA1- and BRCA2-Associated Hereditary Breast and Ovarian Cancer: Synonym: BRCA1- and BRCA2-Associated HBOC [Internet]. 2022 [acesso 2022 nov 11]. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK1247/
7. Tan SS, Loh W. The utility of adipose-derived stem cells and stromal vascular fraction for oncologic soft tissue reconstruction: Is it safe? A matter for debate. Surgeon. 2017;15(4):186-9.
8. Stumpf CC, Zucatto ÂE, Cavalheiro JAC, de Melo MP, Cericato R, Damin APS, et al. Oncologic safety of immediate autologous fat grafting for reconstruction in breast-conserving surgery. Breast Cancer Res Treat. 2020;180(2):301-9.
9. Krastev TK, Schop SJ, Hommes J, Piatkowski AA, Heuts EM, van der Hulst RRWJ. Meta-analysis of the oncological safety of autologous fat transfer after breast cancer. Br J Surg. 2018;105(9):1082-97.
10. He X, Zhang J, Luo L, Shi J, Hu D. New Progress of Adipose-derived Stem Cells in the Therapy of Hypertrophic Scars. Curr Stem Cell Res Ther. 2020;15(1):77-85.
11. Zuk P. Adipose-Derived Stem Cells in Tissue Regeneration: A Review. Int Sch Res Notices. 2013;2013:1-35.
12. Moreno M, Schmidt JC, Gazzoni CD, Dal-Magro L, Bonadiman BDSR, Kosvoski GC, et al. Viability of mesenchymal stem cells of adipose tissue from human liposuction. Rev Bras Cir Plást. 2021;36(1):9-14.
13. da Silva A, do Prado J, Pignataro J, Moreno M. Lipoenxertia. In: Bagnoli F, Postiglione F, Palermo F, Pedrini JL, Freitas Júnior R, Marques V. Mastologia: do diagnóstico ao tratamento. 2ª ed. Goiânia: Conexão Soluções Corporativas; 2022.
14. Arshad Z, Karmen L, Choudhary R, Smith JA, Branford OA, Brindley DA, et al. Cell assisted lipotransfer in breast augmentation and reconstruction: A systematic review of safety, efficacy, use of patient reported outcomes and study quality. JPRAS Open. 2016;10:5-20.
15. Piffer A, Aubry G, Cannistra C, Popescu N, Nikpayam M, Koskas M, et al. Breast Reconstruction by Exclusive Lipofilling after Total Mastectomy for Breast Cancer: Description of the Technique and Evaluation of Quality of Life. J Pers Med. 2022;12(2):153.
16. Goh BC, Thirumala S, Kilroy G, Devireddy RV, Gimble JM. Cryopreservation characteristics of adipose-derived stem cells: maintenance of differentiation potential and viability. J Tissue Eng Regen Med. 2007;1(4):322-4.
17. Lee JE, Kim I, Kim M. Adipogenic differentiation of human adipose tissue-derived stem cells obtained from cryopreserved adipose aspirates. Dermatol Surg. 2010;36(7):1078-83.
18. Wang C, Xiao R, Cao YL, Yin HY. Evaluation of human platelet lysate and dimethyl sulfoxide as cryoprotectants for the cryopreservation of human adipose-derived stem cells. Biochem Biophys Res Commun. 2017;491(1):198-203.
19. Kim IH, Yang JD, Lee DG, Chung HY, Cho BC. Evaluation of centrifugation technique and effect of epinephrine on fat cell viability in autologous fat injection. Aesthet Surg J. 2009;29(1):35-9.
20. Frazier TP, Gimble JM, Devay JW, Tucker HA, Chiu ES, Rowan BG. Body mass index affects proliferation and osteogenic differentiation of human subcutaneous adipose tissue-derived stem cells. BMC Cell Biol. 2013;14:34.
21. Efimenko AY, Kochegura TN, Akopyan ZA, Parfyonova YV. Autologous Stem Cell Therapy: How Aging and Chronic Diseases Affect Stem and Progenitor Cells. Biores Open Access. 2015;4(1):26-38.
22. Zhang TY, Tan PC, Xie Y, Zhang XJ, Zhang PQ, Gao YM, et al. The combination of trehalose and glycerol: an effective and non-toxic recipe for cryopreservation of human adipose-derived stem cells. Stem Cell Res Ther. 2020;11(1):460.
23. Toledo LS, Mauad R. Fat injection: a 20-year revision. Clin Plast Surg. 2006;33(1):47-53.
24. Piccotti F, Rybinska I, Scoccia E, Morasso C, Ricciardi A, Signati L, et al. Lipofilling in Breast Oncological Surgery: A Safe Opportunity or Risk for Cancer Recurrence? Int J Mol Sci. 2021;22(7):3737.
25. Becker H, Vazquez OA, Rosen T. Cannula Size Effect on Stromal Vascular Fraction Content of Fat Grafts. Plast Reconstr Surg Glob Open. 2021;9(3):e3471.
26. Tong Y, Liu P, Wang Y, Geng C, Han X, Ma J, et al. The Effect of Liposuction Cannula Diameter on Fat Retention-Based on a Rheological Simulation. Plast Reconstr Surg Glob Open. 2018;6(11):e2021.
27. Biazus JV, Falcão CC, Parizotto AC, Stumpf CC, Cavalheiro JA, Schuh F, et al. Immediate Reconstruction with Autologous fat Transfer Following Breast-Conserving Surgery. Breast J. 2015;21(3):268-75.
28. Condé-Green A, de Amorim NF, Pitanguy I. Influence of decantation, washing and centrifugation on adipocyte and mesenchymal stem cell content of aspirated adipose tissue: a comparative study. J Plast Reconstr Aesthet Surg. 2010;63(8):1375-81.
29. Coleman SR. Long-term survival of fat transplants: controlled demonstrations. Aesthetic Plast Surg. 1995;19(5):421-5.
30. Ladeira PRS, Isaac C, Nakamura YM, Tutihashi RMC, Paggiaro AO, Ferreira MC. Cultivo de células-tronco derivadas de tecido adiposo: uma análise crítica. Rev Med (São Paulo). 2012;91(4):246-52.
31. Irioda AC. Avaliação da integridade das células-tronco mesenquimais derivadas do tecido adiposo humano após o bioprocesso de criopreservação [Dissertação de mestrado]. Curitiba: Universidade Federal do Paraná; 2010. Disponível em: http://hdl.handle.net/1884/26521
32. De Rosa A, De Francesco F, Tirino V, Ferraro GA, Desiderio V, Paino F, et al. A new method for cryopreserving adipose-derived stem cells: an attractive and suitable large-scale and long-term cell banking technology. Tissue Eng Part C Methods. 2009;15(4):659-67.
33. Ray SS, Pramanik K, Sarangi SK, Jain N. Serum-free non-toxic freezing solution for cryopreservation of human adipose tissue-derived mesenchymal stem cells. Biotechnol Lett. 2016;38(8):1397-404.
34. Ginani F, Soares DM, Barboza CAG. Influência de um protocolo de criopreservação no rendimento in vitro de células-tronco derivadas do tecido adiposo. Rev Bras Cir Plást. 2012;27(3):359-63.
35. Verheijen M, Lienhard M, Schrooders Y, Clayton O, Nudischer R, Boerno S, et al. DMSO induces drastic changes in human cellular processes and epigenetic landscape in vitro. Sci Rep. 2019;9(1):4641.
36. Kennelly P, Rodwell V. Aminoácidos e Peptídeos. In: Rodwell VW, Bender D, Botham KM, Kennelly PJ, Weil PA. Bioquímica Ilustrada de Harper. 31ª ed. Porto Alegre: AMGH Editora; 2021.
37. Dou M, Lu C, Sun Z, Rao W. Natural cryoprotectants combinations of l-proline and trehalose for red blood cells cryopreservation. Cryobiology. 2019;91:23-9.
38. Dovgan B, Miklavčič D, Knežević M, Zupan J, Barlič A. Intracellular delivery of trehalose renders mesenchymal stromal cells viable and immunomodulatory competent after cryopreservation. Cytotechnology. 2021;73(3):391-411.
39. Dalmagro JP. Isolamento e caracterização das células-tronco mesenquimais provenientes do tecido adiposo e avaliação da sua viabilidade tecidual após criopreservação [Monografia]. Porto Alegre: Universidade Federal do Rio Grande do Sul; 2019.
40. Lenoch CY. Estratégias para criopreservação de células tronco mesenquimais de tecido adiposo bovino [Dissertação de mestrado]. Lages: Universidade do Estado de Santa Catarina; 2015.
41. Gonda K, Shigeura T, Sato T, Matsumoto D, Suga H, Inoue K, et al. Preserved proliferative capacity and multipotency of human adipose-derived stem cells after long-term cryopreservation. Plast Reconstr Surg. 2008;121(2):401-10.
1. Universidade Federal da Fronteira Sul, Chapecó,
SC, Brasil
2. Universidade Comunitária da Região de Chapecó,
Chapecó, SC, Brasil
Autor correspondente: Marcelo Moreno Rodovia SC 484, Km 02, Bloco dos professores, Chapecó, SC, Brasil, CEP: 89815-899, E-mail: marcelo.moreno@uffs.edu.br
Artigo submetido: 15/05/2023.
Artigo aceito: 20/08/2023.
Conflitos de interesse: não há.





 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter