

Case Report - Year 2024 - Volume 39 -
Fasciotomia em membro superior após síndrome compartimental por acidente ofídico com posterior enxertia e plástica em Z: relato de caso
Fasciotomy in the upper limb after compartment syndrome due to snakebite with subsequent grafting and z-plasty: case report
RESUMO
Este relato de caso aborda o curso clínico de um envenenamento botrópico ocorrido no município de Jarinu, SP, no ano de 2021. O paciente necessitou de fasciotomia em membro superior após síndrome compartimental aguda com enxertia dermoepidérmica em um segundo momento cirúrgico. No pós-operatório tardio, o paciente evoluiu com retração, necessitando de reabordagem cirúrgica com correção de retração de membro superior esquerdo. Discute-se a gravidade do acidente ofídico, efeitos do veneno nos tecidos, complicações, síndrome compartimental aguda, indicação e técnica da fasciotomia descompressiva com base na literatura.
Palavras-chave: Mordeduras de serpentes; Fasciotomia; Transplante de pele; Retalhos cirúrgicos; Extremidade superior
ABSTRACT
This case study examines the clinical course of a Bothrops snakebite poisoning that occurred in Jarinu, São Paulo, Brazil, in 2021. The patient required a fasciotomy in the upper limb due to acute compartment syndrome, followed by a second surgical procedure involving dermo-epidermal grafting. In the late postoperative period, the patient experienced retraction, leading to a subsequent surgical intervention to correct the retraction in the left upper limb. The severity of the snakebite accident, the effects of venom on tissues, complications, acute compartment syndrome, as well as the indications and techniques for decompressive fasciotomy, are discussed based on the available literature.
Keywords: Snake bites; Fasciotomy; Skin transplantation; Surgical flaps; Upper extremity
INTRODUÇÃO
Os acidentes botrópicos são responsáveis pela maioria dos acidentes ofídicos no Brasil, representando aproximadamente 90,5% dos casos. Serpentes da família Viperidae, especificamente dos gêneros Bothrops e Bothrocophias, são encontradas em todo o Brasil, principalmente em áreas agrícolas, costeiras e periurbanas.
Em 2021, foram notificados 31.354 acidentes ofídicos no país, sendo 5.723 casos no estado do Pará, 3.118 casos no estado da Bahia, 3.030 casos no estado de Minas Gerais, 2.238 casos no estado do Maranhão, 2.112 casos no estado do Amazonas e 2.023 casos no estado de São Paulo, classificando-o como o 6º estado com maior incidência nesse período1-3. A Organização Mundial da Saúde (OMS) reconhece o envenenamento por picada de cobra como uma doença tropical negligenciada que representa um problema significativo de saúde pública, com altas taxas de morbidade e mortalidade4-6.
A doença tem baixa letalidade, estimada em 0,3%. Entretanto, as complicações decorrentes dos acidentes botrópicos são a maior preocupação nesses incidentes, pois podem causar sangramento, síndrome compartimental, necrose muscular e lesão renal aguda, resultando em sequelas anatômicas ou funcionais significativas. Nestes casos, o tratamento específico é fundamental, principalmente a administração precoce de soro antiveneno para neutralizar as toxinas injetadas3,7.
OBJETIVO
Nesse contexto, o objetivo deste relato é descrever o caso de um paciente submetido a fasciotomia em membro superior após síndrome compartimental aguda secundária a envenenamento botrópico, num momento em que o tempo de internação era restrito devido à pandemia de SARS-CoV-2. Além disso, explora a indicação técnica da fasciotomia descompressiva, bem como sua abordagem para enxerto dermoepidérmico em procedimento cirúrgico subsequente.
RELATO DE CASO
Paciente do sexo masculino, 52 anos, destro, branco, procedente de zona rural (fazenda), foi encaminhado de um centro médico de Jarinu, SP, Brasil, ao Pronto Atendimento do Hospital de Beneficência São Vicente de Paulo (HCSP), no dia 2 de abril de 2021, em Jundiaí, SP - Brasil. Chegou 4 horas após ser picado por cobra Jararaca (Bothrops) na região tenar da mão esquerda, procurando atendimento médico especializado.
Na avaliação inicial, observou-se pequena perfuração na mão esquerda, sem sangramento. O membro superior esquerdo do paciente apresentava-se edemaciado e endurecido até a região cubital, com sistema neurovascular íntegro. O paciente apresentava estado geral estável, sem sinais de cianose ou icterícia, respirando confortavelmente, com leve confusão mental aguda, mas com nível de consciência preservado. Não houve déficits neurológicos ou ptose. Sua frequência cardíaca era de 85bpm e sua pressão arterial era de 90/60mmHg. A avaliação neurológica foi desafiadora devido à intoxicação.
O manejo inicial foi realizado no pronto-socorro, que incluiu hidratação intravenosa, alívio da dor, corticoterapia, suporte clínico, além de monitorização hemodinâmica e neurológica. Os exames laboratoriais iniciais mostraram aumento progressivo de níveis de creatina fosfoquinase (2.782U/L), tempo e atividade de protrombina prolongados (INR: 1,78) e trombocitopenia grave (18.000/mm3).
Entretanto, não foi necessária transfusão sanguínea, pois os valores melhoraram após o tratamento inicial. Não houve evidência de acidose metabólica (pH 7,37), lesão renal aguda (Cr 0,88mg/dl) ou distúrbios eletrolíticos (sódio 137mEq/L; potássio 5,0mEq/L; cálcio 1,18mmol/L). O Centro de Informação e Assistência Toxicológica de Campinas (CIATox) foi consultado e recomendou a administração de soro antibotrópico, dose única de 120mL, com infusão programada para 7 horas após o evento inicial.
Durante a avaliação de acompanhamento, após 2 horas, o paciente apresentou dor intensa que não respondeu à analgesia com opioides. Foram observadas lesões bolhosas e limitação de movimentos, como extensão e flexão do cotovelo. Apesar de receber soro antiveneno, o edema continuou a se espalhar para a região axilar.
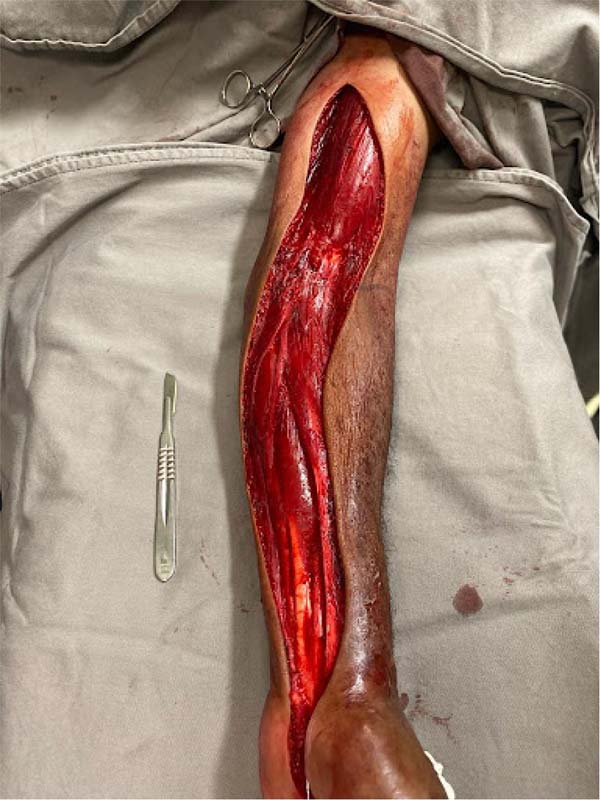
Devido ao agravamento do quadro clínico, acompanhado de parestesia e paresia, foi diagnosticada síndrome compartimental aguda. Consequentemente, foi indicada fasciotomia do membro superior esquerdo após 16 horas. O procedimento cirúrgico consistiu em incisão única na pele e tecido subcutâneo com bisturi frio, iniciando na região palmar da mão, continuando na superfície anterior do antebraço e terço médio do braço, seguindo as linhas naturais de tensão da pele. A hemostasia foi alcançada e a fáscia muscular tensa foi liberada com tesoura de Metzenbaum. Nenhuma evidência de necrose muscular foi observada durante a cirurgia, eliminando a necessidade de incisões adicionais de fasciotomia (Figura 1).
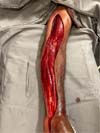
Durante o pós-operatório imediato na unidade de terapia intensiva, o paciente apresentou estabilidade clínica e melhora gradual da dor, edema e parestesia, mas continuou com extensão limitada dos movimentos dos braços e dedos. Após 12 dias (14 de abril de 2021), foi realizada enxertia dermoepidérmica na área cruenta (Figura 2).
O paciente evoluiu sem sinais de infecção ou coleção, com integração adequada do enxerto. Durante reavaliação ambulatorial pós-operatória tardia (5 meses após o procedimento cirúrgico), o paciente queixou-se de extensão limitada do cotovelo esquerdo. Optou-se por reavaliar o assunto devido à hipótese diagnóstica de contração do enxerto.
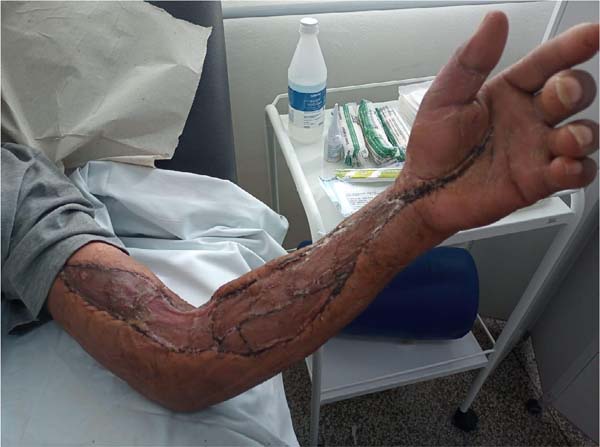
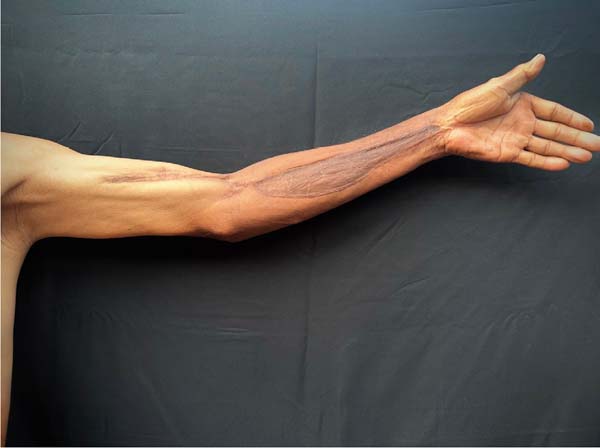
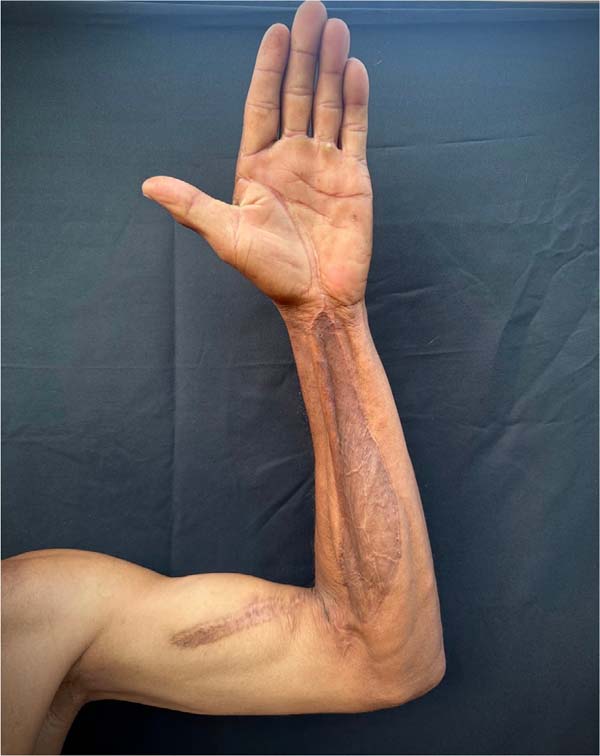
No dia 27 de outubro de 2021 foi realizada excisão parcial da área de enxerto de pele do braço e região cubital (áreas fibróticas), com confecção de 2 retalhos de zetaplastia. O paciente manteve-se clínica e hemodinamicamente estável, sem queixas, e recebeu alta hospitalar para acompanhamento ambulatorial. Durante a consulta de seguimento, observou-se o retorno da funcionalidade do membro superior esquerdo, sem novas indicações cirúrgicas (Figuras 3 e 4).
DISCUSSÃO
No Brasil, os acidentes ofídicos continuam sendo um problema de saúde pública e são considerados a segunda causa mais frequente de intoxicação humana, perdendo apenas para as intoxicações relacionadas a medicamentos8. O veneno é injetado no corpo através das presas após a picada de cobra. A toxina secretada consiste em misturas complexas de proteínas (90 a 95% do total), peptídeos, aminoácidos, lipídios, carboidratos, enzimas (como acetilcolinesterase, proteases, colagenases, fibrogenases, entre outras), compostos inorgânicos e cátions, que determinam um perfil bioquímico e toxicológico com ampla gama de manifestações clínicas4,9.
Esses compostos têm como alvo receptores celulares, proteínas de membrana e coagulação. A ação do veneno de Bothrops resulta principalmente em citotoxicidade, miotoxicidade e hemotoxicidade no corpo humano. Isto leva à hemólise, destruição de células musculares, miócitos e linfócitos, necrose tecidual, aumento da permeabilidade vascular e interferência no sistema de coagulação. As possíveis consequências desse processo incluem lesão renal aguda, falência de órgãos, hemorragia local ou sistêmica, hipotensão, rabdomiólise e síndrome compartimental aguda.
A investigação desta toxina levou não só ao desenvolvimento de tratamentos para envenenamento, mas também a avanços farmacêuticos, como a produção de captopril e outras terapias4,9.
As medidas de primeiros socorros após uma picada de cobra envolvem retirar o paciente do local e transferi-lo para um centro médico apropriado, imobilizando e descansando o membro afetado. A identificação da cobra só é aconselhada se puder ser feita em ambiente seguro, sem atrasar o atendimento médico, sendo recomendável tirar foto digital para identificação. Além disso, é aconselhável retirar joias do membro afetado devido ao risco aumentado de síndrome compartimental10-12.
No ambiente intra-hospitalar, a abordagem envolve o manejo dos sinais vitais e atenção ao risco de sangramento e choque (hipovolemia por hemorragia secundária a coagulopatia, ação de toxinas ou edema da área afetada). A infusão inicial de solução cristaloide pode ser iniciada ou avançada para transfusão sanguínea com base em parâmetros laboratoriais (hemograma completo).
O tratamento específico consiste na administração precoce e direcionada de soro antibotrópico quando há suspeita do agente. Países tropicais com alta incidência de acidentes envolvendo animais peçonhentos, como a Austrália, utilizam kits combinados de detecção de veneno para esse fim, para identificar o animal mais provável. Entretanto, esse teste não está disponível no Brasil e métodos clínicos são utilizados para distinção10-12.
Dentre os desfechos potenciais, a síndrome compartimental se destaca por sua rápida progressão e morbidade significativa, incluindo mionecrose, amputação de membros, neuropatia e até morte, embora a incidência relatada seja baixa (6,6%)13. A maioria dos casos ocorre nos membros superiores, correspondendo a 69,6%, conforme observado neste relato14.
A fisiopatologia da síndrome compartimental envolve aumento da pressão dentro dos compartimentos musculares, que são circundados por fáscia. Essa pressão ultrapassa a pressão de perfusão tecidual e obstrui o retorno venoso no membro afetado, resultando em isquemia e dano celular.
Inicialmente, há dor desproporcional em relação à extensão da lesão, além de alteração na condução nervosa, levando a parestesia e fraqueza muscular quando a pressão do compartimento excede 30mmHg ou quando o gradiente de pressão diastólica dentro do compartimento cai abaixo de 30mmHg. Posteriormente, desenvolve-se isquemia, levando à necrose tecidual.
O monitoramento pode ser feito medindo diretamente a pressão intracompartimental ou avaliando parâmetros clínicos.
É crucial destacar que qualquer compartimento muscular tenso e doloroso após uma lesão pode indicar uma potencial síndrome compartimental. Reavaliações regulares, avaliação cirúrgica especializada e posterior liberação compartimental são necessárias nesses casos15,16.
A fasciotomia precoce, idealmente nas primeiras 4 horas do início dos sintomas clínicos, é o tratamento definitivo e reduz a necessidade de amputações. As indicações para o procedimento incluem forte suspeita clínica ou medição da pressão compartimental para confirmar a presença de síndrome compartimental aguda.
A cirurgia deve ser realizada em centro cirúrgico, mas nos casos em que pacientes instáveis não podem ser transportados, pode ser benéfico realizar o procedimento em unidade de terapia intensiva com sedação leve e anestesia local. O objetivo é dissecar cuidadosamente o membro afetado ao longo de planos específicos, liberando a fáscia muscular tensa sob visualização direta e, posteriormente, aliviando a pressão compartimental. Após o procedimento, é importante avaliar a integridade e a aparência dos músculos, tendo cuidado com a síndrome de reperfusão.
Após a resolução da síndrome compartimental, é necessário considerar opções de reconstrução da ferida operatória. Essas opções incluem fechamento primário precoce, aproximação gradual da ferida (a “Técnica Lace”), terapia com pressão negativa (TPN) e enxerto de pele de espessura parcial16-19. De acordo com a literatura, até o momento não se chegou a um consenso sobre o melhor método de fechamento19. Consequentemente, a técnica escolhida varia de acordo com a preferência do cirurgião e o contexto em que o paciente está inserido20.
Em nosso caso, o paciente não foi considerado adequado para fechamento primário precoce, pois estava no pós-operatório com hérnia muscular significativa e alto risco de recorrência da síndrome compartimental18. O uso da TPN e da técnica de aproximação gradual da ferida foi limitado pela necessidade para uma internação hospitalar prolongada17,20.
Esses procedimentos não foram viáveis devido ao contexto da pandemia de SARS-CoV-2, quando todos os recursos humanos e materiais estavam direcionados aos pacientes com COVID-19. Além disso, a TNP apresentou a limitação adicional de seu custo consideravelmente elevado, principalmente em hospitais carentes de recursos, como os integrados ao sistema público de saúde (Sistema Único de Saúde - SUS).
CONCLUSÃO
Acidentes envolvendo animais peçonhentos, embora categorizados como doenças tropicais negligenciadas, permanecem altamente prevalentes no Brasil, resultando em baixas taxas de letalidade, mas em morbidade significativa. Uma complicação notável é a síndrome compartimental aguda, uma condição que avança rapidamente e que deve ser levada em conta em tais acidentes. A identificação e o tratamento precoces desta complicação, com ênfase em reavaliações regulares por cuidados médicos especializados, são cruciais para resultados favoráveis. Embora a literatura recomende um tempo máximo ideal de 4 horas, o procedimento foi eficaz na prevenção de maiores morbidades em nosso paciente, mesmo sendo realizado além do tempo recomendado.
Dada a falta de consenso sobre a melhor técnica, a experiência do cirurgião e o contexto do paciente determinam a abordagem mais adequada. Além disso, o acompanhamento pós-operatório é crucial para identificar e tratar possíveis complicações tardias, incluindo deiscência de sutura, necrose tecidual e contraturas cicatriciais.
REFERÊNCIAS
1. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Boletim Epidemiológico [Internet]. Volume 53. Brasília: Secretaria de Vigilância em Saúde; 2022. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/edicoes/2022
2. Brasil. Ministério da Saúde [Internet]. Série histórica de acidentes ofídicos - 2000 - 2022. Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/a/animais-peconhentos/acidentes-ofidicos/publicacoes/serie-historica-de-acidentes-ofidicos-2000-2022/view
3. Graciano AR, Carvalho KCN. Síndrome compartimental associada a acidente ofídico por serpente do gênero Bothrops: relato de caso. Rev Pesq Saúde. 2017;18(1):54-6.
4. Gutiérrez JM, Calvete JJ, Habib AG, Harrison RA, Williams DJ, Warrell DA. Snakebite envenoming. Nat Rev Dis Primers. 2017;3:17063. DOI: 10.1038/nrdp.2017.63
5. de Silva HJ, Kasturiratne A, Pathmeswaran A, Lalloo DG. Snakebite: the true disease burden has yet to be determined. Ceylon Med J. 2013;58(3):93-5.
6. Kasturiratne A, Wickremasinghe AR, de Silva N, Gunawardena NK, Pathmeswaran A, Premaratna R, et al. The global burden of snakebite: a literature analysis and modelling based on regional estimates of envenoming and deaths. PLoS Med. 2008;5(11):e218.
7. Pinho FMO, Pereira ID. Ofidismo. Rev Assoc Med Bras. 2001;47(1):24-9. DOI: 10.1590/S0104-42302001000100026
8. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. [boletim na internet]. Boletim Epidemiológico [Internet]. Volume. 50 nº 11. Brasília: Secretaria de Vigilância em Saúde; 2019 [acesso: 2020 Maio 30]. Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/a/animais-peconhentos/acidentes-por-abelhas/arquivos/boletim-epidemiologico-11-vol-50-mar-2019-acidentes-de-trabalho-por-animais-peconhentos-entre-trabalhadores-do-campo-floresta-e-aguas-brasil-2007-a-2017.pdf/view
9. Waheed H, Moin SF, Choudhary MI. Snake Venom: From Deadly Toxins to Life-saving Therapeutics. Curr Med Chem. 2017;24(17):1874-91.
10. Severyns M, Nevière R, Resiere D, Andriamananaivo T, Decaestecker L, Mehdaoui H, et al. Case report: Bothrops lanceolatus snakebite surgical management - Relevance of fasciotomy. Am J Trop Med Hyg. 2018;99(5):1350-3.
11. Russell JJ, Schoenbrunner A, Janis JE. Snake Bite Management: A Scoping Review of the Literature. Plast Reconstr Surg Glob Open. 2021;9(4):e3506.
12. White J. Snakebite worldwide: Management. In: Danzl DF, Wiley JF, eds. Waltham: UpToDate; 2021. [acesso 2021 Dez 29]. Disponível em: https://www.uptodate.com/contents/snakebites-worldwide-management
13. Valente-Aguiar MS, Gonçalves da Costa E Silva B, Magalhães T, Dinis-Oliveira RJ. Compartment Syndrome following Bothrops Snakebite Leads to Decompressive Fasciotomies. Case Rep Med. 2019;2019:6324569.
14. Kim YH, Choi JH, Kim J, Chung YK. Fasciotomy in compartment syndrome from snakebite. Arch Plast Surg. 2019;46(1):69-74.
15. Hamdi MF, Baccari S, Daghfous M, Tarhouni L. Upper limb compartment syndrome after an adder bite: a case report. Chin J Traumatol. 2010;13(2):117-9.
16. Chung KC, Yoneda H, Modrall G. Pathophysiology, classification, and causes of acute extremity compartment syndrome. In: Butler CE, ed. UpToDate. Waltham: UpToDate; 2023. [acesso 2022 Jan 10]. Disponível em: https://www.uptodate.com/contents/pathophysiology-classification-and-causes-of-acute-extremity-compartment-syndrome.
17. Galli R, Baptista RR, Barreiro GC, Reis JOG, Fortes FSG, Ferreira MC. Tratamento cirúrgico dos defeitos complexos causados por acidentes por animais peçonhentos. Rev Bras Cir Plást. 2011;26(3):9.
18. Igoumenou VG, Kokkalis ZT, Mavrogenis AF. Fasciotomy Wound Management. In: Mauffrey C, Hak DJ, Martin III MP, eds. Compartment Syndrome: A Guide to Diagnosis and Management. Cham: Springer; 2019. DOI: 10.1007/978-3-030-22331-1_9
19. Alkhalifah MK, Almutairi FSH. Optimising Wound Closure Following a Fasciotomy: A narrative review. Sultan Qaboos Univ Med J. 2019;19(3):e192-e200. DOI: 10.18295/squmj.2019.19.03.004
20. Jauregui JJ, Yarmis SJ, Tsai J, Onuoha KO, Illical E, Paulino CB. Fasciotomy closure techniques. J Orthop Surg (Hong Kong). 2017;25(1):2309499016684724. DOI: 10.1177/2309499016684724
1. Hospital São Vicente de Paulo, Jundiaí,
Jundiaí, SP, Brasil
2. Faculdade de Medicina de Jundiaí, Jundiaí, SP,
Brasil
Autor correspondente: Alexandre Venâncio de Sousa Rua São Vicente de Paulo, 223, Centro, Jundiaí, SP, Brasil, CEP: 13201-625, E-mail: alexandrevenancio@gmail.com
Artigo submetido: 17/07/2023.
Artigo aceito: 05/12/2023.
Conflitos de interesse: não há.




 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter