

Review Article - Year 2025 - Volume 40Issue 1
Infecções em feridas em queimados: Revisão de 35 anos de avanços, desafios diagnósticos e estratégias baseadas em evidências
Burn Wound Infections: A 35-year Review of Advances, Diagnostic Challenges, and Evidence-based Strategies
RESUMO
Introdução As queimaduras graves representam um problema crítico de saúde pública, com altas taxas de mortalidade e morbidade associadas às infecções em feridas, a principal causa de morte nesses pacientes. Este artigo tem como objetivo fazer uma abordagem abrangente baseada em evidências ao diagnóstico e manejo de infecções invasivas em feridas por queimaduras, destacando avanços científicos recentes e estratégias clínicas eficazes.
Materiais e Métodos Foi realizada uma revisão abrangente de 35 anos de literatura científica utilizando bases de dados reconhecidas, como PubMed, EMBASE e Cochrane Library. As informações foram sintetizadas e validadas por um comitê de especialistas em cirurgia e cuidados com queimados. Os termos MESH utilizados foram Queimaduras, Infecção, Infecções em feridas por queimaduras, Sepse, e Multirresistência a medicamentos.
Resultados A análise mostra que mais de 45% dos pacientes com queimaduras graves desenvolvem infecções. A fisiopatologia inclui imunossupressão secundária ao hipermetabolismo e à desregulação inflamatória, que predispõe os pacientes a infecções por microrganismos multirresistentes. Biomarcadores como a procalcitonina e estratégias baseadas em culturas específicas melhoram a precisão diagnóstica. A implementação de protocolos personalizados reduz as complicações e a mortalidade nessa população.
Conclusão Este estudo estabelece um guia baseado em evidências para o diagnóstico precoce e manejo eficaz das infecções em queimaduras, promovendo o uso racional de antibióticos e cuidados abrangentes. Os achados contribuem para a padronização das práticas clínicas, otimização dos recursos hospitalares e melhora dos desfechos clínicos. Esta revisão é uma referência crucial para o avanço no cuidado de pacientes queimados e estímulo de futuras pesquisas na área.
Palavras-chave: queimaduras; unidades de queimados; cirurgia plástica; sepse; infecções bacterianas; resistência microbiana a medicamentos
ABSTRACT
Introduction Severe burns represent a critical public health issue, with high mortality and morbidity associated with wound infections, which are the leading cause of death in these patients. The present article aims to provide a comprehensive evidence-based approach for the diagnosis and management of invasive burn wound infections, highlighting recent scientific advances and effective clinical strategies.
Materials and Methods A thorough review of 35 years of scientific literature was conducted using recognized databases such as PubMed, EMBASE, and Cochrane Library. The information was synthesized and validated by a committee of experts in surgery and burn care. The medical subject heading (MESH) terms used were: Burns, Infection, Burn wound infections, Sepsis, and Multi-drug resistant.
Results The analysis shows that more than 45% of patients with severe burns develop infections. The pathophysiology includes immunosuppression secondary to hypermetabolism and inflammatory dysregulation, which predispose patients to infections by multidrug-resistant microorganisms. Additionally, biomarkers such as procalcitonin and strategies based on specific cultures improve diagnostic accuracy. The implementation of personalized protocols reduces complications and mortality in this population.
Conclusion The present study establishes an evidence-based guide for the early diagnosis and effective management of burn infections, promoting the rational use of antibiotics and comprehensive care. The findings contribute to standardizing clinical practices, optimizing hospital resources, and improving clinical outcomes. This review serves as a crucial reference for advancing burn patient care and fostering future research in the field.
Keywords: burns; burn units; surgery department; sepsis; hospital infections; drug resistance
Introdução
A Organização Mundial da Saúde (OMS) estima que aproximadamente 180 mil pessoas falecem a cada ano devido a queimaduras, um problema que afeta predominantemente países de baixa e média renda. Além dos óbitos, as queimaduras não letais são uma causa significativa de morbidade, deixando milhares de pessoas com sequelas físicas e psicológicas que afetam sua qualidade de vida. Esses incidentes são frequentes em ambientes cotidianos, como residências e locais de trabalho, nos quais os riscos são elevados e as medidas de segurança muitas vezes são insuficientes. Apesar da gravidade, a maioria das queimaduras nesses ambientes pode ser prevenida com estratégias adequadas e educação em segurança.
Em países de baixa e média renda, as queimaduras estão entre as principais causas de perda de anos de vida ajustados por incapacidade. A hospitalização por queimaduras varia de acordo com o país e os programas de saúde. No entanto, estudos indicam uma tendência global de internações hospitalares mais curtas e aumento do tratamento de queimaduras em centros especializados em muitos países.1
Em pacientes com queimaduras graves, as infecções representam uma das principais ameaças à vida, especialmente naqueles que sobreviveram à primeira fase de ressuscitação. Nesse contexto, as infecções não só se tornam a principal causa de mortalidade, como também são desafios diagnósticos e terapêuticos complexos. Logo, este documento é essencial para explorar vários aspectos críticos relacionados às infecções invasivas em feridas por queimadura.
Os pacientes queimados sofrem alterações fisiológicas específicas decorrentes do trauma térmico. A resposta inflamatória desencadeada por queimaduras inerentemente provoca imunossupressão, aumentando o risco de infecções e acometimento do tecido danificado. Além disso, as diversas complicações infecciosas e suas possíveis manifestações representam desafios para o diagnóstico e tratamento oportunos.2Por fim, propomos estratégias específicas para o manejo clínico com o objetivo de melhorar os desfechos prognósticos neste grupo especial de pacientes.
O uso indiscriminado de antibióticos de amplo espectro em pacientes queimados pode ter vários efeitos adversos, como promover a translocação bacteriana, aumentando o risco de infecções em órgãos distantes, como fígado e pulmões.3 Ademais, o uso de antibióticos pode prejudicar a microbiota intestinal, aumentando a permeabilidade intestinal e promovendo ainda mais translocação, comprometendo as defesas do hospedeiro.4 Outro efeito significativo é o aumento do risco de colonização ou infecção por microrganismos multirresistentes por exposição prévia a antibióticos como cefalosporinas de espectro estendido e carbapenens. Esses antibióticos foram associados a um aumento do risco de infecção por bactérias gram-negativas multirresistentes em pacientes com queimaduras graves5e à indução de resistência em enterobacteriaceae, como Escherichia.6 Por outro lado, o uso de antibióticos com alto teor de sódio pode contribuir para a hipernatremia em pacientes com queimaduras graves, dificultando ainda mais o manejo clínico desses indivíduos.7
Assim, a infecção da ferida por queimadura é a complicação mais grave, pois prolonga significativamente a hospitalização e piora os desfechos estéticos e funcionais. Também aumenta consideravelmente as sequelas e os custos devido à necessidade de outras cirurgias, anestesia, antibióticos e tempo de internação hospitalar, aumentando o risco de mortalidade do paciente de forma significativa.8
Outros sítios exigem estudos extensos para localização da infecção, mas, em pacientes queimados, o sítio infeccioso primário, ou seja, a pele lesionada, é facilmente acessível. Desta forma, exames físicos diários permitem a detecção precoce e a antecipação da progressão da infecção. O diagnóstico e o tratamento oportunos são cruciais para prevenir a disseminação da infecção e as características clínicas visíveis são essenciais para identificar o problema antes da disponibilização dos resultados laboratoriais. Portanto, exames físicos seriados realizados por um profissional treinado são essenciais para o sucesso.8
Materiais e Métodos
Este estudo é uma revisão sistemática da literatura disponível nos últimos 35 anos com foco em infecções invasivas em queimaduras. A metodologia foi desenvolvida conforme as seguintes etapas:
Fontes de informação: Bases de dados com reconhecimento internacional, como PubMed, EMBASE e Cochrane Library, foram utilizadas, além de diretrizes e recomendações da International Society for Burn Injuries, da American Burn Association e de outras organizações especializadas.
Critérios de inclusão e exclusão: Estudos publicados entre 1988 e 2024 que abordassem epidemiologia, fisiopatologia, diagnóstico e manejo de infecções em pacientes queimados foram incluídos. Artigos revistos por pares, diretrizes clínicas, meta-análises e coortes prospectivas foram priorizados. Estudos com amostras insuficientes, sem acesso ao texto completo ou que não atendessem aos padrões de qualidade metodológica foram excluídos.
Processo de seleção: Os títulos e resumos identificados durante a primeira busca foram avaliados por dois revisores independentes. Os trabalhos que atenderam aos critérios foram analisados em profundidade. As discrepâncias foram resolvidas por consenso com um terceiro revisor.
Síntese de dados: Os dados extraídos foram categorizados em quatro áreas principais:
Epidemiologia e fatores de risco;
Fisiopatologia;
Ferramentas diagnósticas (biomarcadores, culturas);
Estratégias terapêuticas (uso racional de antibióticos).
Validação e revisão: O conteúdo foi apresentado e discutido com um grupo multidisciplinar de especialistas em cirurgia e tratamento de queimados, que realizaram os ajustes finais para garantir a aplicabilidade clínica dos achados. Essa metodologia permitiu a integração do conhecimento atual com as práticas clínicas, fornecendo uma estrutura sólida para a criação de um guia baseado em evidências.
Epidemiologia
A incidência de infecções em feridas de pacientes queimados varia de acordo com o estudo e a população analisada. Um estudo retrospectivo realizado em uma unidade de terapia intensiva de queimados constatou que 45,8% dos pacientes desenvolveram infecções, com uma taxa de infecção de 45,8 por mil pacientes-dia.9 A progressão das infecções para sepse é um fenômeno significativo. Segundo Belba et al., a prevalência de sepse em pacientes adultos queimados foi de 26%, com uma incidência acumulada de 30 pacientes por cem adultos.10 As maiores taxas de infecções por queimaduras ocorrem nos membros inferiores, mas patógenos específicos não se limitam a nenhuma localização anatômica em especial.11
Pacientes queimados também apresentam altas taxas de outros tipos de infecções, como infecções relacionadas a cateteres, bacteremia e pneumonia, embora as infecções de feridas sejam as mais comuns.11,12 Em um estudo com uma coorte de 175 pacientes com queimaduras graves, as infecções da ferida precederam a disfunção multiorgânica em 83% dos indivíduos e foram consideradas a causa direta de morte em 36% dos óbitos.13 Estudos têm relacionado a infecção em geral como a principal causa de mortalidade em pacientes queimados, sendo responsável, direta ou indiretamente, por 33 a 80% dos óbitos.14,15
Fisiopatologia
Qualquer tipo de ferida desencadeia uma série de eventos celulares e bioquímicos com o objetivo final de fechamento da lesão. A cicatrização pode ser dividida em três fases sobrepostas: inflamação, proliferação e remodelamento.16
O tempo de restituição tecidual varia conforme o grau da queimadura, que influencia diretamente o resultado estético e aumenta a exposição do tecido normalmente protegido pela epiderme, tornando-o mais suscetível à infecção.
Superficial (grau I): Acomete apenas a epiderme, como ocorre nas queimaduras solares, que cicatrizam em 7 a 10 dias.
Espessura parcial superficial e profunda (grau II): Acomete vários graus da derme. Quando superficial, é denominada tipo A, com cicatrização sem sequelas significativas em menos de 14 dias. Ao atingir a derme intermediária, é considerada tipo AB, com cicatrização após 18 dias, gerando cicatrizes de baixa qualidade, com aparecimento de queloides, hiper ou hipopigmentação e retrações.
Espessura total (grau III): Destrói toda a derme, impedindo a epitelização. Também é conhecida como tipo B e cicatriza por segunda intenção, exigindo desbridamento até a obtenção do tecido de granulação e enxerto.
Grau IV: Destrói estruturas musculares e/ou ósseas e, de modo geral, é decorrente de queimaduras elétricas.
A infecção em uma queimadura pode até mesmo comprometer a derme não atingida pela lesão inicial, impedindo a epitelização e agravando a lesão. Por exemplo, uma queimadura superficial de segundo grau pode se aprofundar rapidamente se não for tratada de maneira adequada e se transformar em uma queimadura de espessura total em poucos dias, prolongando o tempo de recuperação e exigindo desbridamento e enxerto em vez de cicatrizar em menos de 15 dias.8
Um efeito importante das queimaduras é a resposta inflamatória desregulada, que pode progredir para um estado de imunossupressão. Em modelos experimentais com camundongos com queimaduras, populações de leucócitos de camundongos gravemente queimados transferidas para camundongos saudáveis alteraram o reconhecimento de patógenos e afetaram negativamente o equilíbrio entre linfócitos T reguladores e linfócitos T auxiliares.17
Bioquimicamente, em resposta à lesão tecidual, há ativação de moléculas que desencadeiam o sistema imunológico, em especial os padrões moleculares associados a danos (DAMPs, do inglês damage-associated molecular patterns) e os padrões moleculares associados a patógenos (PAMPs, do inglês pathogen-associated molecular patterns). Um exemplo destes últimos inclui lipopolissacarídeos da parede celular de bactérias gram-negativas, RNA de fita dupla viral e flagelina. A princípio, os DAMPs emergem como proteínas intracelulares, ácido úrico, DNA extracelular e ATP liberados pelas células afetadas no tecido queimado; os DAMPs entram na circulação sistêmica e ativam sinais de reconhecimento mediados por receptores Toll-like (TLRs, do inglês toll-like receptors). Os TLRs são moléculas expressas em leucócitos circulantes e em várias células cutâneas, incluindo queratinócitos, células de Langerhans, linfócitos T e B, mastócitos, células endoteliais, miofibroblastos e fibroblastos primários. Sua função primária é a estimulação imunológica para a secreção de citocinas para proteger o tecido danificado de possíveis infecções e participar do reparo da pele danificada. Em queimaduras graves, esse processo atinge níveis extremos, afetando o sistema imunológico, interferindo na cicatrização e aumentando o risco de infecção. Essa perturbação da homeostase é diretamente proporcional à gravidade e à extensão da queimadura, podendo desencadear uma tempestade de citocinas e paralisia do sistema imunológico, diminuindo a produção de interleucinas (IL)-6 e IL-12 e, assim, reduzindo a apresentação de antígenos e a proliferação de linfócitos T, dois processos essenciais em uma resposta imune regulada. Esse processo inflamatório pode progredir para a síndrome de falência múltipladeórgãosemorte.1,17,18 Um estudo de queimaduras de grande porte revelou que a área total da superfície corporal queimada acima de 20% era associada a uma mudança drástica na expressão genética dos leucócitos (80% dos genes), um fenômeno conhecido como “tempestade genômica”.19 Os DAMPs que ativam TLRs e outros receptores de reconhecimento de padrões podem ser classificados em:
1. Proteínas expelidas por lisossomos secretores, como high mobility group box 1 (HMGB1) e galectina 3.
2. Moléculas liberadas por células necróticas, como proteínas S100, HMGB1, IL-1a, galectina 3, HSP60, HSP70, HSP72, histonas e ácidos nucleicos.
3. Moléculas da matriz extracelular, como ácido hialurônico, heparan sulfato, fibronectina e componentes degradados da matriz.
Embora diversos DAMPs tenham sido identificados, em teoria, qualquer molécula que resida normalmente no interior das células e é expelida ou alterada por danos nos tecidos pode atuar como DAMP. Propõe-se que superfícies hidrofóbicas, em geral, atuem como DAMPs.
Os PAMPs, por outro lado, provêm de patógenos e da microbiota cutânea e penetram a derme por meio da barreira epidérmica rompida. Na pele normal, a carga bacteriana foi determinada por reação em cadeia da polimerase quantitativa em tempo real (gene 16S rRNA) nas camadas epidérmicas profundas (biópsias por punch), intermediárias (raspagens) e superficiais (swabs), com obtenção de 10 mil, 50 mil e 1 milhão de unidades formadoras de colônias (CFU, do inglês colony-forming units) por centímetro quadrado, respectivamente,20 de bactérias de diversas espécies.21 Logo, a queimadura na epiderme faz com que esses PAMPs bacterianos, assim como os DAMPs, ativem a sinalização dos TLRs, que converge em uma via comum, com maior potência na área ao redor dos folículos capilares, o microambiente de concentração das bactérias.22 A continuidade da exposição devido ao defeito na barreira epidérmica faz com que os patógenos que colonizam a superfície tenham a oportunidade de se infiltrar na ferida e gerar uma infecção.
A exposição a patógenos ocorre não apenas por meio da ferida de queimadura, mas também de dispositivos invasivos; além disso, a translocação bacteriana do trato gastrointestinal já foi descrita.23 Os microrganismos podem provir da microbiota endógena do paciente (pele, intestino e trato respiratório superior) e de fontes externas contaminadas, como o ambiente hospitalar e os profissionais de saúde. Estes últimos estão associados à contaminação cruzada, o que prolonga o aparecimento e a disseminação da resistência antimicrobiana, representando uma grave ameaça aos cuidados de saúde,24,25 em especial entre pacientes em estado grave.
Por outro lado, o uso indiscriminado de antibióticos, combinado com a perda de água por evaporação da epiderme lesionada, aumenta a concentração de sódio. Um aumento de 10% na concentração de sódio estimula os queratinócitos a secretar maiores quantidades de TLRs, potencializando a resposta inflamatória descrita. A escara da queimadura também contribui para a sinalização inflamatória e a cicatrização, atuando, pelo menos em parte, como um reservatório para DAMPs e PAMPs. Pacientes com queimaduras em mais de 50% da superfície corporal total, com desbridamento total e cobertas em até 3 dias após a lesão, apresentam uma redução de aproximadamente 40% na taxa metabólica basal, prevenindo uma maior perda líquida de proteínas pelo catabolismo muscular e diminuindo a carga bacteriana em culturas, o que reduz o risco de desenvolvimento de sepse em 30% e, consequentemente, a mortalidade.26
Outrofenômenoassociadoàformaçãodeescaras é o desenvolvimento de biofilmes. São comunidades microbianas que aderem à superfície das feridas e são protegidas por uma matriz extracelular, tornando-as resistentes a antibióticos e ao sistema imunológico do hospedeiro.27 O soro de pacientes com queimaduras graves pode aumentar a formação de biofilmes devido ao estresse oxidativo, o que piora as infecções e complica o tratamento da ferida.28
O glicocálice, uma camada gelatinosa que recobre a superfície luminal das células endoteliais vasculares, é composto por proteoglicanos ligados à membrana, cadeias de glicosaminoglicanos, glicoproteínas e proteínas plasmáticas anexas e desempenha um papel crucial na homeostase vascular ao regular a permeabilidade e o tônus microvascular, o que previne a trombose e modula a adesão de leucócitos.29 A degradação dessa estrutura protetora, conhecida como “descamação”, exacerbada pela resposta inflamatória e pelo estresse oxidativo associados ao trauma térmico em pacientes com queimaduras graves, aumenta a permeabilidade vascular, facilitando diretamente a invasão microbiana (formação de biofilme) e, de forma indireta, permitindo o acesso de células imunes e agentes nocivos (como proteases e espécies reativas de oxigênio), que potencializam o dano endotelial e predispõem a infecções. A disfunção endotelial se manifesta pela liberação de componentes como sindecam 1 e heparan sulfato na corrente sanguínea, o que tem sido correlacionado à gravidade da queimadura.27-30 Esta liberação é mais pronunciada em pacientes idosos e naqueles com queimaduras de maior extensão, sugerindo uma relação entre a gravidade da lesão e o grau de eliminação do glicocálice.31
Fatores de Risco
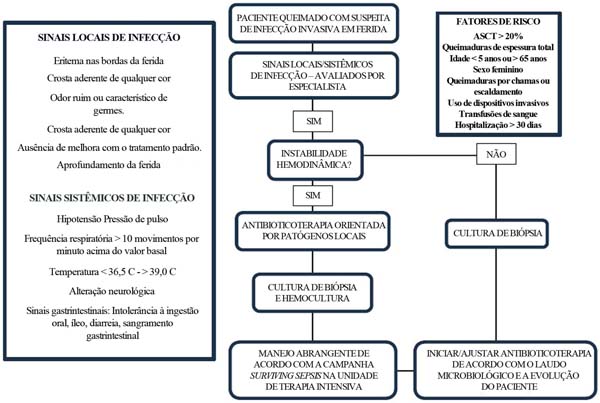
Os pacientes queimados são mais predispostos a infecções devido à perda da integridade cutânea, imunossupressão e necessidade de procedimentos invasivos. Diversos estudos descreveram os fatores de risco para infecções nesses pacientes, que podem ser classificados em três grupos principais.
1. Fatoresrelacionadosaopaciente: Idade avançada: a idade baixa (< 5 anos) e a avançada têm sido associadas a um maior risco de infecções em pacientes queimados. O risco aumenta a partir dos 50 anos e atinge o pico aos 65 anos.32
Sexo feminino: O sexo feminino foi identificado como um fator preditivo independente de infecções em pacientes queimados e, de modo geral, associado queimaduras por tarefas domésticas.33
2. Extensão e profundidade da queimadura:
Área total da superfície corporal queimada: Uma queimadura maior que 20% da área total da superfície corporal está significativamente associada a um maior risco deinfecções.34 Queimaduras de espessura total: A presença de queimaduras de espessura total é um fator de risco independente para infecções de feridas.32
Lesão por inalação: A lesão por inalação aumenta o risco de infecções associadas aos cuidados médicos, como pneumonia associada à assistência médica.34
3. Intervenções hospitalares:
Uso de cateteres: A inserção de cateteres urinários, arteriais e venosos centrais está associada a um maior risco de colonização e infecção por microrganismos gram-negativos multirresistentes. O uso de cateteres venosos centrais também foi identificado como um fator de risco independenteparainfecções.35,36 Ventilação mecânica: A ventilação mecânica é um fator de risco significativo para infecções respiratórias em pacientes com queimaduras graves.36
Transfusões de sangue: A administração de hemoderivados está associada a um maior risco de infecções.33-36 Duração da hospitalização: A hospitalização prolongada (> 30 dias) está relacionada a um maior risco de infecção, incluindo bacteremia e fungemia.37,38
4. Outros fatores:
Sepse: A presença de sepse é um fator preditivo independente de infecções recorrentes em pacientes com queimaduras.33
Intervenções cirúrgicas: Procedimentos como a excisão de queimaduras e os enxertos de pele aumentam o risco de infecções recorrentes.33
Hidroterapia: A hidroterapia tem sido associada a um maior risco de infecções.38
A gravidade sistêmica de uma queimadura é, portanto, multifatorial. Uma queimadura de 40% da superfície corporal total, por exemplo, apresenta um risco de mortalidade de 11% em um paciente de 20 anos, enquanto a mesma queimadura em um paciente de 65 anos tem risco de mortalidade superior a 80%.37 A identificação e gestão destes fatores de risco é crucial para melhorar os desfechos clínicos e reduzir a incidência de infeções nesta população vulnerável.
Abordagem Diagnóstica
Existem critérios bem-definidos para o diagnóstico de diversas infecções em pacientes não queimados. No entanto, no trauma por queimadura, como já mencionado, há o desencadeamento de uma resposta hipermetabólica que difere de qualquer outro tipo de lesão. A temperatura basal normal em um paciente com queimaduras graves, por exemplo, sobe para 38,5 C em vez dos 37,5 C observados em pacientes típicos. Foi identificado um aumento no metabolismo de até 180%26 e as frequências cardíaca e respiratória podem continuar elevadas por semanas ou até meses. Considerando esses fatores, a American Burn Association realizou uma reunião de consenso em 2007 sobre sepse em pacientes queimados, definindo um guia para estabelecer os critérios de suspeita elevada, descritos a seguir.39
Estudos e classificações subsequentes foram desenvolvidos para buscar critérios com melhor desempenho diagnóstico para sepse em pacientes queimados. Em 2018, Yan et al.38 publicaram um estudo de coorte prospectiva com o objetivo de validar os escores atuais de sepse em pacientes queimados. Esse estudo avaliou a precisão de três escalas de critérios diagnósticos de sepse para pacientes queimados e comparou os resultados: os critérios da American Burn Association (ABA) de 2007, os preditores de sepse de Mann- Salinas de 2013 e a definição Sepsis-3 de 2016 da Campanha Surviving Sepsis. O estudo incluiu 418 pacientes com queimaduras graves tratados em um hospital em Toronto entre 2006 e 2016, dos quais 21% desenvolveram sepse. Os diagnósticos de sepse foram feitos de forma prospectiva, considerando sinais clínicos específicos e critérios selecionados para comparação de suas capacidades preditivas.
Os resultados indicaram que os critérios Sepsis-3 apresentaram a maior acurácia, identificando 85% dos casos de sepse, em comparação a 59% dos critérios da ABA e 28% dos critérios de Mann-Salinas. No entanto, nenhum dos critérios avaliados demonstrou confiabilidade suficiente para ser um padrão diagnóstico para essa população específica. Os autores recomendam que o diagnóstico de sepse em pacientes queimados seja baseado em uma avaliação clínica abrangente realizada por uma equipe especializada em tratamento de queimaduras ao invés de se basear apenas em critérios preditivos.38
É essencial que o cirurgião responsável pelo tratamento tenha treinamento para identificar clinicamente uma queimadura infectada, pois o diagnóstico precoce e preciso é crucial para evitar complicações graves. A compreensão dos conceitos essenciais permite diferenciar o curso normal da cicatrização da ferida e os sinais indicativos de infecção, dando aos médicos as ferramentas necessárias para discernir a presença de infecção de forma eficaz. Essa habilidade melhora os desfechos do tratamento, contribui para uma melhor gestão de recursos e evita intervenções desnecessárias. Portanto, é crucial definir conceitos fundamentais que alterarão a evolução terapêutica do paciente.
- Colonização: Refere-se à presença de menos de 100 mil germes por grama de tecido, sem evidência de invasão ou sinais sistêmicos de infecção. Essa colonização pode ter efeitos benéficos, pois pode estimular fatores de crescimento, citocinas e a resposta imune celular.
- Infecção não invasiva: Caracterizada pela presença de mais de 100 mil germes por grama, mas sem invas ão do tecido saudável subjacente. Essa carga bacteriana pode causar deterioração da ferida ou falha na integração do enxerto. O paciente é considerado infectado e deve ser avaliado quanto ao risco de infecção invasiva e sepse.
- Infecção invasiva de ferida por queimadura: Refere-se a uma ferida com sinais locais ou sistêmicos de infecção, mais de 100 mil germes por grama de tecido e comprometimento do tecido saudável subjacente.
- Celulite: Processo inflamatório na área da ferida caracterizado por eritema e edema que ultrapassam os limites normais. De modo geral, a celulite é associada a outros sinais locais e sistêmicos.
- Ectima gangrenoso: Apresenta-se como úlceras necróticas com bordas bem-definidas e halo inflamatório com origem na base da ferida.
- Impetigo: Lesão tardia observada em áreas previamente epitelizadas, como entre enxertos já integrados ou em sítios doadores que já passaram por epitelização.
Sinais locais de infecção:
Eritema nas bordas da ferida;
Crosta aderente de qualquer cor;
Odor ruim ou característico de germes;
Ausência de melhora com o tratamento padrão;
Aprofundamento da ferida.
Sinais sistêmicos de infecção: Os sinais sistêmicos são semelhantes aos de outras infecções, mas, em pacientes queimados, há considerações especiais para seu diagnóstico e tratamento:
Sinais vitais:
- Pressão arterial: Quedas inexplicáveis na pressão arterial média ou diastólica são sinais de vasodilatação associada à infecção.
- Frequência respiratória: Um aumento de mais de 10 movimentos por minuto acima do valor basal pode indicar infecção.
- Temperatura: Aumentos ou diminuições da temperatura corporal (36,5°-38,5° C) e febre acima de 39° C são indicativos de infecção. A hipotermia sugere um patógeno gram-negativo.
- Sinais neurológicos: Alterações de consciência sem causa justificada podem indicar infecção.
- Sinais gastrintestinais: Intolerância nutricional, íleo sem lesão abdominal, diarreia inexplicável ou sangramento gastrintestinal são sinais de infecção descontrolada.
Pacientes queimados tendem a apresentar leucocitose branda, com valores entre 10 mil e 11 mil células por microlitro. Valores acima de 12 mil exigem investigação de um possível foco de infecção, como necrose sem ressecção ou infecção por cocos gram-positivos, em especial estafilococos.
Por outro lado, a leucopenia é preocupante nesses pacientes, especialmente quando há uma queda repentina no número de leucócitos em relação ao valor basal. Por exemplo, um exame de sangue mostrando 6 mil leucócitos e 60% de neutrófilos pode ser normal em um indivíduo saudável, mas, em um paciente com queimaduras,estes números são baixos. Se 48 horas antes os números eram altos (15 mil leucócitos e 85% de neutrófilos), o posterior desenvolvimento de leucopenia e neutropenia pode indicar sepse associada a microrganismos gram-negativos. No entanto, deve-se observar que a sulfadiazina de prata pode induzir neutropenia e atuar como um fator de confusão.
Por fim, a trombocitopenia com contagem de plaquetas abaixo de 100 mil por microlitro pode indicar infecção por consumo, principalmente em infecções relacionadas ao Staphylococcus aureus, podendo evoluir para coagulação intravascular disseminada.8-40
Biópsia e Cultura de Pele
Técnica cirúrgica: Excisão de um fragmento de pele de 1 cm x 0,5 cm sem tecido subcutâneo e determinação do número de germes por grama de tecido. Uma cultura de biópsia com mais de 100 mil CFU por grama de tecido é considerada critério microbiológico para infecção invasiva.8
Em relação à colonização da ferida, um estudo realizado na unidade de queimados do Hospital Universitario del Valle, Cali-Colombia, com coleta de amostras pareadas, mostrou que a cultura de superfície coincidiu com a cultura da biópsia em apenas ~ 20% dos casos. Isso significa que a administração de antimicrobianos com base em uma cultura de superfície tem risco de erro de quase 80%.41
Além disso, hemoculturas positivas em pacientes queimados não devem ser consideradas contaminantes devido à imunossupressão descrita. Uma hemocultura positiva associada a sinais clínicos de infecção é uma indicação para início do tratamento antimicrobiano específico o mais breve possível. A Infectious Diseases Society of America (IDSA) e a American Society for Microbiology desaconselham a coleta de amostras com swabs por limitações significativas, como: (1) alto risco de contaminação superficial e subcutânea e (2) capacidade limitada da amostra (500 μL), com quantidade insuficiente, especialmente quando culturas não bacteriológicas (fúngicas, micobacterianas) são solicitadas. Além disso, antes de qualquer coleta de amostra ou biópsia, a ferida deve ser completamente limpa e livre de antimicrobianos tópicos e resíduos que possam afetar os resultados da cultura.42
Os aspectos cronológicos aproximados dos processos de colonização e infecção de feridas em queimaduras e as características dos microrganismos envolvidos foram identificados. A princípio, com a flora normal predominantemente composta por cocos gram-positivos, a invasão por bactérias gram-negativas, algumas provenientes do ambiente hospitalar, inicia-se entre 2 e 4 dias. Por fim, fungos, como Candida sp., e bactérias multirresistentes podem invadir a ferida.
Características Clínicas de Cada Patógeno
Alguns patógenos apresentam características clínicas importantes que devem ser detectadas durante o exame físico por ajudarem a levantar suspeitas clínicas antes da obtenção dos resultados laboratoriais.
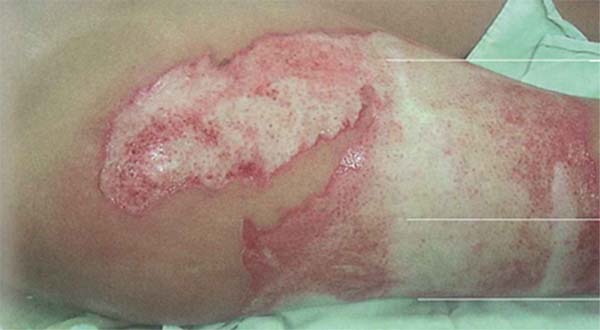
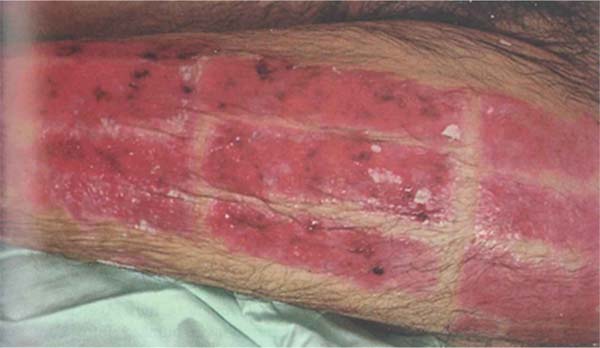
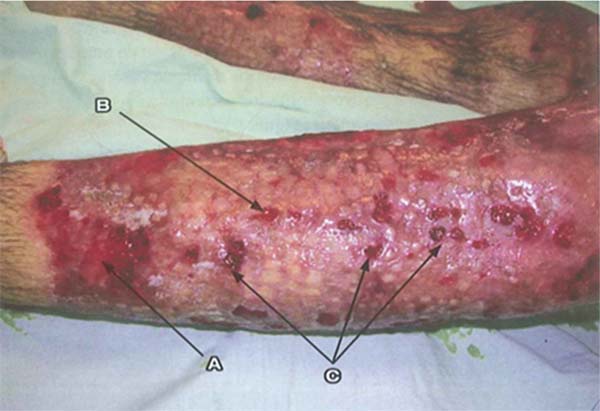
Pseudomonas aeruginosa: Enterobactérias, em particular P. aeruginosa, são caracterizadas pelo início de leucopenia, como já mencionado, que pode progredir para disfunção de múltiplos órgãos. Portanto, se o leucograma for suspeito, mostrando leucopenia, sinais específicos desse patógeno devem ser pesquisados na ferida, como tecido azul/esverdeado ou amarelo/esverdeado intenso (piocianina e pioverdina), petéquias hemorrágicas, fluorescência positiva e odor adocicado característico, descrito como milho ou uva.8 O desenvolvimento de choque séptico grave, acompanhado por uma ferida que se torna cinza, roxa ou preta, é indicativo de infecção invasiva por P. aeruginosa, conhecida como “ectima gangrenoso”. Esses pacientes requerem excisão imediata do tecido acometido, pois a doença está associada a alta mortalidade.43 (►Fig. 1; ►Fig. 2.)
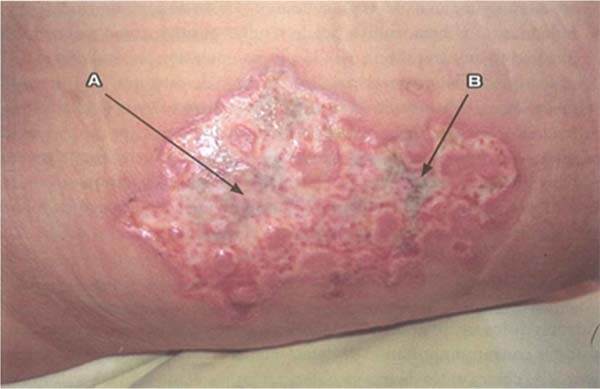
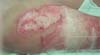
S. aureus: Ao contrário de P. aeruginosa, S. aureus tem progressão mais lenta e é caracterizada por leucocitose em vez de leucopenia. Nos primeiros estágios, a progressão para falência múltipla de órgãos é menos provável. Feridas infectadas por esse patógeno são caracterizadas por achados como palidez e depressão do tecido de granulação e aparecimento de pústulas ou comedões. Essas feridas apresentam múltiplos abscessos pequenos superficiais que tendem a se fundir. Esse tipo de infecção pode levar à ruptura de áreas epitelizadas previamente cicatrizadas e comprometer enxertos já integrados. O tratamento local é composto por limpeza da ferida, desbridamento e aplicação de mupirocina, juntamente com antibioticoterapia sistêmica. (►Fig. 3; ►Fig. 4.)
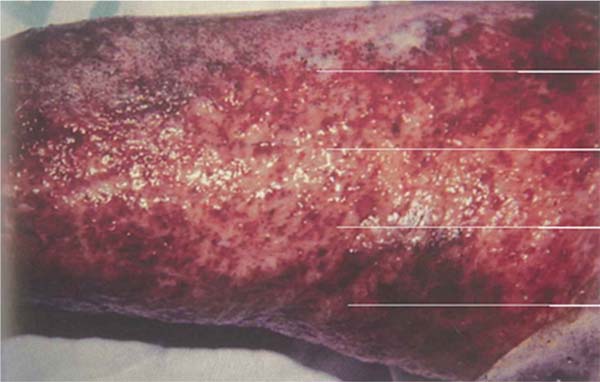
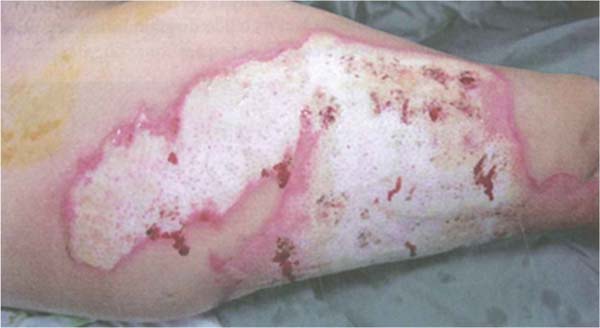
Streptococcus pyogenes: Esta infecção apresenta-se com lesões celulíticas caracterizadas por eritema, edema e hiperestesia na área adjacente à queimadura, área doadora ou área enxertada. Ao acometer uma área enxertada, os enxertos podem parecer destruídos ou ausentes no dia seguinte. A celulite pode ser causada por diversos patógenos, mas, em feridas de queimadura, o microrganismo mais comum é o estreptococo β-hemolítico do grupo A. Esta celulite não deve ser confundida com a celulite precoce relacionada ao trauma, em que há uma reação eritematosa perilesional de 5 mm a 1 cm. Deve-se suspeitar de celulite bacteriana em lesões mais extensas e associadas a dor e febre. O tratamento inclui lavagem, desbridamento e excisão tangencial imediata da ferida em áreas suspeitas. A área de celulite sem uma ferida aberta não deve ser excisada. (►Fig. 5; ►Fig. 6.)
Exames Laboratoriais
Li et al.44 conduziram uma meta-análise que revisou todos os dados publicados disponíveis sobre biomarcadores para a detecção precoce de sepse em pacientes hospitalizados com queimaduras. O estudo abrangeu 28 artigos que avaliaram 57 biomarcadores distintos e incluíram 1.517 participantes. Dada a resposta inflamatória e hipermetabólica desencadeada por lesões térmicas, a meta-análise explora a precisão diagnóstica desses biomarcadores, destacando os desafios associados à detecção precoce de sepse em pacientes com queimaduras. Dos 57 biomarcadores avaliados, a procalcitonina (PCT) apresentou sensibilidade (73%) e especificidade (75%) moderadas, enquanto a proteína C reativa teve alta sensibilidade (86%), mas baixa especificidade (54%). Outros biomarcadores, como peptídeo natriurético cerebral, índice de volume sistólico, fator de necrose tumoral (TNF)-α e DNA livre, mostraram potencial em estudos isolados, mas mais pesquisas são necessárias para confirmar sua utilidade. A necessidade de padronizar as abordagens de avaliação, considerando tempos de amostragem, pontos de corte e definições de sepse, é enfatizada. O estudo conclui que nenhum biomarcador é confiável o suficiente para o diagnóstico de sepse, recomendando a exploração de combinações de biomarcadores e metodologias padronizadas.
Embora confiar em um único biomarcador para o diagnóstico não seja eficaz, a maioria dos estudos endossa seu uso no monitoramento da progressão da sepse, visto que os níveis inicialmente elevados diminuem de forma gradativa com a resolução do quadro. No entanto, mais pesquisas prospectivas são necessárias para determinar os biomarcadores mais precisos para rastrear a progressão da sepse.44 É importante reconhecer que a PCT tem utilidade limitada no diagnóstico precoce e no tratamento da sepse, pois é secretada dentro de 3 horas após a exposição à endotoxina, mas atinge seu pico cerca de 14 horas depois.44,45 No entanto, uma meta-análise de 2015 avaliou a eficácia da PCT como biomarcador para diferenciar pacientes sépticos e não sépticos em casos de queimaduras. A meta-análise analisou estudos anteriores que mediram os níveis de PCT e sua capacidade diagnóstica, determinando uma área sob a curva (AUC, do inglês area under the curve) de 0,83 e um efeito significativo da sepse nos níveis de PCT (d de Cohen ¼ 2,1; IC de 95%: 1,1-3,2). Com um valor de corte estimado de 1,47 ng/mL, os resultados destacam a utilidade da PCT para orientar o manejo antimicrobiano, promovendo decisões informadas sobre o início e a descontinuação de terapias, melhorando, assim, os desfechos clínicos em pacientes queimados.46
Em 2022, uma nova meta-análise avaliou a utilidade da PCT no diagnóstico da sepse em adultos com queimaduras, analisando 15 estudos selecionados entre 856 encontrados. Os resultados mostraram sensibilidade de 0,78, especificidade de 0,85 e AUC de 0,88, indicando bom desempenho diagnóstico precoce. Embora a PCT apresente potencial como marcador de sepse nesse contexto, mais estudos de alta qualidade são necessários para confirmar seu valor clínico.47
De modo geral, as evidências atuais não corroboram o uso de um único biomarcador para o diagnóstico de sepse, visto que existe uma variabilidade significativa entre os estudos publicados em relação às populações de pacientes, definições de sepse, limiares diagnósticos e desfechos relatados. Porém, quando acessíveis, esses biomarcadores podem ser valiosos na orientação do início, monitoramento e descontinuação da terapia antimicrobiana.
Orientações Internacionais
Formulação de recomendações da International Society for Burn Injuries (ISBI) de 2022:
Em 28 de agosto de 2022, durante a reunião bienal da ISBI em Guadalajara, México, com base na estratégia da Campanha Surviving Sepsis, foi desenvolvido um consenso sobre as declarações sobre sepse relacionada a queimaduras, gerando uma série de recomendações.48
Uso da Síndrome da Resposta Inflamatória Sistêmica (SIRS) como Método para Detecção de Sepse em Pacientes com Queimaduras
As características da SIRS são evidentes em todas as grandes queimaduras, visto que os leucócitos são continuamente recrutados para a ferida, levando a flutuações nos números destas células, que podem ser aumentados ou diminuídos. Essas alterações fisiológicas tendem a gerar escores positivos de SIRS mesmo na ausência de infecção. Pacientes com queimaduras que abrangem mais de 20% da área total da superfície corporal (ATSC) apresentam resposta hipermetabólica pronunciada, caracterizada por temperatura basal elevada, taquicardia e taquipneia. Portanto, recomenda-se não utilizar a SIRS como método para detectar sepse e, em vez disso, aderir à definição de sepse. Recomendação 1a: evidências fortes e de alta qualidade.48
Nesse contexto, o escore Sequential Organ Failure Assessment (SOFA) deve servir de base para o desenvolvimento de um conjunto mais refinado de critérios, adaptados a pacientes com queimaduras. A versão atual não considera de maneira adequada todos os sistemas orgânicos comumente acometidos na sepse relacionada a queimaduras, incluindo os sistemas gastrintestinal, dérmico/feridas e endócrino. O refinamento dos parâmetros existentes, como a Escala de Coma de Glasgow, poderia aumentar sua utilidade. Por exemplo, flutuações na glicemia acima de 150 mg/dL, alterações na ferida (na aparência ou no odor), falha do enxerto e íleo paralítico são comumente associados à sepse por queimaduras. Durante a fase de ressuscitação, níveis séricos elevados de lactato e sua remoção servem como marcadores prognósticos, mas não são indicadores definitivos de sepse.48
O uso rotineiro de qualquer critério para diagnóstico de sepse nas primeiras 72 horas não é recomendado. No entanto, isso não significa que a sepse não ocorra em pacientes queimados; logo, o profissional responsável deve identificar sinais de alarme durante esse período. O melhor critério é o do profissional clínico.
Diversos fatores clínicos e paraclínicos foram identificados como indicadores essenciais para suspeita de sepse em pacientes queimados, incluindo um aumento de 2: 2 pontos no escore SOFA, elevação de lactato > 2 mmol/L (> 18 mg/dL) como um substituto para déficit de base, flutuações de temperatura, como febre de início recente ou hipotermia (sem limite estabelecido), declínio súbito no número de plaquetas, redução da produção de urina ou aumento da necessidade de fluidos e lesão renal aguda de estágio 2: 1 com base nos critérios Kidney Disease: Improving Global Outcomes (KDIGO). Outros fatores relevantes incluem distúrbios respiratórios, alteração do estado mental, disfunção gastrintestinal, alterações na ferida sugestivas de infecção e aumento de PCT 2: 2 ng/mL em relação ao valor basal. Nenhum exame isolado faz o diagnóstico definitivo de sepse em pacientes queimados. Em vez disso, uma combinação desses fatores se mostra mais eficaz para induzir decisões diagnósticas ou de tratamento empírico. Consequentemente, os resultados laboratoriais devem ser interpretados no contexto de tendências gerais, e não como valores isolados, e quaisquer alterações devem ser avaliadas em relação à progressão basal do paciente.48
Hoje, não há consenso sobre os fatores desencadeantes exatos para o início do tratamento e nenhum estudo identificou biomarcadores específicos que possam estabelecer o diagnóstico definitivo de sepse em pacientes queimados. Feridas de queimadura que não são inicialmente excisadas começam a ser colonizadas por microrganismos gram-positivos; no entanto, com o tempo, a composição microbiana muda para bactérias gram-negativas, leveduras, fungos e, por fim, patógenos multirresistentes. Devido a essas mudanças dinâmicas na microbiota da ferida, é preferível avaliar a lesão quanto a sinais clínicos de infecção antes de obter culturas, visto que feridas de queimadura são invariavelmente colonizadas. A realização de uma cultura de ferida na ausência de sinais de infecção pode levar a um tratamento inadequado.
Sempre que possível, culturas de feridas devem ser obtidas antes do início da antibioticoterapia caso haja sinais ou sintomas de infecção. No entanto, culturas de feridas de rotina não são recomendadas na ausência de indicadores de infecção, pois a presença bacteriana por si só não é diagnóstica. A coleta de swabs de superfície tem baixa especificidade diagnóstica e o principal método para detectar a infecção continua sendo a identificação de alterações significativas na aparência da lesão. Esta é uma recomendação fraca, baseada em evidências de qualidade muito baixa.48
Em 2024, um consenso de especialistas43 avaliou as recomendações sobre o uso de antibióticos em pacientes queimados. Entre os participantes do consenso, estavam a Global Alliance for Infection in Surgery, a Surgical Infection Society Europe, a World Surgical Infection Society, a American Association for the Surgery of Trauma e a World Society of Emergency Surgery. Esses grupos enfatizaram que a profilaxia antibiótica sistêmica de rotina não é recomendada para pacientes queimados, exceto em circunstâncias específicas.
Os grupos recomendaram seu uso para prevenir infecções em enxertos de pele ou pacientes submetidos a intubação e ventilação mecânica, administrando-os preferencialmente antes da intubação e ajustando-os com base na farmacocinética do antibiótico. Além disso, enfatizaram a importância do controle adequado da fonte, como irrigação extensiva e remoção do material contaminado, para reduzir o risco de infecção sem promover resistência antimicrobiana.43
Estratégias Terapêuticas
A antibioticoterapia deve ser adaptada à suscetibilidade do patógeno e à farmacocinética do paciente. A escolha de antibióticos deve ser orientada pelos padrões regionais de resistência e, sempre que possível, adaptada aos resultados dos antibiogramas e aos padrões de resistência institucionais específicos, permitindo a identificação da prevalência de resistência e, posteriormente, orientando o tratamento de acordo com as culturas específicas do paciente.43 É essencial identificar o microrganismo infeccioso para administrar o tratamento adequado. Alguns estudos documentaram uma alta incidência de culturas negativas em pacientes queimados com sepse, chegando a 52,6%. Portanto, os achados clínicos não devem ser desconsiderados, mesmo quando as culturas apresentam resultados negativos.48
Outras Considerações
Ajuste de acordo com cultura e antibiograma: A terapia deve ser modificada com base nos resultados microbiológicos e na evolução clínica do paciente.
Monitoramento terapêutico: Monitoramento dos níveis de vancomicina em pacientes críticos e ajustes de dose em casos de insuficiência renal.
Prevenção e cControle de infecções: Adesão rigorosa aos protocolos de manejo de dispositivos invasivos, remoção de dispositivos não necessários para o tratamento e manutenção de medidas rigorosas de isolamento.
A ferida da queimadura deve ser avaliada em até uma hora após o diagnóstico e, se houver indícios de infecção invasiva, deve-se realizar a excisão imediata e a coleta de culturas para orientar a antibioticoterapia. A administração de antibióticos empíricos de amplo espectro deve começar, idealmente, até uma hora em casos de choque séptico e até três horas em indivíduos com sepse. Esta é uma recomendação fraca, baseada em evidências de baixíssimo nível.
Para o manejo abrangente, foram extrapolados comportamentos da Campanha Surviving Sepsis que, em teoria, deveriam melhorar os desfechos em pacientes queimados com sepse. Esta recomendação é o primeiro passo para ter metas de ressuscitação mensuráveis para validação ou, pelo menos, desenvolver metas melhores para pacientes queimados com sepse.
1. Obter os níveis séricos de lactato e o déficit de base para orientar a resposta ao tratamento.
2. Obter acesso intravenoso (IV) adequado.
3. Inserir um cateter de Foley para monitoramento rigoroso da urina.
4. Inserir uma linha arterial para monitorar a pressão arterial e a gasometria arterial.
5. Administrar um bôlus de fluido apropriado se houver hipotensão ou redução do débito urinário.
6. Se a pressão arterial média (PAM) for < 65 mmHg, iniciar vasopressores e estabelecer monitoramento hemodinâmico invasivo.
7. Considerar o uso de um agente inotrópico se houver sinais de insuficiência cardíaca após a exclusão de outras causas de choque, como hipovolemia.
8. Iniciar a administração de antibióticos de amplo espectro (após a obtenção das culturas, utilizar a terapia antimicrobiana direta).
9. Obter controle da fonte.
10. Prevenir hipotermia (< 35° C).
Recomendação forte, evidências de baixíssimo nível.48 O manejo de pacientes queimados com infecção profunda deve ser abordado de forma abrangente em uma unidade especializada em queimados que possa oferecer cuidados cirúrgicos, suporte hemodinâmico e identificação e manejo adequados da infecção. É essencial aplicar os objetivos da Campanha Surviving Sepsis para complementar a suspeita clínica e otimizar a resposta do paciente, minimizando a disfunção orgânica. A evolução do paciente será variável, dependendo de fatores como extensão da queimadura, resposta ao tratamento e complicações associadas. Na perspectiva do cirurgião geral, a estabilização precoce, o controle do foco infeccioso com desbridamento cirúrgico oportuno e a prevenção da infecção devem ser priorizados, sempre ajustando o tratamento de acordo com a resposta clínica do paciente.
Conclusão
Este documento estabelece uma diretriz clara, baseada nas evidências científicas mais recentes disponíveis, para o diagnóstico e o manejo de infecções invasivas de feridas em pacientes queimados no Hospital Universitario del Valle, Cali-Colombia. Por meio de uma abordagem estruturada, busca-se padronizar práticas que priorizem o diagnóstico precoce por meio de critérios clínicos definidos, com base em alterações nos aspectos físicos da ferida, corroborados por sinais de inflamação sistêmica e modificações nos parâmetros laboratoriais específicos para essa população. Além disso, promove a escolha dos primeiros antibióticos com base no perfil epidemiológico e de resistência local, sempre ajustando o tratamento de acordo com os achados microbiológicos e a evolução clínica do paciente.
A implementação destas diretrizes não só otimizará o atendimento ao paciente queimado, como também reduzirá complicações, melhorará a eficiência dos recursos e estabelecerá um modelo de gestão integrado que poderá servir de referência para outras instituições (►Fig. 7).
Referências
1. World Health Organization. Burns. [Internet]. Geneva: World Health Organization; 2024 Dec 13 [cited 2024 Dec 13]. Available from: https://www.who.int/news-room/fact-sheets/detail/burns
2. Kiley JL, Greenhalgh DG. Infections in Burn Patients. Surg Clin North Am 2023;103(03):427-437. Doi: 10.1016/j.suc.2023.02.005
3. Wen ZL, Zhang LD, Liu SZ, Liu J, Chen YZ, Chen DC. Effect of broadspectrum antibiotics on bacterial translocation in burned or septic rats. Chin Med J (Engl) 2019;132(10):1179-1187. Doi: 10.1097/CM9.0000000000000242
4. Chen LW, Chen PH, Fung CP, Hsu CM. Dead bacteria reverse antibioticinduced host defense impairment in burns. J Am Coll Surg 2014;219 (04):606-619. Doi: 10.1016/j.jamcollsurg.2014.04.016
5. Vickers ML, Malacova E, Milinovich GJ, Harris P, Eriksson L, Dulhunty JM, Cotta MO. Modifiable risk factors for multidrugresistant Gram-negative infection in critically ill burn patients: a systematic review and meta-analysis. ANZ J Surg 2019;89(10): 1256-1260. Doi: 10.1111/ans.15393
6. Sturtevant AB, Cassell GH, Bobo RA, Feary TW. Effect of antibiotic treatment on the incidence of infectious drug resistance among intestinal lactose-fermenting bacteria isolated from burn patients. Infect Immun 1971;3(03):411-415. Doi: 10.1128/iai.3.3.411-415.1971
7. Bamberg M, Menger MM, Thiel JT, Lauer H, Viergutz T, Fontana J. Antibiotics in patients with severe burn injury-A modifiable variable in hypernatremia etiology. Injury 2024;55(09):111573. Doi: 10.1016/j.injury.2024.111573
8. Ferrada R. Manejo de quemaduras: Básico y avanzado. Bogotá, Colombia: Grupo Distribuna; 2015
9. Ozlu O, Basaran A. Infections in Patients With Major Burns: A Retrospective Study of a Burn Intensive Care Unit. J Burn Care Res 2022;43(04):926-930. Doi: 10.1093/jbcr/irab222
10. Belba MK, Petrela EY, Belba AG. Epidemiology and outcome analysis of sepsis and organ dysfunction/failure after burns. Burns 2017;43(06):1335-1347. Doi: 10.1016/j.burns.2017.02.017
11. Posluszny JA Jr, Conrad P, Halerz M, Shankar R, Gamelli RL. Surgical burn wound infections and their clinical implications. J Burn Care Res 2011;32(02):324-333. Doi: 10.1097/BCR.0b013e31820aaffe
12. Richards C, Emori TG, Edwards J, Fridkin S, Tolson J, Gaynes R. Characteristics of hospitals and infection control professionals participating in the National Nosocomial Infections Surveillance System 1999. Am J Infect Control 2001;29(06):400-403. Doi: 10.1067/mic.2001.118408
13. Fitzwater J, Purdue GF, Hunt JL, O’Keefe GE. The risk factors and time course of sepsis and organ dysfunction after burn trauma. J Trauma 2003;54(05):959-966. Doi: 10.1097/01.TA.0000029382.26295.AB
14. Mason AD Jr, McManus AT, Pruitt BA Jr. Association of burn mortality and bacteremia. A 25-year review. Arch Surg 1986; 121(09):1027-1031. Doi: 10.1001/archsurg.1986.01400090057009
15. Ramirez-Blanco CE, Ramirez-Rivero CE, Diaz-Martinez LA, Sosa- Avila LM. Infection in burn patients in a referral center in Colombia. Burns 2017;43(03):642-653. Doi: 10.1016/j.burns.2016.07.008
16. Teller P, White TK. The physiology of wound healing: injury through maturation. Surg Clin North Am 2009;89(03):599-610. Doi: 10.1016/j.suc.2009.03.006
17. Abbas AK, Lichtman AH, Pillai S. Cellular and Molecular Immunology. 10th ed. Elsevier; 2021
18. D’Arpa P, Leung KP. Toll-Like Receptor Signaling in Burn Wound Healing and Scarring. Adv Wound Care (New Rochelle) 2017;6 (10):330-343. Doi: 10.1089/wound.2017.0733
19. Tompkins RG. Genomics of injury: The Glue Grant experience. J Trauma Acute Care Surg 2015;78(04):671-686. Doi: 10.1097/TA.0000000000000568
20. Cundell AM. Microbial ecology of the human skin. Microb Ecol 2018;76(01):113-120. Doi: 10.1007/800248-016-0789-6
21. Grice EA, Kong HH, Renaud G, Young AC, Bouffard GG, Blakesley RW, et al; NISC Comparative Sequencing Program. A diversity profile of the human skin microbiota. Genome Res 2008;18(07): 1043-1050. Doi: 10.1101/gr.075549.107
22. Lange-Asschenfeldt B, Marenbach D, Lang C, Patzelt A, Ulrich M, Maltusch A, et al. Distribution of bacteria in the epidermal layers and hair follicles of the human skin. Skin Pharmacol Physiol 2011; 24(06):305-311. Doi: 10.1159/000328728
23. Church D, Elsayed S, Reid O, Winston B, Lindsay R. Burn wound infections. Clin Microbiol Rev 2006;19(02):403-434. Doi: 10.1128/CMR.19.2.403-434.2006
24. Goff DA, Kullar R, Goldstein EJC, Gilchrist M, Nathwani D, Cheng AC, et al. A global call from five countries to collaborate in antibiotic stewardship: united we succeed, divided we might fail. Lancet Infect Dis 2017;17(02):e56-e63. Doi: 10.1016/S1473-3099(16)30386-3
25. A Global Declaration on Appropriate Use of Antimicrobial Agents across the Surgical Pathway. Surg Infect (Larchmt) 2017;18(08): 846-853. Doi: 10.1089/sur.2017.219
26. Williams FN, Herndon DN, Jeschke MG. The hypermetabolic response to burn injury and interventions to modify this response. Clin Plast Surg 2009;36(04):583-596. Doi: 10.1016/j.cps.2009.05.001
27. Kennedy P, Brammah S, Wills E. Burns, biofilm and a new appraisal of burn wound sepsis. Burns 2010;36(01):49-56. Doi: 10.1016/j.burns.2009.02.017
28. Yin S, Jiang B, Huang G, Gong Y, You B, Yang Z, et al. Burn Serum Increases Staphylococcus aureus Biofilm Formation via Oxidative Stress. Front Microbiol 2017;8:1191. Doi:10.3389/fmicb.2017.01191
29. Patterson EK, Cepinskas G, Fraser DD. Endothelial Glycocalyx Degradation in Critical Illness and Injury. Front Med (Lausanne) 2022;9:898592. Doi: 10.3389/fmed.2022.898592
30. Tapking C, Hernekamp JF, Horter J, Kneser U, Haug V, Vogelpohl J, et al. Influence of burn severity on endothelial glycocalyx shedding following thermal trauma: A prospective observational study. Burns 2021;47(03):621-627. Doi: 10.1016/j.burns.2020.07.021
31. Osuka A, Kusuki H, Yoneda K, Matsuura H, Matsumoto H, Ogura H, Ueyama M. Glycocalyx Shedding is Enhanced by Age and Correlates with Increased Fluid Requirement in Patients with Major Burns. Shock 2018;50(01):60-65. Doi: 10.1097/SHK.0000000000001028
32. Ladhani HA, Young BT, Posillico SE, Yowler CJ, Brandt CP, Claridge JA, Khandelwal AK. Risk Factors for Wound Infection in Outpatients With Lower Extremity Burns. Am Surg 2021;87(07): 1118-1125. Doi: 10.1177/0003134820952387
33. Bourgi J, Said JM, Yaakoub C, Atallah B, Al Akkary N, Sleiman Z, Ghanimé G Bacterial infection profile and predictors among patients admitted to a burn care center: A retrospective study. Burns 2020;46(08):1968-1976. Doi: 10.1016/j.burns.2020.05.004
34. Strassle PD, Williams FN, Weber DJ, Sickbert-Bennett EE, Lachiewicz AM, Napravnik S, et al. Risk Factors for Healthcare-Associated Infections in Adult Burn Patients. Infect Control Hosp Epidemiol 2017;38(12):1441-1448. Doi: 10.1017/ice.2017.220
35. Karaaslan A, Çetin C, Köle MT, Dereli M, Tekol SD, Filinte G, Akin Y. Infections in Pediatric Patients With Burn Injury: 6 Years of Experience. Pediatr Infect Dis J 2023;42(01):8-12. Doi: 10.1097/INF.0000000000003741
36. Fochtmann-Frana A, Freystätter C, Vorstandlechner V, Barth A, Bolliger M, Presterl E, et al. Incidence of risk factors for bloodstream infections in patients with major burns receiving intensive care: A retrospective single-center cohort study. Burns 2018;44 (04):784-792. Doi: 10.1016/j.burns.2017.12.009
37. Pereira CT, Barrow RE, Sterns AM, Hawkins HK, Kimbrough CW, Jeschke MG, et al. Age-dependent differences in survival after severe burns: a unicentric review of 1,674 patients and 179 autopsies over 15 years. J Am Coll Surg 2006;202(03):536-548. Doi: 10.1016/j.jamcollsurg.2005.11.002
38. Yan J, Hill WF, Rehou S, Pinto R, Shahrokhi S, Jeschke MG. Sepsis criteria versus clinical diagnosis of sepsis in burn patients: A validation of current sepsis scores. Surgery 2018;164(06):1241-1245. Doi: 10.1016/j.surg.2018.05.053
39. Greenhalgh DG, Saffle JR, Holmes JH IV, Gamelli RL, Palmieri TL, Horton JW, et al; American Burn Association Consensus Conference on Burn Sepsis and Infection Group. American Burn Association consensus conference to define sepsis and infection in burns. J Burn Care Res 2007;28(06):776-790. Doi: 10.1097/BCR.0b013e3181599bc9
40. George A, Bang RL, Lari AR, Gang RK. Acute thrombocytopenic crisis following burns complicated by staphylococcal septicaemia. Burns 2001;27(01):84-88. Doi: 10.1016/s0305-4179(00)00065-6
41. Ferrada R, Aragón N, Becerra C. Cultivo biopsia en quemaduras. Rev Colomb Cir 1992;7(03):151-153
42. Miller JM, Binnicker MJ, Campbell S, Carroll KC, Chapin KC, Gilligan PH, et al. A Guide to Utilization of the Microbiology Laboratory for Diagnosis of Infectious Diseases: 2018 Update by the Infectious Diseases Society of America and the American Society for Microbiology. Clin Infect Dis 2018;67(06):e1-e94. Doi: 10.1093/cid/ciy381
43. Coccolini F, Sartelli M, Sawyer R, Rasa K, Ceresoli M, Viaggi B, et al. Antibiotic prophylaxis in trauma: Global Alliance for Infection in Surgery, Surgical Infection Society Europe, World Surgical Infection Society, American Association for the Surgery of Trauma, and World Society of Emergency Surgery guidelines. J Trauma Acute Care Surg 2024;96(04):674-682. Doi: 10.1097/TA.0000000000004233
44. Li AT, Moussa A, Gus E, Paul E, Yii E, Romero L, et al. Biomarkers for the Early Diagnosis of Sepsis in Burns: Systematic Review and Meta-analysis. Ann Surg 2022;275(04):654-662. Doi: 10.1097/sla.0000000000005198
45. Brunkhorst FM, Heinz U, Forycki ZF. Kinetics of procalcitonin in iatrogenic sepsis. Intensive Care Med 1998;24(08):888-889. Doi: 10.1007/s001340050683
46. Cabral L, Afreixo V, Almeida L, Paiva JA. The Use of Procalcitonin (PCT) for Diagnosis of Sepsis in Burn Patients: A Meta-Analysis. PLoS One 2016;11(12):e0168475. Doi: 10.1371/journal.pone.0168475
47. Zhang YJ, Guo ZH, Ming ZG, Hao ZM, Duan P. Meta-analysis of the diagnostic value of serum procalcitonin for burn sepsis in adults. Eur Rev Med Pharmacol Sci 2023;27(15):7188-7200. Doi: 10.26355/eurrev_202308_33292
48. Greenhalgh DG, Hill DM, Burmeister DM, Gus EI, Cleland H, Padiglione A, et al. Surviving Sepsis After Burn Campaign. Burns 2023;49(07):1487-1524. Doi: 10.1016/j.burns.2023.05.003
1. Departamento de Cirurgia Geral, Faculdade de Medicina, Universidad del Valle, Cali,
Valle del Cauca, Colômbia
2. Faculdade de Medicina, Universidad Nacional de Colombia, Bogotá D.C., Colômbia
Aprovação do Comitê de Ética em Pesquisa
Este artigo é uma revisão; portanto, não incluiu pacientes e não foi conduzido em uma instituição de saúde específica. Entendemos que, de acordo com os requisitos do periódico, uma carta do comitê de ética não é necessária. Permanecemos à disposição para outras solicitações.
Endereço para correspondência Juan Paulo Benitez, Departamento de Cirugía General, Facultad de Medicina, Universidad del Valle, Calle 4B #36-00, Cali, Valle del Cauca, Colombia, (e-mail: benitez.juan@correounivalle.edu.co).
Artigo submetido: 20/01/2025.
Artigo aceito: 24/03/2025.
Conflito de Interesses
Os autores não têm conflito de interesses a declarar.







 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter