

Original Article - Year 2011 - Volume 26 -
Substituição de soro bovino fetal por soro humano como suplemento para cultura de fibroblastos humanos
Replacement of fetal calf serum by human serum as supplementation for human fibroblast culture
RESUMO
Introdução: Soro bovino fetal (SBF) é comumente usado como suplemento no meio de cultura para cultivar fibroblastos. Essa forma de suplementação, porém, não é ideal, pois a qualidade das amostras de SBF é variada e sua composição não é completamente conhecida. Além disso, o SBF pode apresentar contaminação por vírus e príons ou causar complicações imunológicas. Assim, a comunidade científica tem buscado alternativas ao uso de elementos xenobióticos em cultura celular. O soro humano pode ser uma dessas alternativas, principalmente para aplicação clínica. Métodos: Soro humano, obtido de sangue de 10 voluntários saudáveis submetidos a avaliação sorológica prévia, foi testado como substituto do SBF em cultura de fibroblastos humanos. As células foram cultivadas em placas multipoços, contendo Dulbecco's Modified Eagle's Medium (DMEM) mais 10% de SBF (D10) ou DMEM mais 10% de soro humano (D10H). Entre 24 e 264 horas de exposição aos meios testados, as células foram contadas e os resultados foram expressos em média ± erro padrão da média, para obtenção de curvas de proliferação celular. Resultados: Não houve diferença estatística entre os grupos de proliferação. Fibroblastos na presença de soro humano aparentavam ser menores e mais arredondados em comparação àqueles mantidos em D10. Conclusões: Os resultados permitem inferir que o soro humano pode substituir o SBF em cultura de fibroblastos e que fibroblastos cultivados em meio suplementado por soro humano apresentam morfologia mais semelhante àqueles in vivo.
Palavras-chave: Soro. Técnicas de cultura de células. Células cultivadas. Fibroblastos. Proliferação celular.
ABSTRACT
Background: Fetal calf serum (FCS) is commonly used as supplement in the culture medium for fibroblast cell cultures. This form of supplementation is far from ideal, as samples quality varies from batch to batch and its composition is not completely known. FCS may contain virus and prion contamination and it may also cause immunologic complications to humans. Due to those facts, a worldwide effort is being made to find alternatives to the use of xenobiotic elements in cell cultures. Human serum would be a safer alternative for FCS use, providing maintenance for cell in clinical appliance. Methods: We assayed human serum as a replacement of FCS in human fibroblasts culture. Human serum was obtained from blood of 10 healthy volunteers, submitted to serological evaluation. Fibroblasts were cultivated in multiwell plates containing either Dulbecco's Modified Eagle's Medium (DMEM) plus 10% FCS (D10) or DMEM plus 10% human serum (D10H). After 24 to 264 hours cells were counted and results were expressed in mean ± standard error of the mean to obtain cell proliferation curves. Results: There was no statistical difference between both proliferation groups. Human serum supported growth and proliferation of human fibroblasts, with a potential as substitute for FCS in cell culture. Cell morphology was different in human serum presence appearing to be smaller and rounded as compared to cells kept in D10. Conclusions: These results allow us to infer that human serum can substitute FCS in fibroblasts cell culture, and that fibroblasts cultured in human serum present morphology similar to in vivo fibroblasts.
Keywords: Serum. Cell culture techniques. Cells, cultured. Fibroblasts. Cell proliferation.
Desde o início do século XX, a comunidade científica procurou por métodos que permitam o isolamento e o crescimento in vitro de pele e/ou células da pele1. Atualmente, a cultura celular está se tornando uma ferramenta fundamental para pesquisa e uso terapêutico2.
Para crescimento in vitro e subsistência da célula, uma mistura especial de nutrientes é necessária. Essa mistura, chamada meio de cultura, é um líquido ou gel que mantém as células em crescimento. Existem diferentes meios para o cultivo de diversos tipos de célula3. Meio de fibroblastos é universalmente suplementado com soro bovino fetal (SBF), uma mistura complexa que contém fatores de crescimento necessários à manutenção da função e proliferação celular4.
SBF é facilmente obtido e apresenta alta concentração de fatores de crescimento e baixa concentração de gamaglobulinas, comparado a outros soros animais, fatos que contribuíram para a adoção do SBF como suplemento padrão de meio de cultura celular5.
Normalmente, o SBF é suplementado ao meio de cultura em concentração de 5% a 20%. Apresenta em sua composição mais de mil componentes diferentes, entre os quais 200 já estão definidos, como hormônios, vitaminas, nucleosídeos, aminoácidos, lipídios, proteínas de transporte (albumina, globina, transferrina), fatores de ligação (fibronectina e laminina), fatores de estabilização, desintoxicantes, fatores de proliferação e fatores de crescimento6.
Essa forma de suplementação não é ideal, pois as concentrações dos nutrientes podem mudar de lote para lote e a composição do SBF não é totalmente conhecida, podendo conter vírus ou príons. Complicações imunológicas podem ocorrer, uma vez que o SBF possui proteínas que estimulam a imunogenicidade humana de modo persistente7,8.
O SBF induz ao aumento da síntese de DNA em células de baço de ratos saudáveis9 e aumenta a formação de placas de linfócitos-B em ratos, elevando a síntese de DNA e IgM nessas células10. O SBF também é blastogênico para linfócitos sanguíneos periféricos11 e sua presença no meio de cultura pode ser responsável por alterações antigênicas da membrana de células tumorais humanas12. O SBF induz resposta citotóxica inespecífica em linfócitos humanos, o que não acontece quando as células são cultivadas em soro humano. Ambas as respostas mostraram-se dose-dependentes e acionadas por uma única exposição13.
Alguns estudos demonstraram que pacientes submetidos a cardiomioplastias usando miofibroblastos cultivados em SBF desenvolveram arritmias ventriculares e morte súbita14. Além disso, pacientes queimados que receberam transplante de queratinócitos cultivados in vitro desenvolveram respostas imunes contra proteínas séricas, as quais levaram à rejeição desses enxertos15.
É importante ressaltar que o SBF é classificado como produto de baixo risco para transmissão de encefalopatia espongiforme bovina, uma vez que o príon causador dessa doença não pode cruzar a barreira placentária. Esse príon apresenta um tropismo para o sistema nervoso central de animais e raramente é encontrado no sangue. Muitas doenças podem ser transmitidas pelo soro, o que torna a restrição a áreas endêmicas imperiosa. Assim, de acordo com as normas do comércio internacional, o SBF deve ser obtido em áreas livres de doenças de gado, apesar de ferramentas para controle de qualidade serem relativamente primitivas e dispendiosas16.
Atualmente, existe um esforço mundial para encontrar alternativas para o uso de elementos xenobióticos em culturas celulares5,17,18.
A viabilidade de soro humano na promoção de crescimento celular foi descrita por Chang19, após longo período de observação de células epiteliais humanas, notando que os soros de indivíduos diferentes apresentam taxas de crescimento celular distintas.
Outros estudos com células humanas, como epitélio conjuntivo20, condrócitos21 e medula óssea22, demonstraram que o soro humano é capaz de manter crescimento celular restante do fenótipo normal dessas células, evidenciando maior taxa de multiplicação em meio com soro humano que com SBF23. Tallheden et al.24 demonstraram que o soro humano possui níveis mais elevados de fatores de crescimento derivados da epiderme e das plaquetas que o SBF.
Com base nesse conhecimento, foi desenvolvida esta pesquisa com células substituindo SBF por soro humano como fator de enriquecimento da cultura. As células eleitas para esse estudo inicial foram fibroblastos dérmicos, visto que possuem papel fundamental no processo de contração da ferida. Assim, este trabalho apresenta os resultados da substituição do SBF pelo soro humano na promoção de proliferação in vitro de fibroblastos humanos.
MÉTODO
O presente estudo foi aprovado pelo Comitê de Ética para Análise de Projetos de Pesquisa (CAPPesq) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), número 2010 (23/1/2008), e foi realizado no Laboratório de Pesquisa em Cultura de Células e Cicatrização de Feridas (LIM 04) da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
Obtenção de Soro Humano
Foram obtidos 10 ml a 20 ml de soro humano (média de 15,7 ± 3,9 ml) a partir de amostras sanguíneas (400 ml) de 10 voluntários adultos saudáveis (ambos os sexos), submetidos às seguintes avaliações sorológicas: HIV, hepatite B, hepatite C, sífilis, doença de Chagas, HTLV I e II, citomegalovírus e toxoplasmose. Os voluntários foram informados sobre a finalidade e as consequências do estudo e, em seguida, assinaram termo de consentimento livre e esclarecido.
Amostras sanguíneas foram coletadas por punção venosa, realizada no Banco de Sangue do Instituto Central do HCFMUSP, por profissionais capacitados e treinados. As amostras obtidas foram enviadas ao laboratório, onde, por centrifugação a 10.000 rpm durante 20 minutos, o soro foi obtido.
Grupos de Estudo
Meio de cultura celular contendo soro humano (nomeado D10H) foi produzido pela adição de 10% de soro humano em Dulbecco's Modified Eagle's Medium (DMEM) (GIBCO 11965.092 - Life Technologies, Baltimore, MD, Estados Unidos), contendo 2 mM de glutamina (GIBCO 25.030.081 - Life Technologies, Baltimore, MD, Estados Unidos), 100 U/ml de penicilina, 100 µg/ml de estreptomicina e 25 µg/ml de anfotericina B (Antibiotic Antimycotic - GIBCO 15249.062 - Life Technologies, Baltimore, MD, Estados Unidos),. Esse meio foi então filtrado para remoção de contaminantes e patógenos eventualmente adquiridos durante seu preparo, minimizando o risco potencial de perda de fatores de crescimento.
Meio com SBF (nomeado D10) foi obtido pela adição de DMEM contendo 2 mM de glutamina, 100 U/ml de penicilina, 100 µg/ml de estreptomicina e 25 µg/ml de anfotericina B em 10% de SBF (GIBCO 16000.044 - Life Technologies, Baltimore, MD, Estados Unidos).
Culturas de Fibroblastos
Usando o método de explante, culturas primárias de fibroblastos foram iniciadas a partir de pele humana fisiológica de espessura total (n = 4) originada de mastoplastia estética. Os explantes foram cultivados no interior de frascos de cultura de células/tecidos com 25 cm2 de área superficial (TPP 90025), contendo D10 ou D10H a 37ºC em atmosfera úmida a 5% de gás carbônico (CO2). O comportamento macroscópico dos fragmentos de pele foi observado. O meio de cultura foi trocado a cada 72 horas. Essas culturas primárias de fibroblastos alcançaram subconfluência após cerca de quatro semanas de crescimento e, subsequentemente, foram tripsinizadas e subcultivadas no mesmo meio, com subpassagens em intervalos semanais.
Proliferação de Fibroblastos
Ensaio de crescimento de fibroblastos foi realizado com a utilização de culturas não-confluentes assíncronas, colocando 1,5 x 103 fibroblastos recém-tripsinizados, contidos em 1 ml de meio de cultura, em triplicata com poços de 9,62 cm2 (6 placas multipoços - Falcon 35 3047). As culturas foram incubadas por 11 dias. Após 24, 48, 72, 96, 120 e 264 horas, os fibroblastos foram tripsinizados e o número de células soltas foi quantificado por contagem em hemocitômetro de Neubauer, com viabilidade avaliada por exclusão por meio de azul tripano a 0,4% (Sigma T-8154). Os testes foram realizados usando culturas em triplicata, cada cultura foi contada duas vezes e valores foram expressos em números de células por poço de 9,62 cm2 ± erro padrão da média (EPM).
Análise Estatística
Coorte ou estudo de acompanhamento para amostras independentes foi realizado e P < 0,05 foi considerado significante.
RESULTADOS
Aspectos Macroscópicos das Culturas
Fragmentos cutâneos apresentaram maior dificuldade de aderir à superfície dos frascos na presença de D10H, quando comparados ao D10 (Figura 1).

Figura 1 - Cultura primária em frascos de 25 cm2 de superfície após uma semana do explante. À direita, 3 frascos contendo D10H; à esquerda, 3 frascos contendo D10. Foi observada menor aderência dos fragmentos cutâneos na presença de soro humano, comparativamente ao meio com soro bovino fetal.
Morfologia dos Fibroblastos Dérmicos
Em microscópio óptico de luz invertida, fibroblastos cultivados em D10H apresentaram demora de cerca de uma semana para a liberação de células a partir dos fragmentos cutâneos, quando comparados a fibroblastos cultivados em D10. Células em meio de D10H estavam mais alongadas e com mais grânulos intracitoplasmáticos que fibroblastos mantidos em meio de D10 (Figura 2).
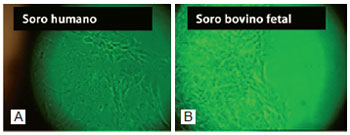
Figura 2 - Duas semanas de cultura de fibroblastos. Na presença de soro humano (A), as células se apresentaram mais alongadas e com maior número de grânulos intracitoplasmáticos, quando comparadas aos fibroblastos cultivados em soro bovino fetal (B). Em ambos os casos, queratinócitos estão presentes entre os fibroblastos (MO - 10x).
Após múltiplas passagens com seleção de fibroblastos, as células mudaram de fenótipo, ficando mais arredondadas na presença de D10H, quando comparadas às mantidas em D10 (Figura 3).

Figura 3 - Detalhes da cultura celular após três semanas. Desarranjo na organização e pequeno volume celular são observados em fibroblastos cultivados em soro humano (A e C), quando comparados aos cultivados em soro bovino fetal (B e D). Em aspecto confluente, fibroblastos cultivados em soro humano apresentaram morfologia mais arredondada (E), quando comparados às células cultivadas em soro bovino fetal (F) (MO - 10x). Número de células ± EPM; P < 0,001.
Ensaio de Proliferação de Fibroblastos
Ao longo do ensaio, foi observada proliferação de fibroblastos. Depois de 48 horas, havia 6.565 ± 590,83 fibroblastos cultivados em meio com soro humano e 6.041,5 ± 216,81 em meio com SBF. Após 11 dias, o número de células era de 99.791,5 ± 24.793,93 em soro humano e de 68.645,75 ± 22.452,39 fibroblastos em SBF (Figura 4).
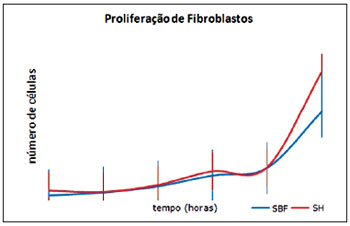
Figura 4 - Comparação da proliferação de fibroblastos humanos (n = 4) em presença de soro bovino fetal ou soro humano ao longo do tempo (horas). EPM = erro padrão da média; SBF = soro bovino fetal; SH = soro humano.
DISCUSSÃO
SBF é o soro animal mais utilizado em suplementações de meio de cultura celular, pela sua relativa disponibilidade, facilidade de armazenamento e altas concentrações de fatores de crescimento. Essa forma de suplementação é distante da ideal, em decorrência da irregularidade das concentrações de nutrientes de um lote para outro, do fato de sua composição não ser completamente conhecida, e da possibilidade de contaminação por vírus ou príons7,8.
Para aplicação clínica, a não utilização de elementos xenobióticos em cultura celular humana seria de grande utilidade. O uso de elementos sanguíneos humanos em cultura celular tem demonstrado resultados promissores. Esse é o motivo pelo qual o SBF (um nutriente xenobiótico) em culturas in vitro de fibroblastos está sendo substituído por um nutriente similar de origem humana.
Em um estudo realizado por Kurita et al.25, em que são comparadas três confecções séricas humanas (soro, plasma rico em plaquetas e plasma pobre em plaquetas), foi observado que soro humano e plasma rico em plaquetas estimulam de forma intensa o crescimento de fibroblastos, com resultados equivalentes aos do SBF, enquanto plasma pobre em plaquetas apresenta resultados significativamente menores. Houve boa correlação com o fato de que alguns fatores de crescimento obtidos de plaquetas, como fator derivado de plaquetas, são claramente mitogênicos para fibroblastos26. Observou-se que essa capacidade de gerar proliferação demonstrou alguma variação entre indivíduos. Entretanto, os resultados apresentaram o mesmo padrão, sem relação significante entre sexo e idade.
Neste estudo, observou-se, primeiramente. dificuldade na adesão de fragmentos cutâneos às superfícies dos frascos de cultura celular, na presença de soro humano (Figura 1). Não foi encontrada nenhuma outra referência a esse fato.
No presente estudo, foram observadas diferenças morfológicas entre fibroblastos cultivados em SBF ou soro humano. A literatura descreve mudanças fenotípicas entre fibroblastos in vivo e in vitro, reportando fibroblastos em culturas de camada única na presença de SBF como células mais largas, quando comparados a fibroblastos presentes em matriz extracelular, mais arredondados27. Fibroblastos mantidos em cultura de camada única com meio D10H estavam mais arredondados que os cultivados em D10, sugerindo que a presença de soro humano é o fator de manutenção do fenótipo in vivo (Figuras 2 e 3).
Quanto à proliferação de fibroblastos, nenhuma diferença estatisticamente significante foi observada no decorrer deste ensaio, independentemente do meio de cultura (D10H ou D10) usado (Figura 4). Esse fato é confirmado por Cooper & Goldstein28, que compararam a multiplicação de fibroblastos cultivados em soro humano e em SBF, relatando taxa de crescimento similar em ambos os grupos, mas tempo de vida de replicação significativamente reduzido em amostras séricas humanas.
Mazlyzam et al.29 analisaram o tempo de vida e a síntese proteica de fibroblastos cultivados em meio a 10% de soro humano em comparação ao meio a 10% de SBF. Os autores observaram que a proliferação celular foi mais acelerada em meio de soro humano, com tempo menor de duplicação e manutenção do fenótipo fisiológico de fibroblasto. Neste estudo, esse fato não foi observado, possivelmente em decorrência da diferença na composição do meio: Mazlyzam et al.29 utilizaram Ham's F12 e DMEM, suplementado com 10% de SBF, enquanto este estudo não incluiu Ham's.
De acordo com Mazlyzam et al.29, o nível de expressão gênica do colágeno tipo I foi mantido, com aumento de sua expressão em passagens precoces e suprarregulação de genes relacionados com a expressão de colágeno III. Esse fato é importante para a infrarregulação da expressão gênica de alfa-AML (alfa actina de músculo liso) e proteínas extracelulares, envolvidas na contração da ferida e formação cicatricial29.
Kondo et al.30 obtiveram fibroblastos de pele humana fetal e compararam a migração celular in vitro em meio de cultura contendo soro humano ou SBF. Em 48% das amostras, o soro humano inibiu a migração celular e manteve níveis mais altos de proliferação. Esses autores também observaram que a inibição era dependente da concentração e da idade do doador de soro: doadores com mais idade apresentaram forte inibição da migração31. Essa inibição pode ser atribuída à interferência na síntese de colágeno, mas os autores levantaram também a hipótese de que a inibição seria decorrente dos níveis de alfa 2 macroglobulina e lipoproteína de baixa densidade (low-density lipoprotein - LDL).
Nosso grupo está realizando outros estudos com o intuito de substituir o SBF por componentes humanos, entre eles o lisado de plaquetas. É nossa intenção comparar os resultados obtidos nesse estudo com aqueles de outras pesquisas, com o objetivo central de produzir um equivalente de pele humanizado para ser clinicamente aplicado no tratamento de úlceras crônicas de membro inferior. Essa fase clínica do estudo será desenvolvida no Laboratório de Terapia Celular do Instituto Central do Hospital das Clínicas.
CONCLUSÕES
Os resultados deste estudo permitem inferir que o soro humano pode substituir o SBF na cultura celular de fibroblastos humanos, principalmente na aplicação clínica, minimizando, assim, a possibilidade de complicações imunológicas relacionadas com o uso de componentes xenobióticos.
REFERÊNCIAS
1. Bello YM, Falabella AF, Eaglstein WH. Tissue-engineered skin. Current status in wound healing. Am J Clin Dermatol. 2001;2(5):305-13.
2. Gruber DF, Jayme DW. Cell and tissue culture media: history and terminology. In: Cell biology: a laboratory handbook. New York: Academic Press; 1994. p.45-50.
3. Madigan MT, Martinko JM, Stahl DA, Clark DP. Brock biology of microorganisms. 12nd ed. Upper Saddle River: Prentice Hall; 2008. p.943.
4. Eagle H. Nutrition need of mammalian cells in tissue culture. Science. 1955;122(3168):501-14.
5. van der Valk J, Mellor D, Brands R, Fischer R, Gruber F, Gstraunthaler G, et al. The humane collection of fetal bovine serum and possibilities for serum-free cell and tissue culture. Toxicol In Vitro. 2004;18(1):1-12.
6. Staines D, Price P. Managing serum requirements for cell culture. Baltimore:GIBCO® Cell Culture; 2003. p.87.
7. Johnson MC, Meyer AA, deSerres S, Herzog S, Peterson HD. Persistence of fetal bovine serum proteins in human keratinocytes. J Burn Care Rehabil. 1990;11(6):504-9.
8. Martin MJ, Muotri A, Gage F, Varki A. Human embryonic stem cells express an immunogenic nonhuman sialic acid. Nat Med. 2005;11(2):228-32.
9. Vogt A, Mishell RI, Dutton RW. Stimulation of DNA synthesis in cultures of mouse spleen cell suspensions by bovine transferrin. Exp Cell Res. 1969;54(2):195-200.
10. Melchers F, Andersson J. Early changes in immunoglobin M synthesis after mitogenic stimulation of bone marrow derived lymphocytes. Biochemistry. 1974;13(22):4645-53.
11. Coutinho A, Möller G, Anderson J, Bullock WW. In vitro activation of mouse lymphocytes in serum-free medium: effect of T and B cell mitogens on proliferation and antibody synthesis. Eur J Immunol. 1973;3(5):299-306.
12. Irie RF, Irie K, Morton DL. Characteristics of heterologous membrane antigen on cultured human cells. J NatI Cancer Inst. 1974;53(6):1545-51.
13. Zielske JV, Golub SH. Fetal calf serum-induced blastogenic and cytotoxic responses of human lymphocytes. Cancer Res. 1976;36(10):3842-6.
14. Chachques JC, Herreros J, Trainini J, Juffe A, Rendal E, Prosper F, et al. Autologous human serum for cell culture avoids the implantation of cardioverter-defibrillators in cellular cardiomyoplasty. Int J Cardiol. 2004;95 Suppl 1:S29-33.
15. Johnson LF, deSerres S, Herzog SR, Peterson HD, Meyer AA. Antigenic cross-reactivity between media supplements for cultured keratinocyte grafts. J Burn Care Rehabil. 1991;12(4):306-12.
16. Eloit M. Risks of virus transmission associated with animal sera or substitutes and methods of control. Dev Biol Stand. 1999;99:9-16.
17. Falkner E, Appl H, Eder C, Losert UM, Schöffl H, Pfaller W. Serum free cell culture: the free access online database. Toxicol In Vitro. 2006; 20(3):395-400.
18. Brunner D, Frank J, Appl H, Schöffl H, Pfaller W, Gstraunthaler G. Serum-free cell culture: the serum-free media interactive online database. ALTEX. 2010;27(1):53-62.
19. Chang RS. Continuous subcultivation of epithelial-like cells from normal human tissues. Proc Soc Exper Biol Med. 1954;87(2):440-3.
20. Ang LP, Tan DT, Seah CJ, Beuerman RW. The use of human serum in supporting the in vitro and in vivo proliferation of human conjunctival epithelial cells. Br J Ophthalmol. 2005;89(6):748-52.
21. Badrul AH, Aminuddin BS, Sharaf I, Samsudin OC, Munirah S, Ruszymah BH. The effects of autologous human serum on the growth of tissue engineered human articular cartilage. Med J Malaysia. 2004;59 Suppl B:11-2.
22. Yamamoto N, Isobe M, Negishi A, Yoshimasu H, Shimokawa H, Ohya K, et al. Effects of autologous serum on osteoblastic differentiation in human bone marrow cells. J Med Dent Sci. 2003;50(1):63-9.
23. Chuak KH, Aminuddin BS, Fuzinan NH, Ruszymah BH. Basic fibroblast growth factor with human serum supplementation: enhancement of human chondrocyte proliferation and promotion of cartilage regeneration. Singapore Med J. 2007;48(4):324-32.
24. Tallheden T, van der Lee J, Brantsing C, Månsson JE, Sjögren-Jansson E, Lindahl A. Human serum for culture of articular chondrocytes. Cell Transplant. 2005;14(7):469-79.
25. Kurita M, Aiba-Kojima E, Shigeura T, Matsumoto D, Suga H, Inoue K, et al. Differential effects of three preparations of human serum on expansion of various types of human cells. Plast Reconstr Surg. 2008;122(2):438-48.
26. Eppley BL, Woodell JE, Higgins J. Platelet quantification and growth factor analysis from platelet-rich plasma: implications for wound healing. Plast Reconstr Surg. 2004;114(6):1502-8.
27. Sorrell JM, Caplan AI. Fibroblast heterogeneity: more than skin deep. J Cell Sci. 2004;117(Pt 5):667-75.
28. Cooper JT, Goldstein S. Comparative studies on human skin fibroblasts: life span and lipid metabolism in medium containing fetal bovine or human serum. In Vitro. 1977;13(8):473-6.
29. Mazlyzam AL, Aminuddin BS, Saim L, Ruszymah BH. Human serum is an advantageous supplement for human dermal fibroblast expansion: clinical implications for tissue engineering of skin. Arch Med Res. 2008;39(8):743-52.
30. Kondo H, Yonezawa Y, Ito H. Inhibitory effects of human serum on human fetal skin fibroblast migration: migration-inhibitory activity and substances in serum, and its age-related changes. In Vitro Cell Dev Biol Anim. 2000;36(4):256-61.
31. Kondo H, Nomaguchi TA, Yonezawa Y. Effects of serum from human subjects of different ages on migration in vitro of human fibroblasts. Mech Ageing Dev. 1989;47(1):25-37.
1. Doutor, responsável pelo Laboratório de Pesquisa em Cultura de Células e Cicatrização de Feridas (LIM 04) da Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.
2. Médica residente do HCFMUSP, São Paulo, SP, Brasil.
3. Graduanda de Medicina da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP, Brasil.
4. Mestre, pesquisadora do Laboratório de Cultura Celular da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
5. Doutor, responsável pelo Banco de Tecidos do Instituto Central do HCFMUSP, São Paulo, SP, Brasil.
6. Pós-graduando, médico residente de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
7. Pós-doutora, pesquisadora do Instituto de Pesquisas Energéticas e Nucleares (IPEN), São Paulo, SP, Brasil.
8. Professor titular da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
Correspondência para:
César Isaac
Avenida Doutor Arnaldo, 455 - sala 1360 - Pinheiros
São Paulo, SP, Brasil - CEP 01246-903
E-mail: cesaris@uol.com.br
Artigo submetido pelo SGP(Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 23/3/2011
Artigo aceito: 12/6/2011
Trabalho realizado no Laboratório de Pesquisa em Cultura de Células e Cicatrização de Feridas (LIM 04) da Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter