

Original Article - Year 2011 - Volume 26 -
Micobacteriose em implantes mamários: revisão da casuística do Instituto Ivo Pitanguy
Mycobacteriosis in patients with breast implants: a case review from the Ivo Pitanguy Institute
RESUMO
Introdução: Nos últimos anos, foram crescentes os registros de infecções por micobactéria de crescimento rápido em cirurgia plástica, mesmo com a melhoria dos métodos de assepsia/antissepsia e da antibioticoprofilaxia. A infecção após inclusão de implantes mamários causa grande morbidade às pacientes e transtorno ao cirurgião. Métodos: Estudo retrospectivo dos casos de infecção por micobactéria de crescimento rápido da 38ª Enfermaria da Santa Casa da Misericórdia do Rio de Janeiro, após inclusão de implantes mamários, em que são apresentadas propostas de prevenção e tratamento da micobacteriose. Foram incluídos os casos confirmados laboratorialmente e os clinicamente suspeitos. Resultados: Até o presente momento foram confirmados 3 casos de infecção por micobactéria, num total de 483 mamaplastia de aumento no decorrer de 3 anos. Em 2 pacientes, houve suspeita de infecção, porém sem confirmação laboratorial. Conclusões: A profilaxia é o pilar fundamental para a redução do impacto da micobacteriose em procedimentos de cirurgia plástica. Entretanto, saber identificar, diagnosticar e tratar corretamente a micobacteriose é de suma importância para minimizar a morbidade da paciente.
Palavras-chave: Micobactérias atípicas. Mycobacterium. Implante mamário. Mamoplastia/efeitos adversos. Infecção.
ABSTRACT
Introduction: Reports of infections caused by rapidly growing mycobacteria during plastic surgery have increased in recent years despite improvements in techniques of asepsis/ antisepsis and antibiotic prophylaxis. Infections occurring after the insertion of breast implants are a cause of patient morbidity and a significant problem for the surgeon. Methods: Breast implant surgery cases complicated by mycobacterial infections at the Infirmary ward 38th of the Santa Casa da Misericórdia, Rio de Janeiro were retrospectively reviewed. A description of the current guidelines for the prevention and treatment of mycobacteriosis is included. Laboratory confirmed and clinically suspected cases were included in this study. Results: Of 483 augmentation mammaplasty cases, 3 patients developed mycobacterial infections in the last 3 years. In 2 patients, there was a suspicion of infection that was not confirmed by laboratory data. Conclusions: Prophylaxis is fundamental for reducing the incidence of mycobacteriosis during plastic surgery procedures. However, the identification, diagnosis, and treatment of mycobacterial diseases are important to minimize the morbidity of this type of infection.
Keywords: Mycobacteria, atypical. Mycobacterium. Breast implantation. Mammaplasty/adverse effects. Infection.
A infecção é uma das complicações mais temidas após a cirurgia para inclusão de implantes mamários, ocorrendo em 1% a 2% dos casos1, sendo os agentes etiológicos mais frequentes Staphylococcus aureus e Staphylococcus coagulase negativos. Apesar de incomum, a infecção pós-operatória em implantes mamários é de grande morbidade à paciente. Na maioria dos casos, essas pacientes necessitarão de novo procedimento cirúrgico e curso de antibióticos prolongado, com resultado estético final potencialmente comprometido. Além da remoção do implante, a cirurgia para reinclusão pode ser postergada por meses ou até anos2.
É crescente o número de relatos de infecções por micobactéria após operações estéticas, principalmente lipoaspiração e mastoplastia de aumento3. A explicação para esse fato está relacionada a contaminação de instrumental cirúrgico, imunossupressão do hospedeiro e criação de novos métodos laboratoriais de diagnóstico2.
As micobactérias são organismos bastante conhecidos em nosso meio, desde seu primeiro agente descrito por Hansen, em 18683. Elas apresentam peculiaridades relacionadas à quantidade e aos tipos de lipídeos complexos em sua parede celular. Essa parede singular e rica em lipídeos constitui uma barreira impermeável e eficiente, possibilitando que as micobactérias sejam mais resistentes que as outras bactérias.
As micobactérias de crescimento rápido Mycobacterium fortuitum, Mycobacterium chelonae e Mycobacterium abscessus são microrganismos oportunistas, normalmente encontrados no solo, na poeira e em encanamentos para água. Dificilmente causam doenças em seres humanos, a menos que sejam inoculadas diretamente no organismo por feridas traumáticas ou por materiais cirúrgicos contaminados.
O grupo de maior importância clínica das micobactérias atípicas, na classificação de Runyon, é o grupo das bactérias de crescimento rápido ou grupo 4. Frequentemente envolvidas em infecções de pele e tecidos moles, já foram responsabilizadas por infecções em cateteres intravenosos e peritoneais, abscessos após injeções, infecções em sítio cirúrgico, mastoplastias e cirurgias oftálmicas3.
A infecção causada por micobactérias pode se assemelhar à causada por germes comumente encontrados nas infecções de implantes, embora na maioria das vezes se inicie em período mais tardio, em cerca de 4 a 6 semanas. O quadro clínico se apresenta com drenagem de secreção frequentemente inodora e incolor na ferida cirúrgica, podendo ser acompanhada por sinais sistêmicos, como febre e astenia.
O diagnóstico da micobacteriose necessita de uma cultura positiva para esse organismo. O material aspirado deve ser enviado para a coloração de Gram, pesquisa para bacilo álcool-ácido resistente (BAAR), cultura para bactérias aeróbias, anaeróbias, fungos e micobactérias4. A determinação do subtipo da micobactéria é de suma importância na orientação da antibioticoterapia. Para esse fim, dois testes bioquímicos são usados: tolerância ao cloreto de sódio e ao citrato e reação em cadeia polimerase.
Este estudo teve como objetivo analisar a evolução dos casos e das propostas de tratamento dos casos de infecção diagnosticados. Para isso, foram relatados incidência, métodos diagnósticos, evolução e tratamento dos pacientes que apresentaram tal complicação no Serviço de Cirurgia Plástica do Instituto Ivo Pitanguy, na 38ª Enfermaria da Santa Casa da Misericórdia do Rio de Janeiro.
MÉTODO
Revisão de prontuários, incluindo o seguimento pós-operatório dos casos que desenvolveram infecção por micobactéria de crescimento rápido após inclusão de implantes mamários, comprovados laboratorialmente, nos anos de 2008, 2009 e 2010.
Foram revistos dois casos suspeitos sem diagnóstico laboratorial, porém com clínica compatível e tratamento para micobacteriose.
O presente trabalho foi aprovado pelo Comitê de Ética da instituição.
RESULTADOS
Relatos de Casos Confirmados
Primeiro caso - Paciente do sexo feminino, 23 anos, submetida a cirurgia de inclusão de implantes mamários de silicone, redondos, com revestimento de poliuretano, 285 ml à direita e 195 ml à esquerda, por incisão periareolar inferior, e localização retroglandular, em 3 de março de 2008. No 22º dia de pós-operatório, queixou-se de peso em mama direita, sem sinais flogísticos locais e/ou sistêmicos. Foi solicitada ultrassonografia, que evidenciou uma coleção. No 36o dia de pós-operatório, houve drenagem espontânea de serosidade pela incisão da mama direita, que foi enviada para cultura e antibiograma. Iniciada antibioticoterapia empírica com ciprofloxacino 500 mg a cada 12 horas.
A cultura foi positiva para Mycobacterium abscessus. A conduta adotada foi a retirada dos implantes mamários e encaminhamento da paciente para acompanhamento com infectologista. Após a retirada dos implantes, a paciente abandonou o acompanhamento ambulatorial.
Segundo caso - Paciente do sexo feminino, 31 anos, submetida a inclusão de implantes mamários de silicone, redondos, texturizados, de 260 ml, por incisão periareolar inferior e localização retroglandular, em 4 de fevereiro de 2009. No 15º dia de pós-operatório, notou-se drenagem de secreção purulenta da mama direita pela cicatriz. Foi enviada secreção para cultura e antibiograma e iniciada antibioticoterapia com ciprofloxacino 500 mg, a cada 12 horas, por 15 dias. Os resultados das culturas solicitadas retornaram negativos. Pela manutenção do quadro clínico citado, no 30o dia optou-se pela retirada dos implantes mamários e pelo reenvio de material para cultura, incluindo-se nesse material um fragmento de tecido da loja.
O resultado da cultura retornou negativo para micobacteriose, porém o tecido retirado da loja tinha alterações compatíveis com infecção por micobactéria de crescimento rápido: processo inflamatório crônico, tipo granulomatoso, granulomas necrosantes, com presença de células epitelioides, histiócitos e células gigantes (Figura 1).
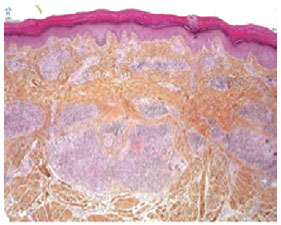
Figura 1 - Lâmina de granuloma cutâneo causado por micobacteriose.
Foi iniciado tratamento para infecção por micobactéria de crescimento rápido com claritromicina de 500 mg, por via oral, a cada 12 horas, por 4 meses. No dia 4 de agosto de 2009, procedeu-se à reinclusão de novos implantes mamários de tamanho e forma similares aos anteriores, pelas cicatrizes cirúrgicas prévias na posição retroglandular, não havendo relato de intercorrências até a presente data.
Terceiro caso - Paciente do sexo feminino, 34 anos, submetida a inclusão de implantes mamários de silicone, redondos, texturizados, de 305 ml, por incisão periareolar inferior, com localização retroglandular, em 15 de julho de 2010. No 13o dia de pós-operatório, a paciente apresentou hematoma bilateral das mamas. Foi realizada drenagem dos hematomas no centro cirúrgico e, após irrigação das lojas, os implantes foram reinclusos pela mesma incisão. Drenos aspirativos foram mantidos por dois dias. Antibioticoterapia com ciprofloxacina 500 mg, a cada 12 horas, foi mantida por 15 dias.
No 28º dia de pós-operatório, a paciente evoluiu com aumento da mama direita e astenia. A ultrassonografia demonstrou coleção líquida posterior ao implante em mama direita e o hemograma apresentava-se normal. Foi realizada punção do material com agulha de Klein, e o material foi enviado para cultura e antibiograma (Figura 2). Por apresentar picos de febre e sinais flogísticos em torno da área de punção, a paciente foi internada, iniciando-se antibioticoterapia intravenosa. Não houve melhora do quadro clínico, optando-se pela retirada dos implantes mamários e envio de novo material para cultura.
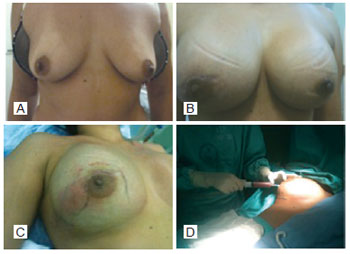
Figura 2 - Em A, pré-operatório. Em B, aumento do volume da mama direita. Em C, área de hiperemia da mama direita. Em D, punção da secreção da mama direita.
A paciente evoluiu bem, com alta em 48 horas em uso de ciprofloxacino. Três dias após, houve resultado positivo para BAAR em todas as amostras, sendo introduzida claritromicina 500 mg, a cada 12 horas, por via oral. Na terceira semana de pós-operatório, os resultados dos exames solicitados retornaram positivos para micobacteriose. A paciente segue em tratamento oral com os antibióticos ciprofloxacino e claritromicina, aguardando o término da antibioticoterapia para reinclusão de novos implantes.
Relatos de Casos Suspeitos
Primeiro caso - Paciente do sexo feminino, 23 anos, submetida a inclusão de implantes mamários de silicone, redondos, texturizados, de 325 ml, por incisão periareolar inferior, com localização retroglandular, em 1º de setembro de 2009. Com 60 dias de pós-operatório, a paciente apresentou saída de secreção purulenta pela cicatriz. Foi introduzido ciprofloxacino 500 mg, a cada 12 horas, por 10 dias e curativo seco.
No 9º dia, a paciente apresentou exposição parcial do implante da mama direita. Optou-se pela retirada dos implantes e envio do material para cultura e exame anatomopatológico. Todos os exames foram negativos para micobacteriose. Considerando-se o quadro clínico compatível com tal afecção, foi instituída antibioticoterapia por 6 meses, com ciprofloxacino e claritromicina. Em 16 de abril de 2010, foi realizada reinclusão dos implantes, sem intercorrências.
Segundo caso - Paciente do sexo feminino, 24 anos, submetida a inclusão de implantes mamários de silicone, redondos, texturizados, de 235 ml, por incisão periareolar inferior, em localização retroglandular, em 24 de maio de 2007. Após 15 meses, a paciente foi submetida a retirada do implante da mama direita por seroma. No intraoperatório, não se evidenciou sinal de infecção, tendo sido enviado material para cultura e anatomia patológica e reincluído novo implante. Todos os exames foram negativos para micobactéria.
Após 6 meses, a paciente foi reinternada para a retirada de ambos os implantes, por exposição parcial dos mesmos. Foi enviado novamente material para exames, com resultados negativos. Em decorrência do quadro clínico compatível com micobacteriose, foi instituída antibioticoterapia por 6 meses com ciprofloxacino e claritromicina. Em 3 de novembro de 2009, foi realizada reinclusão dos implantes.
DISCUSSÃO
O tratamento inicial para infecção após colocação de implante mamário inclui cobertura antimicrobiana empírica2,3. Caso o tratamento antibiótico não seja eficaz, deve-se suspeitar de infecção na loja dos implantes, recomendando-se a remoção dos implantes e o desbridamento das lojas com colocação de drenos. A melhora das pacientes após retirada dos implantes e uso de antibióticos indica que o tratamento deve ser continuado até a obtenção do resultado das culturas. No entanto, se a paciente não apresentar melhora dos sinais sistêmicos ou apresentar até mesmo piora dos sinais e sintomas, deve-se suspeitar de uma infecção por micobactéria, recomendando-se iniciar terapia endovenosa com amicacina e cefalotina em doses padrão. Tão logo os testes de sensibilidade microbiana fiquem prontos, a dose pode ser ajustada2.
É recomendada terapia antimicrobiana com dois tipos diferentes de antimicrobianos, por um período de 3 a 6 meses, com remoção dos implantes e desbridamento das lojas e do tecido de granulação. A capsulectomia para a total erradicação da micobacteriose é imperiosa. A micobacteriose forma biofilmes nesses implantes, tornando muito difícil sua eliminação, sendo, portanto, necessária sua retirada. A reinclusão dos implantes não deve ser feita antes de 6 meses completos de uma terapia adequada2.
Em infecções leves e moderadas, que compreendem a maioria dos casos, o tratamento pode ser apenas oral, com uso de claritromicina com ciprofloxacino, sulfametoxazol-trimetoprima ou tetraciclina.
Para tratamento da infecção por Mycobacterium fortuitum, deve-se administrar claritromicina 500 mg duas vezes por dia por via oral e ciprofloxacino 500 mg duas vezes por dia, também por via oral, ambos por um período de 4 a 6 meses. Podem ser usados também amicacina, sulfonamidas, imipenem, doxiciclina e cefoxitina.
Já para o tratamento de quadros infecciosos causados por Mycobacterium abscessus e Mycobacterium chelonae, caracterizados por formas cutâneas extensas ou não-responsivas, devem ser administrados claritromicina 500 mg, duas vezes por dia, por via oral ou 1.000 mg, duas vezes por dia, por um período de 4 a 6 meses, e amicacina 250 mg, três vezes por semana, durante 90 dias ou 750 mg, três vezes por semana, por via intramuscular ou endovenosa, durante 30 dias.
Pode ser observada exacerbação dos sintomas durante o tratamento, com resposta imunológica intensa, e os sintomas clínicos são muito similares aos do próprio quadro infeccioso que o paciente apresentava, porém com sinais e sintomas mais floridos. Nesses casos, deve-se prolongar o tratamento por 12 meses e realizar um teste de sensibilidade para direcionar a terapêutica e a associação com outras drogas4 (Figura 3).
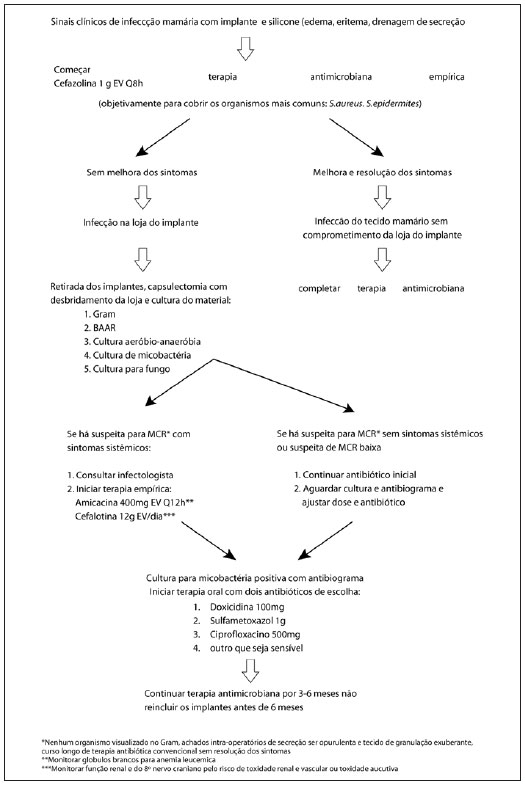
Figura 3 - Algoritmo terapêutico.
Diante do aumento dos casos de infecções por micobactéria nos últimos anos, especialmente em procedimentos pouco invasivos como na cirurgia plástica, o cirurgião plástico deve estar sempre muito atualizado e alerta para essa doença.
A micobacteriose é, na maioria das vezes, discreta em sua apresentação, mas com consequências bastante deletérias. Além de dispor de um grupo amplo e cepas que vêm se destacando em sua virulência, como a Mycobacterium massiliense, a micobacteriose não possui um tratamento comum para todos os representantes de seu grupo; o que acaba por dificultar e atrasar o tratamento correto em muitos casos.
O prolongamento da infecção é sustentado pela formação do biofilme, que compromete a manutenção de um resultado estético durante o tratamento, uma vez que pode implicar a realização de capsulectomia e retirada dos implantes para seu controle.
A cirurgia plástica tem muito a ganhar com as pesquisas genéticas para melhor conhecimento dos grupos de micobactéria e de suas cepas virulentas, pois esse é o caminho para descobrir a suscetibilidade específica de cada cepa, tanto para antibioticoterapia eficaz como para o uso de degermantes e esterilizantes que possam eliminar com segurança esses organismos do ambiente cirúrgico.
Com as pesquisas genéticas, espera-se o desenvolvimento de medicamentos que impeçam a síntese e/ou a liberação dos sensores de quorum, cruciais para a formação do biofilme, garantidor de uma infecção de difícil erradicação ou até mesmo de vacinas contra as proteínas envolvidas na formação do biofilme e medicamentos que ajam diretamente em sua eliminação.
O grande aumento da incidência de micobacteriose em serviços de Cirurgia Plástica em todo o mundo, até então nunca experimentado, nos leva a considerar que as doenças estão evoluindo em conjunto com as melhores técnicas cirúrgicas e de antissepsia. Sendo assim, há uma busca por métodos mais modernos para evitá-las, usando todos os campos da medicina, tendo em vista sua capacidade de mutação e crescimento, como no caso dos surtos recentes de micobacterioses.
As infecções por micobactérias de crescimento rápido estão fortemente relacionadas a falhas nos processos de limpeza, desinfecção e esterilização de produtos médicos5-9. Na maioria dos serviços de saúde investigados, os instrumentais cirúrgicos foram submetidos somente ao processo de desinfecção e não ao processo de esterilização, como é definido pela Resolução da Agência Nacional de Vigilância Sanitária (ANVISA) - RE no 2606/06. Diante dos indícios de resistência da cepa Mycobacterium massiliense ao glutaraldeído a 2%, que até então era amplamente utilizado por inúmeros serviços de saúde como agente desinfectante de parte do instrumental cirúrgico, a ANVISA, em norma técnica de 8 de agosto de 2008, orienta os serviços de saúde para que realizem a esterilização de artigos críticos com outros métodos disponíveis.
Os casos diagnosticados na 38ª Enfermaria da Santa Casa da Misericórdia do Rio de Janeiro obtiveram êxito na resolução da infecção e reinclusão dos implantes mamários, tendo sido adequadamente diagnosticados e recebido o tratamento correto para a micobacteriose. A ocorrência esporádica e a não configuração de um surto dessa afecção em nossa instituição provavelmente decorrem do fato de padrões e recomendações dos órgãos competentes quanto à correta manipulação e esterilização do material cirúrgico terem sido implementados no Serviço antes da ocorrência dos surtos descritos no Brasil.
CONCLUSÕES
Assim como em outras áreas do conhecimento médico, a profilaxia é o fator determinante na redução do impacto dessa afecção dentro da Cirurgia Plástica. Seguir as determinações de órgãos competentes10 quanto à correta esterilização e manipulação de instrumental cirúrgico, assim como métodos de antissepsia rigorosos no pré-operatório, constituem-se na melhor maneira de prevenção.
Entretanto, saber identificar e tratar corretamente a micobacteriose é de suma importância para resolução do caso e para investigação da fonte infectante. Um tratamento bem realizado é o caminho para a resolução do quadro infeccioso e diminuir as sequelas das pacientes.
REFERÊNCIAS
1. Haiavy J, Tobin H. Mycobacterium fortuitum infection in prosthetic breast implants. Plast Reconstr Surg. 2002;109(6):2124-8.
2. Macadam SA, Mehling BM, Fanning A, Dufton JA, Kowalewska-Grochowska KT, Lennox P, et al. Nontuberculous mycobacterial breast implant infections. Plast Reconstr Surg. 2007;119(1):337-44.
3. Macedo JLS, Henriques CMP. Infecções pós-operatórias por micobactérias de crescimento rápido no Brasil. Rev Bras Cir Plást. 2009;24(4):544-51.
4. Secretaria de Estado da Saúde de São Paulo. Centro de Vigilância Epidemiológica "Prof. Alexandre Vranjac". Orientações para investigação clínica e tratamento de infecções por Mycobacterium spp em procedimentos estéticos. Disponívelnem: http://www.cve.saude.sp.gov.br
5. Brickman M, Parsa AA, Parsa FD. Mycobacterium cheloneae infection after breast augmentation. Aesthetic Plast Surg. 2005;29(2):116-8.
6. Douglas SR, Cook T, Shorr N. Lumps and bumps: late postsurgical inflammatory and infectious lesions. Plast Reconstr Surg. 2003;112(7):1923-8.
7. Kalita JB, Rahman H, Baruah KC. Delayed post-operative wound infections due to non-tuberculous Mycobacterium. Indian J Med Res. 2005;122(6):535-9.
8. Nadell CD, Xavier JB, Levin SA, Foster KR. The evolution of quorum sensing in bacterial biofilms. PLoS Biol. 2008;6(1):e14.
9. Timpe A, Runyon EH. The relationship of atypical acid-fast bacteria to human disease: preliminary report. J Lab Clin Med. 1954;44(2):202-9.
10. Brasil. Agência Nacional de Vigilância Sanitária. RE no 75, de 23 de outubro de 2008, que dispõe sobre a comprovação de eficácia de esterilizantes e desinfetantes hospitalares para artigos semi-críticos frente às micobactérias "Mycobacterium abscessus" e "Mycobacterium massiliense" e dá outras providências. Disponível em: http://www.anvisa.gov.br/e-legis/
1. Cirurgiã plástica, pós-graduada no Instituto Ivo Pitanguy, Rio de Janeiro, RJ, Brasil.
2. Cirurgião geral, pós-graduando do Instituto Ivo Pitanguy, Rio de Janeiro, RJ, Brasil.
3. Membro titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), professor assistente dos cursos de Pós-Graduação Médica em Cirurgia Plástica pela Pontifícia Universidade Católica do Rio de Janeiro (PUC-RJ) e pelo Instituto de Pós-Graduação Médica Carlos Chagas, Rio de Janeiro, RJ, Brasil.
4. Patrono da SBCP, membro da Academia Nacional de Medicina e Academia Brasileira de Letras, professor titular do curso de Pós-Graduação Médica em Cirurgia Plástica pela PUC-RJ e pelo Instituto de Pós-Graduação Médica Carlos Chagas, Rio de Janeiro, RJ, Brasil.
Correspondência para:
Vinícius Volpe D'Angieri Basile
Av. General San Martin, 856 - ap. 302
Rio de Janeiro, RJ, Brasil - CEP 22441-014
E-mail: vimedbasile@hotmail.com
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 18/7/2011
Artigo aceito: 30/8/2011
Trabalho realizado no Serviço de Cirurgia Plástica do Professor Ivo Pitanguy, Santa Casa da Misericórdia do Rio de Janeiro, Rio de Janeiro, RJ, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter