

Original Article - Year 2014 - Volume 29 -
Influência do tabagismo na qualidade da pele de mulheres brancas
Smoking influence on the skin quality of white women
RESUMO
INTRODUÇÃO: Avaliar a influência do tabagismo na qualidade da pele de mulheres brancas analisando o colágeno, as fibras elásticas e a vascularização.
MÉTODOS: Realizou-se análise histológica e morfométrica de 78 retalhos pré-auriculares de mulheres brancas que se submeteram à cirurgia estética facial. As pacientes foram pareadas conforme a idade, constituindo dois grupos (n=39), um de fumantes e um de não fumantes. Utilizaram-se a coloração de Picrosírius Ultra red para quantificar os colágenos I e III, a coloração de Weigert para a análise do material elástico e o imunomarcador anti CD34 para evidenciar os vasos sanguíneos.
RESULTADOS: Foi possível verificar que em fumantes e não fumantes há diminuição da densidade de colágeno dérmico com o envelhecimento, tanto na fração I quanto na III. A diminuição da fração I é maior na derme de fumantes, na faixa etária de 50 a 59 anos (p=0,019). O material elástico aumenta na derme com o passar dos anos, tornando-se fragmentado, espessado e desorganizado, de modo mais acentuado na derme das fumantes, na mesma faixa etária (p=0,006) e, finalmente, existe um aumento gradativo do número de vasos na microcirculação, mais significativo nas fumantes (p=0,008).
CONCLUSÃO: A pele de mulheres fumantes contém menos colágeno (especialmente do tipo I), mais material elástico degenerado, fragmentado e espessado e maior número de vasos sanguineos.
Palavras-chave: Pele; Mulheres; Colágeno; Tecido elástico; Microcirculação; Tabagismo.
ABSTRACT
INTRODUCTION: This study aimed to evaluate the influence of smoking on the skin quality of Caucasian women by analyzing collagen, elastic fibers, and vascularization.
METHODS: Histological and morphometric analysis was carried out on the pre-auricular flaps of 78 women undergoing facial cosmetic surgery. The patients were paired (n = 39) based on age, to form a group of smokers and another of non-smokers. Collagen types I and III were quantified using Picrosirius Ultra red staining, Weigert staining was used to analyze elastic material, and anti-CD34 immunostaining highlighted blood vessels.
RESULTS: Dermal density of both types of collagen decreased with age in both groups. The decrease in type I was higher in the dermis of smokers aged 50-59 years (p = 0.019). Elastic material increased in the dermis with age, becoming fragmented, thickened, and disorganized, particularly in 50-59-year-old smokers (p = 0.006). Moreover, in smokers, a gradual and significant increase in the number of microcirculatory vessels also observed (p = 0.008).
CONCLUSION: The skin of women who smoke contains less collagen (type I in particular), more degenerated, fragmented and thickened elastic material, and a greater number of blood vessels.
Keywords: Skin; Women; Collagen; Elastic tissue; Microcirculation; Smoking.
O complexo processo de reparo denominado cicatrização, que "consiste no fechamento de falhas teciduais ou substituição de um tecido destruído por outro de mesmo tipo ou por tecido fibroso que recompõe as partes lesadas", é essencial para a sobrevivência das espécies após trauma com lesão tecidual1.
Este processo pode ser influenciado negativamente por diversos fatores, entre eles o tabagismo2.
A síntese de colágeno subcutâneo é significantemente impedida em fumantes3. O cádmio, outro componente do tabaco, tem sido associado à depressão da produção de pró-colágeno pelos fibroblastos4.
A associação entre fumar e deficiências cicatriciais é muito conhecida na prática clínica e motivo de preocupação entre os cirurgiões plásticos. Tabagismo tem sido relacionado a maior risco de complicações relacionadas à cicatrização como: necrose de pele, infecção de sítio cirúrgico, deiscências de parede, cicatrizes espessas e atraso da cicatrização epidérmica5-8. Verificou-se experimentalmente que a administração de nicotina a ratos aumenta a área de necrose nos retalhos cutâneos9-11.
A manutenção do endotélio e da integridade da microcirculação é necessária para o transporte e oferta de nutrientes bem como para a remoção dos metabólitos dos tecidos. Demonstrou-se clinicamente que a deposição de colágeno é direta e significativamente proporcional à tensão de oxigênio e às medidas de perfusão12.
A nicotina possui atividade vasoconstritora reduzindo a pO2 nos tecidos, aumentando a agregação plaquetária e diminuindo a proliferação de macrófagos e fibroblastos13. Fibroblastos necessitam pO2 de 15mmHg para a divisão celular e 15 a 30mmHg para sintetizar colágeno. Isto sugere que a vasoconstrição causada pela nicotina possa contribuir com a diminuição da tensão de oxigênio e afetar a cicatrização de feridas13.
A exposição de fibroblastos dérmicos ao tabaco tem sido relacionada à diminuição da síntese dos colágenos tipos I e III2,14-19. Sorensen et al. relataram diminuição da inflamação, da contração, da proliferação fibroblástica e da vitamina C em fumantes18-19. Estudo realizado em nossa linha de pesquisa com ratos que receberam nicotina demonstrou que a densidade de colágeno não estava afetada, mas sim a sua organização, encontrando-se diminuição da população de fibroblastos20-21.
O catabolismo do colágeno é realizado por um conjunto de enzimas proteolíticas do grupo das metalo-proteinases (MMP), as quais são produzidas pelos fibroblastos e outros tipos celulares. Já identificou-se interferência sobre a MMP-1, MMP-2, MMP3, MMP-7 e MMP-8 14,15,22. Verificou-se que o tabaco altera a função endotelial e fibroblástica, além de afetar a matriz extracelular23.
O efeito vasoconstritor da nicotina tem sido posto em dúvida. Segundo Usuki et al., pequenas doses de nicotina promoveriam aumento do fluxo sanguíneo cutâneo24. Sørensen et al. relataram que a nicotina administrada aumenta o fluxo, mas o fumo o diminuía, reduzindo a tensão tecidual de O218.
A exposição crônica à nicotina diminui a regulação dos receptores nicotínicos colinérgicos do endotélio e induz uma redução dos níveis séricos do fator de crescimento vascular endotelial (VEGF), prejudicando a angiogênese. A exposição aguda, por sua vez, parece promover aumento da densidade capilar25. Assim, a nicotina, em baixa concentração, poderia acelerar a angiogênese e nesta condição melhorar a remodelação e a cicatrização26.
A relação entre o envelhecimento cutâneo e o hábito de fumar foi descrita em 1856 por Solly27. Em 1985 Model criou critérios para definir o "fácies de tabagismo": a) rugas salientes; b) olhos fundos com proeminências ósseas; c) pele atrófica e acinzentada; e d) pele pletórica28.
Existem dois processos que governam o envelhecimento da pele: um intrínseco, que consiste num processo degenerativo lento de todos os tecidos e órgãos, e um extrínseco, causado pela exposição a diversos agentes como a foto exposição e o tabagismo29. A intensidade do envelhecimento está relacionada ao número de cigarros/dia e ao tempo de tabagismo30-32.
Na pele, os primeiros sinais clínicos de envelhecimento são o ressecamento, a perda da firmeza e da elasticidade e o surgimento de rugas, especialmente nas áreas foto-expostas que são acompanhados de alterações histológicas que variam de acordo com o local da pele e a idade do indivíduo33. A pele senil apresenta achatamento da junção dermo-epidérmica, marcada atrofia e perda de elasticidade nos tecidos conectivos dérmicos, associados à redução e desorganização dos componentes da matriz extracelular, dos colágenos tipo I e III, das fibras elásticas, dos proteoglicans e das glicosaminoglicans 16,33. Raduan et al. consideraram o tabaco como fator independente envolvido no enrrugamento da pele34.
O estresse oxidativo vem sendo relacionado há muito tempo ao processo de envelhecimento e o tabagismo é um importante acelerador deste processo pelo aumento da formação de radicais livres 35,36. Estes processos podem ser intensificados por fatores externos como as RUV35.
Baroni et al. relataram que o envelhecimento promoveu diminuição da densidade, fragmentação e desorganização do colágeno dérmico. Identificaram aumento da densidade do material elástico, que, no entanto, era desorganizado, o que os levou a chamá-lo de material elastótico e não fibras elásticas37.
Just et al. consideram o tabagismo fator independente para o aumento das fibras elásticas na derme reticular da pele não foto-exposta e fator aditivo para o envelhecimento da pele foto-exposta38.
Quando se buscam informações da influência do tabagismo no envelhecimento, encontram-se problemas metodológicos importantes como: amostras pequenas e insuficientes e a falta de controle de fatores de interferência.
OBJETIVO
O objetivo do presente estudo é comparar a qualidade da pele de mulheres brancas fumantes com a de não fumantes.
MÉTODO
O estudo utilizou as lâminas preparadas para a pesquisa protocolada sob número: 0541.0.084.000-09 no CONEP e número: 5430 no Comitê de Ética em Pesquisa com Seres Humanos da Pontifícia Universidade Católica do Paraná, tendo sido aprovado de acordo com o Parecer Nº 0003880/10.
Todas as pacientes, em número de 250, incluídas no estudo assinaram termo de consentimento informado no qual autorizaram a utilização de seus retalhos de pele pré-auriculares, retirados em cirurgia plástica facial.
No questionário preenchido pelas pacientes foi possível identificar as fumantes e as não fumantes. Fatores de interferência como terapia de reposição hormonal, uso de corticosteróides ou outros medicamentos, tratamento estético facial prévio e exposição solar intensa foram considerados para a não inclusão das pacientes na análise.
Os cortes histológicos contidos nas lâminas foram tratados pela hematoxilina-eosina (HE) e pelo Picrosírius-red. A coloração com HE permitiu reconhecer a estrutura geral da pele e o Picrosírius-red, sob luz polarizada, conhecer a densidade dos colágenos do tipo I e III, principais constituintes deste tecido. Para o reconhecimento do material elástico utilizou-se a hematoxilina de Weigert e para o reconhecimento dos vasos sanguíneos os cortes foram tratados com um imunomarcador biológico, o anticorpo antiCD34. Foram lidos cinco campos de cada corte e obteve-se a média da densidade do colágeno e de material elástico pelo cálculo do percentual da área examinada e os vasos pela média de vasos nos campos examinados. A leitura foi feita de modo que o leitor não soubesse a que grupo pertencia e foi utilizado o programa Image Plus® 4.5 para Windows® da Media Cybernetics.
Os dados foram tabulados e encaminhados para análise estatística.
Os resultados foram expressos por médias, medianas, valores mínimos, valores máximos e desvios padrões. Para a comparação dos grupos definidos pela faixa etária foi considerado o teste não-paramétrico de Kruskal-Wallis. Para a comparação dos grupos de fumantes e não fumantes, dentro de cada faixa etária, foi usado o teste não-paramétrico de Mann-Whitney. Para resultados paramétricos utilizou-se o Teste t de student. Valores de p<0,05 indicaram significância estatística. Os dados foram analisados com o programa computacional Statistica v.8.0.
RESULTADOS
De uma amostra de 250 mulheres, respeitados os critérios de inclusão, foi possível parear 78 mulheres, 39 para o grupo não fumante e 39 para o fumante.
Alocadas conforme a idade, conseguiu-se estudar três subgrupos em cada um dos grupos. Foram avaliados nove pares na faixa de 40 a 49 anos, 24 na faixa dos 50 aos 59 e seis na faixa dos 60 aos 69 anos. Não se pode estudar pacientes acima dos 70 anos porque ao se fazer o pareamento e excluir os fatores de confusão a amostra resultante foi insuficiente para que se pudesse fazer uma análise.
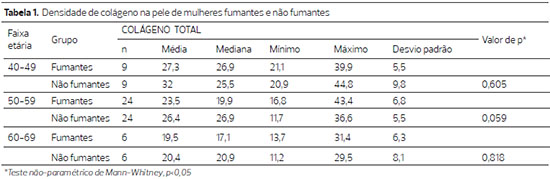
A densidade do colágeno na derme diminuiu com o avançar da idade, de modo não significante no grupo das não fumantes (p=0,211) e significante no grupo das fumantes (p=0,042). Quando se compararam os dois grupos dentro da mesma faixa etária a diferença não foi significante (tabela 1).
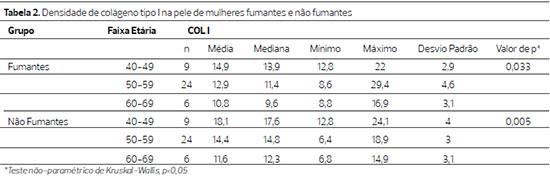
Observou-se diminuição significante do colágeno tipo I na pela das pacientes não fumantes à medida que a idade avançou (p=0,033) e ainda mais na pele das fumantes (p=0,005) (tabela 2).
Embora a densidade de colágeno do tipo I tenha sido menor nas pacientes fumantes, a comparação nas diferentes faixas etárias mostrou tendência a ser menor entre os 40 e os 49 anos, na pele de fumantes (0,077) e foi significantemente menor entre os 50 e os 59 anos (p=0,019) (Tabela 3) (Figura 1).
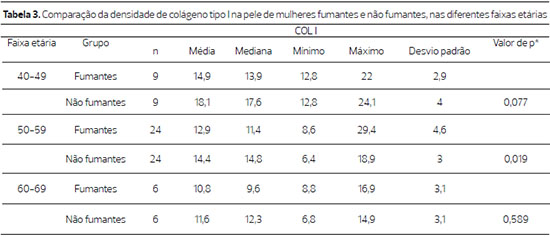
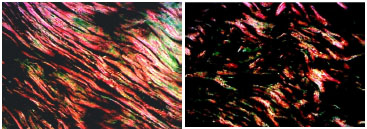
Figura 1. Fotomicrografias de cortes histológicos tratados pelo Picrosirius-red, mostrando, na imagem superior, um corte de pele de paciente fumante e na inferior, de paciente não fumante, com idade entre 50 e 59 anos. (vermelho = colágeno tipo I e verde = colágeno tipo III) (200X)
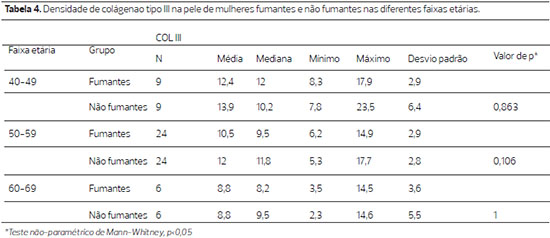
A análise da densidade do colágeno tipo III, na pele das pacientes fumantes, embora tenha diminuído com o avançar da idade não o foi de modo significante (p=0,124), o mesmo acontecendo nas das pacientes não fumantes (p=0,526). A comparação nas diferentes faixas etárias também não foi significante (Tabela 4).
A análise do material elástico não mostrou diferença significante na pele das pacientes com idade entre 40 e 49 anos (p=0,071). Entretanto quando se analisou as das pacientes com idade entre 50 e 59 anos pode-se perceber um aumento importante (p=0,006) e ainda significante na faixa entre 60 e 69 anos. (Tabela 5). A análise intra-grupo mostrou que nas pacientes fumantes o ganho de material elástico na faixa dos 50 aos 59 anos quando comparada à encontrada na pela das pacientes com idade entre 40 e 49 anos, não foi significante (p=0,401), mas foi significante quando comparada a contida na pele das pacientes com idade entre 60 e 69 anos (p=0,032). O mesmo comportamento foi observado na pele das pacientes não fumantes, embora nestas o percentual de material elástico tenha sido menor, comparado o contido na pele das pacientes com idade entre 40 e 49 anos com o contido na das pacientes com idade entre 50 e 59 anos (p=0,494), A comparação destas últimas com as das pacientes com idade entre 60 e 69 anos foi significante (p=0,044) (Figura 2).
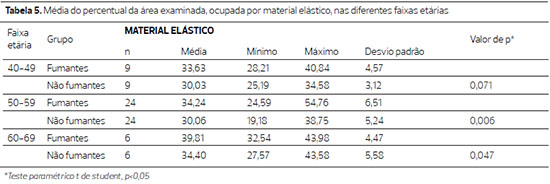
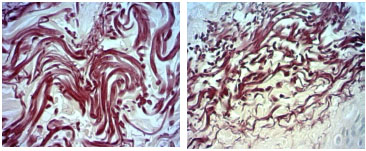
Figura 2. Fotomicrografias de cortes histológicos de pele tratados pela hematoxilina de Weigert, a imagem superior, de paciente não fumante e a inferior de paciente fumante, da faixa 50 a 59 anos. (400X).
A média do número de vasos por campo mostro que nas pacientes fumantes este número é maior em todas as faixas examinadas e de modo significante na comparação dos 50 aos 59 anos (p=0,008) (Tabela 6) (Figura 3).
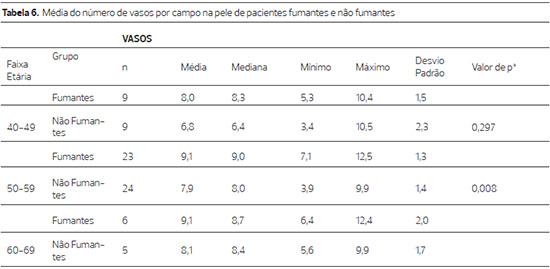
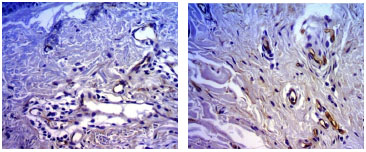
Figura 3. Fotomicrografia de cortes de pele tratados pelo anti CD 34, a imagem superior de paciente não fumante e a inferior de paciente fumante, da faixa 50 a 59 anos. (400X).
DISCUSSÃO
Analisando os resultados encontrados em seus estudos, Baroni et al. concluíram que o envelhecimento da pele levava à alterações qualitativas e degenerativas da derme, com diminuição do colágeno total e de suas frações I e III e à desorganização e fragmentação das fibras colágenas, especialmente a partir dos 60 anos de idade37. É descrito que a síntese do colágeno é prejudicada pelo tabagismo3, seja pela diminuição do número de fibroblastos seja pela exposição deles aos produtos do tabaco2,14-21.
Broniarczyk-Dyla et al. afirmaram que o envelhecimento fica acelerado nas mulheres, após a menopausa, devido à diminuição do colágeno, além da queda da produção ovariana de estrógenos39.
É de se esperar que além da perda fisiológica do envelhecimento, mulheres tabagistas mostrem perdas de colágeno mais acentuadas. Neste estudo pode-se identificar que as peles das pacientes fumantes possuíam menos colágeno, mas a diferença não era significante. Entretanto pode-se verificar que a fração de colágeno I, estruturalmente mais organizado, era menor nas peles das fumantes, na faixa etária dos 50 aos 59 anos (p=0,019). Nas demais faixas não se pode afirmar, embora se tenha observado tendência a ter menos colágeno, pois ao se aplicar os critérios de exclusão a amostra analisável ficou muito reduzida. Embora vários autores tenham relatado que a exposição dos fibroblastos dérmicos ao tabaco diminui a síntese dos colágenos I e IIII2,14-19, neste estudo encontrou-se diminuição tanto nas fumantes como nas não fumantes, embora mais acentuado nas fumantes.
A elasticidade fisiológica e a resiliência da derme são decorrentes das fibras elásticas40. A degeneração das fibras elásticas, a diminuição do colágeno, especialmente do tipo I, e a desorganização levam à diminuição da elasticidade da pele e à formação de rugas 41.
A densidade da rede de elastina aumenta desde o nascimento até atingir seu volume final, por volta dos 20 anos nas mulheres, e aos 40 anos, nos homens 42. Com o avançar da idade as fibras elásticas tornam-se espessadas, emaranhadas, degradadas e disfuncionais43. Bioquimicamente, o material elastótico assemelha-se à elastina, embora desorganizado e anormal na proporção de vários constituintes 43. Nas áreas com degeneração actínica, as fibras elásticas tornam-se mais espessas, com aumento progressivo da massa de material elastótico granular anormal41.
O tabagismo é considerado fator independente para o aumento das fibras elásticas na derme reticular da pele não foto-exposta e fator aditivo para o envelhecimento da pele foto-exposta38.
Estudo de Ortolan mostrou que o envelhecimento provocou aumento da densidade do material elástico, com modificação da qualidade e da organização das fibras elásticas 44. Baroni et al. identificaram aumento da densidade do material elástico, que, no entanto, era desorganizado, o que os levou a chamá-lo de material elastótico e não fibras elásticas37.
Nesta amostra, comparadas as dermes das peles de mulheres fumantes e de não fumantes, pode-se perceber que a densidade de material elástico aumentou com o envelhecimento e mais intensamente nas pacientes fumantes, tendo sido muito significante a diferença na faixa dos 50 aos 59 anos (p=0,006).
Deve-se considerar que fumantes de longa data, não infrequentemente, apresentam algum grau de doença pulmonar obstrutiva (DPOC). Maclay et al. encontraram aumento da degradação da elastina da pele de pacientes com PDOC em ralação aos controles 45. Este relato reforça os achados de desorganização e degradação das fibras elásticas. Embora Rosado et al. tenham estudado pacientes homens, fumantes e adultos jovens (idade entre 23 e 36 anos), eles encontraram um aumento de material elástico que chegou a 42,5% a mais quando comparados aos controles não fumantes46.
Alguns autores relataram que o envelhecimento promove diminuição da microcirculação cutânea com redução das alças capilares, dilatações vasculares e proliferação endotelial com diminuição da reserva funcional47-49. Trabalhos de nossa linha de pesquisa não mostraram modificação significante da densidade de vasos sanguíneos na derme com o envelhecimento 44. Na análise desta amostra pode-se verificar que as dermes das peles das pacientes fumantes apresentavam maior número de vasos, tendo sido muito significante na faixa dos 50 aos 59 anos (p=0,008). Talvez um certo grau de hipóxia tecidual estimule a neoangiogênese.
Se a síntese e a organização do colágeno é oxigênio dependente12, se a nicotina promove estresse oxidativo e vasoconstrição é de se considerar que o tabagismo interfira na quantidade e na organização do colágeno, acelerando o envelhecimento. Esta análise em condições clínicas fica muito prejudicada pelos fatores de interferência. Grande parte das pacientes mais idosas apresentam-se com doenças próprias da idade, muitas usam medicamentos e estas situações interferem tanto no colágeno como na vascularização. Além disso, muitas já se submeteram a um ou mesmo vários tratamentos de rejuvenescimento. São necessárias amostras muito grandes para que aplicados os fatores de exclusão se tenha um número de pacientes suficiente para uma análise. Neste estudo, de um número inicial de 250 mulheres que se apresentaram clinicamente bem para tratamento cirúrgico, aplicados os critérios de exclusão, restaram 78, isto é, perderam-se 68,8% da amostra. Estudaram-se mulheres brancas, predominantes na população de nossa região. É bem provável que este comportamento seja diferente nas mulheres de outros grupos raciais. Girardeau et al. mostraram que existem diferenças na epiderme superficial, nas funções dérmicas e nas interações celulares da pele de africanos e de caucasianos50.
Nesta amostra foi possível verificar que fumantes e não fumantes diminuem a densidade de colágeno dérmico com o envelhecimento, tanto da fração I quanto da III, entretanto a diminuição é maior na derme de fumantes. O material elástico aumenta na derme com o passar dos anos, se torna fragmentado, espessado e desorganizado, de modo mais acentuado na derme das fumantes e finalmente existe um aumento gradativo do número de vasos na microcirculação, mais significativo nas fumantes.
CONCLUSÃO
A pele de mulheres fumantes contém menos colágeno, especialmente da fração I, mais material elástico degenerado, fragmentado e espessado e maior número de vasos.
REFERÊNCIAS
1. Singer AJ, Clark RAF. Mechanism of disease: cutaneous wound healing. N Engl J Med. 1999;340(10):738-46.
2. Tipton DA, Dabbous MK. Effects of nicotine on proliferation and extracellular matrix production of human gingival fibroblast in vitro. J Periodontol. 1995;66(12):1056-64.
3. Jorgensen LN, Kallehave F, Christensen E, Siana JE, Gottrup F. Less collagen production in smokers. Surgery. 1998;123(4):450-5.
4. Chambers RC, McAnulty Rj, Shock A, Campa JS, Newman Taylor AJ, Laurant GJ. Cadmium selectively inhibits fibroblast procollagen production and proliferation. Am J Respir Cell Mol Biol. 1998;19(3):498-506.
5. Selber JC, Kurichi JE, Vega SJ, Sonnad SS, Serletti JM. Risk factors and complications in free TRAM flap breast reconstruction.Ann Plast Surg. 2006;56(5):492-7.
6. Spear SL, Ducic I, Cuoco F, Hannan C. The effect of smoking on flap and donor-site complications in pedicled TRAM breast reconstruction. Plast Reconstr Surg. 2005;116(7):1873-80.
7. Sorensen LT, Karlsmark T, Gottrup F. Abstinence from smoking reduces incisional wound infection: a randomized controlled Trial. Ann Surg. 2003;238(1):1-5.
8. Sørensen LT, Hemmingsen U, Kallehave F, Wille-Jørgensen P, Kjaergaard J, Møller LN, et al. Risk factors for tissue and wound complications in gastrointestinal surgery. Ann Surg. 2005;241(4):654-8.
9. Campos H, Ferreira LM, Conrado dos Santos WL, Araújo MCM. Efeitos da nicotina nos retalhos cutâneos em ratos. Acta Cir Bras. 2001;16(4):206-10.
10. Eroglu L; Orak I; Turhan Haktanir N. Effect of short-term use of oral smokeless tobacco on random- pattern skin flap s. urvival in rats. Scand J Plast Rreconstr Surg Hand Surg. 2005;39(5):272-6.
11. Fan GB; Wu PL; Wang XM. Changes of oxygen content in facial skin before and after cigarette smoking. Skin Res Technol. 2012;18(4):511-5.
12. Jonsson K, Jensen JA, Goodson WH, Scheuenstuhl H, West J, Hopf HW, et al. Tissue oxygenation, anemia, and perfusion in relation to the wound healing in surgical patients. Ann Surg. 1991;214(5):605-13.
13. Jensen JA, Goodson WH, Hopf HW, Hunt TK. Cigarette smoking decreases tissue oxygen. Arch Surg. 1991;126(9):1131-4.
14. Yin L, Morita A, Tsuji T. Alterations of extracellular matrix induced by tobacco smoke extract. Arch Dermatol Res 2000;292(4):188-94.
15. Knuutinen A, Kallioinen M, Vähäkangas K, Oikarinen A. Smoking and skin: a study of the physical qualities and histology of skin in smokers and non-smokers. Acta Derm Venereol. 2002;82(1):36-40.
16. Morita A. Tobacco smoke causes premature skin aging. J Dermatol Sci. 2007;48(3):169-75.
17. Tanaka H, Ono Y, Nakata S, Shintani Y, Sakakibara N, Morita A. Tobbaco smoke extract induces premature skin aging in mouse. J Dermatol Sci. 2007;46(1):69-71.
18. Sørensen LT, Jørgensen S, Petersen LJ, Hemmingsen U, Büllow J, Loft S, et al. Acute effects of nicotine and smoking on blood flow, tissue oxygen, and aerobe metabolism of the skin and subcutis. J Surg Res. 2009;152:224-30.
19. Sørensen LT, Toft BG, Rygaard J, Ladelund S, Paddon M, James T, et al. Effect of smoking, smoking cessation, and nicotine patch on wound dimension, vitamin C, and systemic markers of collagen metabolism. Surgery. 2010;148(5):982-90.
20. Biondo-Simões MLP et al. A influência da nicotina na densidade de colágeno em cicatrizes cutâneas, em ratos.Rev Col Bras. 2009;36(5):425-30.
21. Biondo-Simões MLP et al. The influence of nicotine on the population of fibroblasts in cutaneous scars in rats.Acta Cir Bras. 2009;24(6):466-70.
22. Ortega YV, Tomey AV. Metaloproteinasas de la matriz y envejecimiento cutâneo. Rev Habanera Cienci. Med. 2003; 2(5). Internet. Disponível: http://www.ucmb.sld.cu/rhab/index.html. Acesso em 2011.
23. Su Y, Cão W, Han Z, Block ER. Cigarette smoke extract inhibits angiogenesis of pulmonary artery endothelial cells: the role of calpain. Am J Physiol ung Cell Mol Physiol. 2004;287(4):L794-800.
24. Usuki K, Kanekura T, Aradono K, Kanzaki T. Effects of nicotine on peripheral cutaneous blood flow and skin temperature. J Dermatol Sci. 1998;16(3):173-81.
25. Konishi H, Wu J, Cooke JP. Chronic exposure to nicotine impairs cholinergic angiogenesis. Vasc Med. 2010;15(1):47-54.
26. Morimoto N, Takemoto S, Kawazoe T, Suzuki S. Nicotine at a low concentration promotes wound healing. J Surg Res. 2008;145(2):199-204.
27. Gill JF; Yu SS; Neuhaus IM. Tobacco smoking and dermatologic surgery. J Am Acad Dermatol. 2013;68(1):167-72.
28. Model D. Smoker's face: an underrated clinical sign? Br Med J (Clin Res Ed). 1985;291(6511):1760-2.
29. Uitto J. Understanding premature skin aging. N Engl J Med. 1997;337(20):1463-5.
30. Doshi DN, Hanneman KK, Cooper KD. Smoking and skin aging in identical twins. Arch Dermatol. 2007;143:1543-6.
31. Just M, Ribera M, Monsó E, Lorenzo JC, Ferrándiz C. Effect of smoking on skin elastic fibres: morphometric and immunohistochemical analysis. Br J Dermatol. 2007;156(1):85-91.
32. Helfrich YR; Yu L; Ofori A; Hamilton TA; Lambert J; King A; Voorhees JJ; Kang S. Effect of smoking on aging of photoprotected skin: evidence gathered using a new photonumeric scale. Arch Dermatol. 2007;143(3):397-402.
33. Oriá RB, Brito GAC, Ferreira FVA, Santana EM, Fernandes MR. Estudo das alterações relacionadas com a idade na pele humana utilizando métodos de histomorfometria e auto fluorescência. An Bras Dermatol. 2003;78(4):425-34.
34. Raduan AP; Luiz RR; Manela-Azulay M. Association between smoking and cutaneous ageing in a Brazilian population. J Eur Acad Dermatol Venereol. 2008;22(11):1312-8.
35. Fisher GJ, Kang S, Varani J, Bata-Csorgo Z, Wan Y, Datta S, Voorhees JJ . Mechanisms of photoaging and chronological skin aging.. Arch Dermatol. 2002;138(11):1462-70.
36. Nicita-Mauro V; Lo Balbo C; Mento A; Nicita-Mauro C; Maltese G; Basile G. Smoking, aging and the centenarians. Exp Gerontol. 2008;143(2):95-101.
37. Baroni ER, Biondo-Simões, ML, Auersvald A, Auersvald LA, Montemor Netto MR, Ortolan MC, et al. Influence of aging on the quality of the skin of white women: the role of collagen. Acta Cir Bras. 2012;27(10):736-40.
38. Just M; Ribera M; Monsó E; Lorenzo JC; Ferrándiz C. Effect of smoking on skin elastic fibres: morphometric and immunohistochemical analysis. Br J Dermatol. 2007;156(1):85-91.
39. Broniarczyk-Dyla G, Joss-Wichman E. Ageing of skin during menopause. J Eur Acad Dermatol Venereol. 2001;15(5):494-5.
40. Mahoney MG, Brennan D, Starcher B, Faryniarz J, Ramirez J, Parr L, et al. Extracellular matrix in cutaneous ageing: the effects of 0.1% copper-zinc malonate-containing cream on elastin biosynthesis. Exp. Dermatol. 2009;18(3):205-11.
41. Miyasaka M, Sakai S, Kusaka A, Endo Y, Kobayashi M, Kobayashi K, et al. Ultrasonic tissue characterization of photodamaged skin by scanning acoustic microscopy. Tokai J Exp Clin Med. 2005;30(4):217-25.
42. Pasquali-Ronchetti I, Baccarani-Contri M. Elastic fiber during development and aging. Microsc Res Tech. 1997;38(4):428-35.
43. Wulf HC, Sandby-Moller J, Kobayasi T, Gniadecki R. Skin aging and natural photoprotection. Micron. 2004;35(3):185-91.
44. Ortolan MCAB. Influência da idade na percentagem de material elástico e na vascularização da pele de mulheres brancas. 2012. Dissertação (Mestrado em Cirurgia) - Pontifícia Universidade Católica do Paraná.
45. Maclay JD, McAllister DA, Rabinovich R, Haq I, Maxwell S, Hartland S, et al. Systemic elastin degradation in chronic obstructive pulmonary disease. Thorax. 2012;67(7):606-12.
46. Rosado JP, Favorito LA, Cavalcanti AG, Costa WS, Cardoso LE. Structural alterations of foreskin caused by chronic smoking may explain high levels of urethral reconstruction failure using foreskin flaps. Int Braz J Urol. 2012;38(4):529-35.
47. Chung JH, Yano K, Lee MK, Youn CS, Seo JY, Kim KH, et al. Differential effects of photoaging vs intrinsic aging on de vascularization of human skin. Arch Dermatol. 2002;138(11):1437-42.
48. Chung JH, Eun HC. Angiogenesis in skin aging and photoaging. J Dermatol. 2007;34(3):593-600.
49. Li L, Mac-Mary S, Marsaut D, Sainthillier JM, Nouveau S, Gharbi T,et al. Age-related changes in skin topography and microcirculation. Arch Dermatol Res. 2006;297(9):412-6.
50. Girardeau S, Mine S, Pageon H, Asselineau D. The Caucasian and African skin types differ morphologically and functionally in their dermal component. Exp Dermatol. 2009;18(8):704-11.
1 - Doutora em Cirurgia Experimental - Professora associada do Departamento de Cirurgia da Universidade Federal do Paraná, Curitiba, PR, Brasil
2 - Mestre em Cirurgia - Dermatologista da Santa Casa de Misericórdia de Ponta Grossa, Ponta Grossa, PR, Brasil
3 - Mestre em Cirurgia - Cirurgião Plástico, Membro Titular da SBCP
4 - Cirurgião Plástico - Membro Titular da SBCP
5 - Médica - Residente em Cirurgia Geral, Hospital Angelina Caron, Campina Grande do Sul, PR, Brasil
6 - Mestre em Cirurgia - Professor de Anatomia Patológica da Universidade Estadual de Ponta Grossa, Ponta Grossa, PR, Brasil
7 - Mestre em Cirurgia - Ginecologista e Obstetra da Santa Casa de Misericórdia de Ponta Grossa, Ponta Grossa, PR, Brasil
Instituição: Pontifícia Universidade Católica do Paraná.
Autor correspondente:
Luiz Augusto Auersvald
Al. Presidente Taunay, 1756
Curitiba-PR - Brasil - CEP: 80430-000
E-mail: luizauersvald@uol.com.br
Artigo submetido: 5/2/2014
Artigo aceito: 1/6/2014


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter