

Review Article - Year 2016 - Volume 31 -
Tratamento intralesional de malformações linfáticas com ênfase na escleroterapia com picibanil (OK-432): revisão sistemática
Intralesional treatment of lymphatic malformations with emphasis on Picibanil (OK-432) sclerotherapy: a systematic review
RESUMO
INTRODUÇÃO: Conduziu-se revisão sistemática retrospectiva da literatura incluindo estudos relatando o uso de picibanil para tratar malformações linfáticas (ML).
MÉTODOS: A pesquisa foi realizada com estudos publicados no PubMed de janeiro de 1990 a 14 de abril de 2013. Na estratégia de busca, usou-se os descritores "OK-432" ou "Picibanil" e "lymphatic malformation". Os seguintes elementos foram comparados aos de outras modalidades relatadas e, então, compilados: mecanismo de ação, indicações, contraindicações, eficácia, administração, efeitos colaterais, complicações, vantagens e desvantagens.
RESULTADOS: Foram encontrados 44 estudos, 27 dos quais atenderam aos critérios de inclusão. O picibanil é uma preparação liofilizada de uma cepa de baixa virulência de Streptococcus pyogenes inativada pela penicilina G. Seu mecanismo de ação ainda não definido claramente, mas especula-se que provoque uma resposta inflamatória controlada com adesão das paredes dos cistos. O picibanil é indicado quase que unanimemente para o tratamento da ML macrocística, cuja resposta é mais efetiva do que em lesões microcísticas ou mistas. Em geral, o picibanil é administrado por meio de punção com visualização direta ou guiada por ultrassonografia, com o paciente sob anestesia geral. A preparação comumente utilizada consiste em 0,1 mg de picibanil em 10 ml de soro fisiológico. Os efeitos colaterais são, em geral, leves; sendo dor, inchaço e febre os mais frequentemente relatados.
CONCLUSÃO: Os estudos apresentam pouca evidência científica. A revisão sistemática identificou que o picibanil é útil no tratamento da ML de qualquer tipo, mas tem resultados melhores em lesões macrocísticas. A eficácia foi comparável à de outras terapias. Não foi apresentada nenhuma contraindicação específica. Embora o mecanismo de ação ainda não tenha sido determinado, o picibanil trata-se de opção de tratamento.
Palavras-chave: Anormalidades linfáticas; Terapêutica; Escleroterapia; Picibanil; Streptococcus pyogenes.
ABSTRACT
INTRODUCTION: We performed a retrospective systematic review of studies reporting the use of Picibanil for treatment of lymphatic malformations (LMs).
METHODS: We searched the PubMed database for available studies, including those published between January 1990 and April 14, 2013. The search strategy involved the use of the keywords "OK-432" or "Picibanil" and "lymphatic malformation." Information was compiled regarding the reported mechanism of action, indications, contraindications, efficacy, administration, side effects, complications, and advantages and disadvantages compared to those of other modalities.
RESULTS: Forty-four studies were found, of which 27 fulfilled the inclusion criteria. Picibanil is a lyophilized preparation of a low-virulence strain of Streptococcus pyogenes inactivated with penicillin G. Its mechanism of action is unclear, but it has been speculated that it causes a controlled inflammatory response with adhesion of cyst walls. Picibanil is almost unanimously indicated for the treatment of macrocystic LMs, which show a greater effectiveness response compared to that shown by microcystic or mixed LMs. Picibanil is usually administered by puncturing, either with direct visualization or guided by ultrasound, with the patient under general anesthesia. The most widely used preparation comprises 0.1 mg of Picibanil in 10 mL of saline. Side effects are mostly mild, with pain, swelling, and fever being the most frequently reported.
CONCLUSION: The studies had low scientific evidence. A systematic review found that Picibanil is useful against any LM, with better results in macrocystic lesions. Efficacy was comparable to that of other therapies. No specific contraindication was presented. Although the mechanism of action has not been established, the inclusion of Picibanil as a treatment option is warranted.
Keywords: Lymphatic abnormalities; Therapeutics; Sclerotherapy; Picibanil; Streptococcus pyogenes.
As malformações linfáticas (ML) - previamente denominadas de linfangioma ou higroma cístico - são uma anomalia vascular congênita relativamente incomum1,2. A literatura descreve essa doença como uma lesão hamartomatosa benigna que compromete a pele e os tecidos subcutâneos ou uma massa cística benigna decorrente do desenvolvimento anormal dos vasos linfáticos1-5.
Mais da metade das lesões da ML (50% a 75%) já está presente no nascimento, mas é comum que os sintomas se tornem mais evidentes no decorrer da infância. Segundo Zhou et al.6, de 80% a 90% dos casos não aparentes no nascimento são diagnosticados por volta dos 2 anos de idade.
É comum que as áreas de malformações linfáticas ocupem a região cervicofacial (75% dos casos). As principais regiões acometidas são a língua, lábios e mucosa oral3,4,6; outros locais frequentes são a axila e o mediastino2,5.
A ML é caracterizada histologicamente por cistos de tamanhos variados, constituídos por células endoteliais e preenchidos por líquido linfático2. A classificação da International Society for the Study of Vascular Anomalies (ISSVA) categoriza os tipos de ML como macrocístico, microcístico e misto. A apresentação clínica da ML compreende lesões translúcidas, podendo ter aparência avermelhada ou amarelada em caso de comprometimento da mucosa. Os cistos linfáticos também poderão conter sangue ou secreção purulenta, se houver sangramento ou infecção6.
Além da desfiguração física, o comprometimento do fluxo linfático na ML pode provocar disfunções graves2,4,5. O crescimento progressivo pode provocar compressão de estruturas vitais adjacentes, como a traqueia, grandes vasos e nervos1,6. Se localizada nos espaços torácico ou abdominal, a ML pode desencadear derrames e ascite, podendo acarretar futuramente uma insuficiência respiratória1.
O tratamento da ML compreende diversos procedimentos por meio de radiologia intervencionista ou cirurgia. Não há consenso sobre a abordagem mais efetiva para todos os quadros clínicos. No entanto, os agentes intralesionais parecem ser, no mínimo, uma alternativa menos invasiva que as opções cirúrgicas.
Diversos agentes esclerosantes já foram empregados na abordagem intralesional, como solução de glicose hipertônica, etanol, quinina, doxiciclina, morruato de sódio, corticosteroides, bleomicina e picibanil. Os agentes mais usados atualmente são doxiciclina, bleomicina, etanol e picibanil.
O picibanil - também conhecido como OK-432 (Chugai Pharmaceutical Co. LTD, Japão) - é uma preparação liofilizada de uma cepa (Su) de baixa virulência de Streptococcus pyogenes (S. hemolyticus) inativada por calor e penicilina G. O medicamento era originalmente usado como um imunoestimulante inespecífico no tratamento de malignidades, particularmente em tumores digestivos e pleurais associados a ascite e hidrotórax2,6,7.
O picibanil ainda não é comercializado no mundo todo e não foi aprovado pela Food and Drug Administration (FDA), nos EUA. O medicamento foi estudado na Europa, Japão e América do Sul, tendo sido recomendado por alguns grupos como um tratamento primário da ML, em decorrência de sua fácil aplicação, ausência de cicatrização e por ser menos agressivo a estruturas adjacentes2,6,7. O mecanismo de ação exato desse medicamento, porém, ainda não foi totalmente elucidado2.
Entre os estudos clínicos disponíveis, encontra-se majoritariamente estudos de casuística com protocolos independentes. Consequentemente, os estudos apresentam pouca evidência científica, o que impede a recomendação segura desse método de tratamento. A revisão sistemática é uma metodologia importante e útil para apresentar dados mais consistentes sobre a eficácia e segurança do uso de picibanil no tratamento da ML.
O principal objetivo deste estudo foi realizar uma revisão sistemática de estudos que relatassem o uso de picibanil no tratamento da ML, incluindo-se mecanismo de ação, indicações, contraindicações, eficácia, administração, efeitos colaterais, complicações, vantagens e desvantagens.
MÉTODO
O presente estudo foi aprovado pelo Comitê de Ética em Pesquisa da FMUSP (Faculdade de Medicina da Universidade de São Paulo), com o protocolo de número 045/14.
Foi realizada uma revisão sistemática dos estudos disponíveis no banco de dados PubMed, publicados de janeiro de 1990 a junho de 2014. Na estratégia de busca, usou-se as palavras "OK-432" ou "Picibanil" e "lymphatic malformation".
Os critérios de inclusão foram os seguintes:
• Artigos, inclusive relatos de caso, estudos de casuística, estudos comparativos, artigos originais e revisões;Se disponíveis no estudo, o mecanismo de ação, indicações, contraindicações, eficácia, administração, efeitos colaterais, complicações, vantagens e desvantagens comparados aos de outras opções de tratamento foram reunidos e analisados.
• Artigos disponíveis integralmente;
• Artigos publicados no idioma inglês;
• Artigos sobre o tratamento intralesional da ML de tecidos moles.
RESULTADOS
Foram identificados 44 estudos pela estratégia de busca, 27 dos quais atenderam aos critérios de inclusão. Os estudos excluídos não estavam integralmente disponíveis (7 estudos), não tinham sido escritos no idioma inglês (1 estudo) ou estavam fora do escopo deste estudo (9 estudos).
1. Definição: o que é picibanil?
O picibanil, produzido exclusivamente pela Chugai Pharmaceuticals, em Tóquio, Japão8, é uma preparação de uma cepa de baixa virulência de Streptococcus pyogenes, grupo A, de origem humana, tratada com benzilpenicilina G e aquecida. A preparação liofilizada perde a capacidade de produzir estreptolisina - e, consequentemente, a atividade tóxica -, mas preserva suas propriedades imunofarmacológicas responsáveis pela regressão da ML. Foram relatadas definições e classificações diversas do picibanil, descritas na Tabela 1.
O picibanil também é conhecido na literatura como OK-432. Destaca-se que, embora a maioria dos autores prefira a nomenclatura "OK-432" (19 de 21 artigos), os dois termos ("OK-432" e "picibanil") foram adotados em todos os artigos tratados neste manuscrito (Tabela 1).
2. Mecanismo de ação
O tratamento com picibanil foi apresentado por Peter et al., em 1987, e, segundo esses autores, evidenciouse como uma modalidade terapêutica segura com eventos adversos menos frequentes que na cirurgia2,9.
O mecanismo exato de ação do picibanil ainda não foi totalmente compreendido, mas assume-se que provoque uma resposta inflamatória controlada com efeitos citotóxicos acarretando fibrose, colapso das paredes da ML, obstrução dos cistos e remissão3,8. O efeito na parede dos cistos é considerado esclerosante. O picibanil é usado no tratamento da ML por sua ação esclerosante7, sendo recomendado como tratamento eletivo por muitos autores2.
Segundo estudos publicados, a administração de picibanil produz um aumento de células natural killer, células LAK (células killer ativadas por linfocina) e até mesmo de linfócitos e macrófagos CD3. Ademais, acredita-se que esse medicamento estimule a liberação de interferona (alfa, beta e gama), TNF (fator de necrose tumoral) e interleucinas (IL1, IL2 e IL6)1-3. A associação desses fatores aumenta a permeabilidade endotelial da ML e favorece a drenagem linfática. Consequentemente, os espaços císticos são esvaziados, o que acarreta colapso e esclerose e resulta em diminuição da lesão7,10. Outros estudos afirmam que a ação do picibanil se restringe à lesão e ocorre por meio de imunoestimulação inespecífica que compreende a ativação das células endoteliais, resultando em obliteração dos canais linfáticos com fibrose local mínima6. A Tabela 2 resume as informações sobre o mecanismo de ação do medicamento.
3. Indicações
A indicação de picibanil para lesões macrocísticas foi unânime. Os estudos que usaram esse medicamento exclusivamente em lesões microcísticas foram menos comuns na literatura. Dos 23 estudos clínicos ou metanalíticos, 19 apresentavam informações sobre a indicação do uso de picibanil. Este foi indicado exclusivamente para o tratamento de lesões macrocísticas em 248 pacientes; ML microcística isolada, em 92 pacientes; e lesões mistas, em 27 casos (Tabela 3). Os pacientes geralmente apresentavam remissão completa ou respostas favoráveis ao tratamento da ML macrocística, independentemente do tamanho da lesão. Embora alguns autores relatassem desfechos insatisfatórios na ML microcística10-16, outros afirmaram que injeções repetidas de picibanil podiam ter bons resultados1,14.
4. Contraindicações
O uso de picibanil é formalmente contraindicado em pacientes com histórico de alergia a betalactâmicos, em decorrência do risco de reação anafilática7,10. Surpreendentemente, essa contraindicação foi mencionada em apenas 8 dos 27 estudos (29,2%).
Alguns autores consideram a falta de uma resposta efetiva após diversas injeções como uma contraindicação para tentativas futuras. Hong et al. afirmaram que o fato de uma resposta não ser observada em três tentativas constitui uma contraindicação para outras injeções4.
5. Efetividade
Ogita et al. 11 foram os primeiros a confirmar o sucesso do tratamento da ML com picibanil, em 1996. Diversos estudos comprovaram a grande eficácia desse medicamento, particularmente no tratamento da ML macrocística12. Em geral, os pacientes com ML macrocística apresentam uma resposta clínica boa ou total ao tratamento, com remissão, independentemente do tamanho da lesão13. Os pacientes com ML microcística ou mista (macro e microcística), porém, não apresentam um desfecho satisfatório13. As malformações linfovenosas também apresentaram uma resposta insatisfatória, em comparação à ML pura13.
Claesson e Kuylenstierna14 descreveram a experiência de tratar 32 pacientes com ML (28 crianças, 3 adolescentes e 1 adulto). O desfecho foi excelente em todas as vinte e oito lesões de ML macrocística, exceto uma, tratada previamente com etanol. Ainda, nenhum dos quatro pacientes com ML microcística precisou de mais tratamento, em dois dos quais o desfecho foi considerado excelente. Em outro estudo, Wheeler et al.16 conduziram uma revisão de prontuários de sete crianças tratadas com picibanil. Quatro destas apresentavam lesões acometendo a axila e/ou parede torácica, duas apresentavam comprometimento de tecidos da nuca não milo-hióideos e apenas uma criança apresentava comprometimento por ML da língua, assoalho da boca e de um componente não milo-hióideo. Os autores concluíram que as lesões macrocísticas apresentaram excelente respostas à terapia com picibanil, mas que a efetividade em lesões microcísticas foi inferior à esperada.
Mello-Filho et al.15 realizaram um estudo retrospectivo com seis crianças diagnosticadas com ML da cabeça e nuca, tratadas com picibanil. O tipo mais frequentemente encontrado foi a ML macrocística. Todos os pacientes apresentaram regressão da massa e, em três pacientes, houve remissão total.
Em 2006, Peters et al.13 relataram um estudo de casuística com 12 pacientes, seis dos quais apresentavam malformações macrocísticas; e os outros seis, malformações microcísticas ou linfovenosas mistas. Dez anormalidades localizavam-se na cabeça e na nuca; e as outras duas, nos membros. Todos os pacientes com anormalidades macrocísticas apresentaram remissão total ou boa resposta clínica ao tratamento com picibanil, sem tratamento adicional. Em contraste, os pacientes com malformações microcísticas ou lesões linfovenosas mistas tiveram uma resposta insatisfatória. Destaca-se que o tamanho e o local da lesão não se correlacionaram à resposta ao tratamento.
Poldervaart et al.3 fizeram uma busca na literatura por estudos em inglês com cinco ou mais pacientes com ML sem tratamento prévio. Nos resultados, observou-se que 27% das lesões de ML microcística apresentaram um desfecho excelente (ou seja, uma regressão superior a 90%); 33% apresentaram um bom desfecho (redução superior a 50%); e 40% apresentaram um desfecho insatisfatório (redução inferior a 50%). Em contraste, nos estudos sobre ML macrocística, observou-se 88% de desfechos excelentes. De modo semelhante, Churchill et al.5, 2011, realizaram uma revisão de literatura sobre o tratamento da ML por escleroterapia com picibanil em pacientes pediátricos (n = 318 casos). Sessenta e seis porcento dos pacientes com lesões macrocísticas apresentaram desfechos excelentes com a escleroterapia, enquanto apenas vinte e três porcento dos pacientes com lesões microcísticas apresentaram o mesmo desfecho.
Embora a ML seja congênita e, em geral, localize-se na região cervicofacial, foi observada uma resposta satisfatória independentemente da região, inclusive em lesões retroperitoneais grandes, sem prejuízo relativo à idade10 (Tabela 4).
Ono et al.1, 2010, relataram o tratamento bemsucedido com picibanil de dois pacientes com ML microcística e derrame pleural ou ascite. No primeiro caso, o neonato apresentava ML microcística acometendo a cavidade abdominal, circundando veia porta e estendendo-se ao retroperitônio. Aos 5 meses de idade, o bebê desenvolveu um derrame pleural quiloso grande e ascite, que foram drenados. Foi injetado 0,1 mg de picibanil (10 ml) pelo dreno, nas cavidades abdominal e pleural, por meio de toracoscopia.
A ascite e o derrame pleural diminuíram gradualmente no decorrer dos dois meses seguintes. Após seis meses, o bebê já não apresentava derrame pleural ou ascite, independentemente da persistência da ML microcística abdominal. O segundo caso foi de um paciente de 26 anos de idade com ascite quilosa e ML microcística difusa na virilha e coxa. Por meio de laparoscopia, foi injetado 0,1 mg de picibanil (10 ml) diretamente na ML retroperitoneal. A ascite quilosa se remitiu totalmente após dois meses e o paciente permaneceu estável, sem ascite, por cinco anos1.
Embora os estudos acima corroborem a eficácia do OK-432, as evidências de sua efetividade não provêm de estudos clínicos randomizados e controlados. Nenhum estudo avalia esse sucesso objetivamente como, por exemplo, com um observador independente do médico responsável pelo tratamento, para que se apresente mais evidência clínica.
6. Administração
Recomenda-se realizar um teste cutâneo de alergia a betalactâmicos antes da administração6.
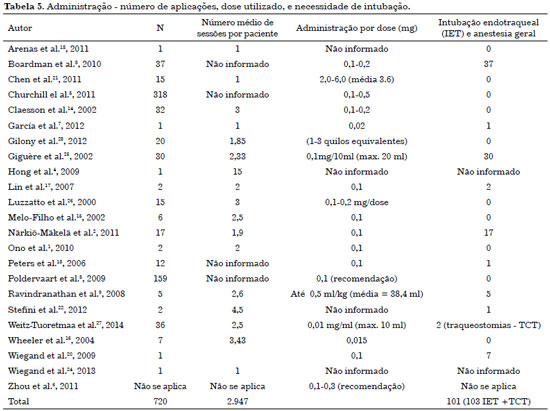
Em crianças, o procedimento é realizado sob anestesia geral3,12 e a preparação mais usada é 0,1 mg de picibanil misturado a 10 ml de soro fisiológico3,10,11. Assegura-se a patência das vias aéreas por meio de intubação endotraqueal durante a escleroterapia da ML cervicofacial que cubra uma região ampla, comprometendo a língua, assoalho da boca, palato mole e região parafaringal, pois um edema pode se desenvolver e causar obstrução das vias aéreas6.
A via de acesso mais utilizada é a punção direta guiada por ultrassonografia. Após o conteúdo da lesão ser aspirado, a agulha (calibre 7)6 deve permanecer no local para a injeção do mesmo volume da solução de picibanil3,12. A injeção é, em geral, realizada em pontos e direções diferentes, até que se atinja a expansão cística. A maioria dos estudos recomenda não exceder uma quantidade total de 20 ml6,10. A Tabela 5 descreve a quantidade média de aplicações, doses e indicação para intubação traqueal.
Segundo García et al.7, caso haja indicação, outra sessão de tratamento deve ser realizada de 3 a 6 semanas após o 1º procedimento, na qual deve-se aumentar a dose para 0,3 mg (30 ml). Posteriormente, se houver necessidade de tratamento adicional, o intervalo adequado deverá ser de 1 a 1,5 mês. Outros autores, que sugerem uma dose terapêutica de 0,02 mg de picibanil, recomendam uma 2ª dose de igual quantidade após 10 a 15 dias.
O uso de picibanil na ML microcística é controverso, pois há relatos de desfechos insatisfatórios no tratamento desse tipo de lesão12. Outros autores, por sua vez, afirmam que injeções intralesionais repetidas de picibanil possam ter bons resultados6. Nesses casos, a injeção não é considerada totalmente intracística e os efeitos do picibanil podem ocorrem nos microcistos ou no interstício da lesão.
7. Efeitos colaterais e complicações
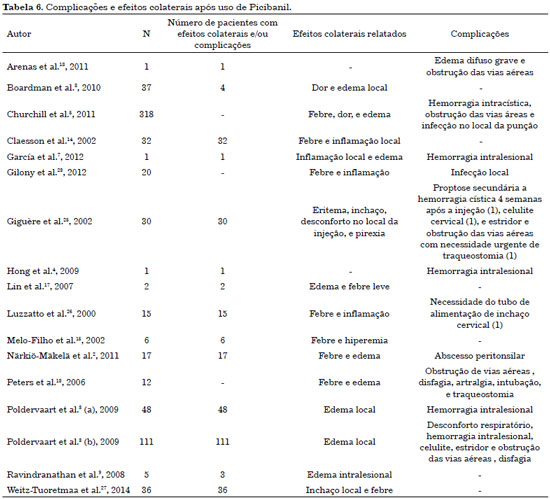
Os efeitos colaterais relatados podem ser categorizados como locais ou sistêmicos (Tabela 6). Dor, inchaço e eritema com duração de três a sete dias2,6,12 são relatados frequentemente. Quase todos os pacientes apresentam hipetermia baixa (38 °C a 39 °C) em até 6 horas da injeção, com melhora 2 a 4 dias depois do procedimento. Na revisão de literatura conduzida por et al.3, 2009, quase todos os pacientes (48) apresentaram febre (38 °C a 39 °C) associada à inflamação local e letargia após o tratamento. Esses eventos adversos se remitiram em cerca de uma semana.
Também foram descritas outras complicações, como celulite cervical e proptose demandando descompressão de emergência; abscesso cervical com necessidade de drenagem cirúrgica; lesão dos nervos adjacentes; e necrose da pele sobre a ML9. Para tratar cavidades císticas muito pequenas, o agente esclerosante pode ser injetado imperceptivelmente nos tecidos circundantes. O extravasamento pode também ser inevitável e, em última instância, provocar lesão dos nervos e tecidos saudáveis adjacentes17.
Segado Arenas et al.18, 2011, relataram um caso de ML microcística da língua em um menino de 5 anos de idade que apresentou, na primeira infiltração de picibanil, edema difuso grave, obstrução progressiva das vias aéreas superiores e dificuldade respiratória que demandou intubação traqueal de emergência. Os autores concluíram que, embora as injeções de picibanil sejam consideradas seguras e efetivas como tratamento de primeira escolha para a ML, deve-se considerar a possibilidade de edema local com comprometimento possivelmente fatal das vias aéreas.
Embora a facilidade de aplicação e a ausência de cicatrização sejam vantajosas, a reação inflamatória local confere controvérsia ao uso de picibanil em locais específicos7.
DISCUSSÃO
As malformações linfáticas são definidas como malformações vasculares de baixo fluxo. Os subtipos microcístico, macrocístico e misto se comportam diferentemente com as diversas opções de tratamento. Termos descritivos obsoletos - como higroma cístico, linfangioma ou malformações cavernosas - devem ser evitados.
A ML microcística apresenta uma grande quantidade de tecido conjuntivo fibroso entre os cistos pequenos. Esse tipo de lesão tende a ser mais difusa, maldefinida e ter protrusões digitiformes nos tecidos adjacentes. Os cistos são de difícil tratamento, tanto com escleroterapia quanto com remoção cirúrgica total. A ML macrocística tende a ser mais bem-definida e, em geral, responder melhor à escleroterapia, independentemente da área afetada.
A localização mais comum da ML é a região cervicofacial. Serres et al.19 propuseram uma classificação da ML cervicofacial com implicações terapêuticas, correlacionando o local à gravidade.
Classificação de Serres:
• Estágio 1: infra-hióidea unilateral.Língua, lábios, mucosa oral e assoalho da boca são as principais partes afetadas20. Deve-se prestar especial atenção às lesões no assoalho da boa, orofaringe e nuca, pois podem comprometer a patência das vias aéreas em consequência do local anatômico ou do manejo. Alguns autores recomendam retardar a intubação endotraqueal21 - após escleroterapia da ML microcística em áreas extensas -como meio de liberação da obstrução esperada das vias aéreas, causada por edema inflamatório3,6,12.
• Estágio 2: supra-hióidea unilateral.
• Estágio 3: supra-hióidea e infra-hióidea unilateral.
• Estágio 4: supra-hióidea bilateral.
A evolução da ML pode causar macroglossia, protrusão da língua, deformidades ósseas, anomalias dentárias, como prognatismo mandibular, maloclusão e deformidades estéticas. O comprometimento funcional da respiração, mastigação, deglutição e fala, assim como problemas psicológicos, são possíveis consequências. A ML se apresenta na forma de lesões instáveis que podem aumentar rapidamente após infecção, trauma, radioterapia, sangramento ou alterações nos níveis hormonais.
A remissão espontânea já foi descrita na literatura, mas pode ser seguida por recorrência. Portanto, a abordagem mais justificável é indicar uma modalidade de tratamento com respostas clínicas rápidas e efetivas.
Historicamente, o tratamento da ML se restringiu à excisão cirúrgica. Embora esta seja razoavelmente efetiva, lesões maldemarcadas, uma associação íntima às estruturas vitais adjacentes, altos índices de recorrência e riscos de complicações motivaram o desenvolvimento de abordagens menos invasivas22-24.
O desenvolvimento de alternativas terapêuticas, portanto, tem sido importante nas últimas décadas. Embora diversos agentes esclerosantes tenham sido descritos, o picibanil destaca-se na literatura como uma opção efetiva para a escleroterapia da ML. "Picibanil" e "OK-432" foram usados como sinônimos em quase todos os estudos, mas o termo "OK-432" predominou.
O mecanismo exato de ação ainda não foi esclarecido, e as hipóteses para tal podem ser agrupadas em duas teorias parcialmente contraditórias que precisam ser mais bem-elucidadas: aumento da permeabilidade endotelial, que causa drenagem ou absorção do conteúdo cístico7,10, e resposta endotelial por obliteração ou esclerose dos canais linfáticos malformados com fibrose mínima3,6,7,8.
Os pacientes que não apresentarem remissão total após escleroterapia com picibanil serão candidatos à cirurgia. O pré-tratamento com picibanil não compromete a dissecção cirúrgica. Como não há um método capaz de tratar idealmente as malformações linfáticas, com remissão total em 100% dos casos, deve-se considerar uma terapia que compreenda mais de uma modalidade como opção de tratamento, inclusive com associação de escleroterapia e cirurgia.
Os eventos adversos relatados após escleroterapia com picibanil são menos frequentes comparados aos da cirurgia ou de outros agentes esclerosantes. Os estudos publicados, porém, apresentam poucas evidências. É essencial que se conduza estudos clínicos controlados prospectivos para definir o real estado dos efeitos e da eficácia em longo prazo25-27.
Pode ocorrer lesão dos nervos e tecidos adjacentes no tratamento da ML microcística com escleroterapia. Acredita-se que isquemia e neurotoxicidade não sejam fatores presentes no uso de picibanil. Foram relatadas alterações temporárias na função dos nervos faciais após a aplicação de picibanil, na forma de injeções na região da parótida. A extensão e a compressão dos ramos nervosos foram consideradas os mecanismos causadores17. Efeitos relacionados à superdosagem por absorção de picibanil são raros, mas já foram descritos - como, por exemplo, cardiotoxicidade.
Destaca-se que esta revisão apresente uma limitação importante à generalização dos achados, visto que a maioria dos estudos consiste em relatos de caso, estudos retrospectivos e revisão de literatura, o que impossibilita a avaliação estatística de todos os dados coletados. De todo modo, essa é a realidade que se constata na literatura disponível para embasar a discussão e a prática clínicas.
Embora os estudos sejam de pouca evidência científica, observou-se nesta revisão sistemática que o picibanil pode ser usado em qualquer malformação linfática - sendo os melhores desfechos observados em lesões macrocísticas - e que sua eficácia relatada é comparável, senão superior, à de outras modalidades de tratamento. Não foi apresentada nenhuma contraindicação específica e, independentemente de o mecanismo de ação ainda não ter sido determinado claramente, a inclusão desse medicamento entre as opções de tratamento é justificável.
COLABORAÇÕES
OHGP Análise e/ou interpretação dos dados; análise estatística; aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
DCG Análise e/ou interpretação dos dados; análise estatística; aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
RG Aprovação final do manuscrito; redação do manuscrito ou revisão crítica de seu conteúdo.
REFERÊNCIAS
1. Ono S, Iwai N, Chiba F, Furukawa T, Fumino S. OK-432 therapy for chylous pleural effusion or ascites associated with lymphatic malformations. J Pediatr Surg. 2010;45(9):e7-10.
2. Närkiö-Mäkelä M, Mäkelä T, Saarinen P, Salminen P, Julkunen I, Pitkäranta A. Treatment of lymphatic malformations of head and neck with OK-432 sclerotherapy induce systemic inflammatory response. Eur Arch Otorhinolaryngol. 2011;268(1):123-9.
3. Poldervaart MT, Breugem CC, Speleman L, Pasmans S. Treatment of lymphatic malformations with OK-432 (Picibanil): review of the literature. J Craniofac Surg. 2009;20(4):1159-62.
4. Hong JP, Lee MY, Kim EK, Seo DH. Giant lymphangioma of the tongue. J Craniofac Surg. 2009;20(1):252-4.
5. Churchill P, Otal D, Pemberton J, Ali A, Flageole H, Walton JM. Sclerotherapy for lymphatic malformations in children: a scoping review. J Pediatr Surg. 2011;46(5):912-22.
6. Zhou Q, Zheng JW, Mai HM, Luo QF, Fan XD, Su LX, et al. Treatment guidelines of lymphatic malformations of the head and neck. Oral Oncol. 2011;47(12):1105-9.
7. García AL, Navarro RB, Cardeñosa AL, Navarro CD. Resultado sin éxito en el tratamiento de un linfangioma orbitario con OK-432. Arch Soc Esp Oftalmol. 2012;87(1):17-9.
8. Boardman SJ, Cochrane LA, Roebuck D, Elliott MJ, Hartley BE. Multimodality treatment of pediatric lymphatic malformations of the head and neck using surgery and sclerotherapy. Arch Otolaryngol Head Neck Surg. 2010;136(3):270-6.
9. Ravindranathan H, Gillis J, Lord DJ. Intensive care experience with sclerotherapy for cervicofacial lymphatic malformations. Pediatr Crit Care Med. 2008;9(3):304-9.
10. Cabrera J, Redondo P. Tratamiento esclerosante de las malformaciones vasculares. An Sist Sanit Navarra. 2004;Suppl 1:117-26.
11. Ogita S, Tsuto T, Nakamura K, Deguchi E, Tokiwa K, Iwai N. OK-432 therapy for lymphangioma in children: why and how does it work? J Pediatr Surg. 1996;31(4):477-80.
12. Breugem CC, Courtemanche DJ. Portable ultrasound-assisted injection of OK-432 in lymphatic malformations by the plastic surgeon. J Plast Reconstr Aesthet Surg. 2008;61(10):1269-70.
13. Peters DA, Courtemanche DJ, Heran MK, Ludemann JP, Prendiville JS. Treatment of cystic lymphatic vascular malformations with OK-432 sclerotherapy. Plast Reconstr Surg. 2006;118(6):1441-6.
14. Claesson G, Kuylenstierna R. OK-432 therapy for lymphatic malformation in 32 patients (28 children). Int J Pediatr Otorhinolaryngol. 2002;65(1):1-6.
15. Mello-Filho FV, Tone LG, Kruschewsky LS. O uso de Picibanil (OK-432) no tratamento do linfangioma de cabeça e pescoço. Rev Bras Otorrinolaringol. 2002;68(4):552-6.
16. Wheeler JS, Morreau P, Mahadevan M, Pease P. OK-432 and lymphatic malformations in children: the Starship Children's Hospital experience. ANZ J Surg. 2004;74(10):855-8.
17. Lin PJ, Guo YC, Lin JY, Chang YT. Facial nerve conduction after sclerotherapy in children with facial lymphatic malformations: report of two cases. Tohoku J Exp Med. 2007;211(4):401-6.
18. Segado Arenas A, Flores González JC, Rubio Quiñones F, Quintero Otero S, Hernández González A, Pantoja Rosso S. Obstruction iatrogène sévère de la voie aérienne par un lymphangiome lingual. Arch Pediatr. 2011;18(9):983-6.
19. de Serres LM, Sie KC, Richardson MA. Lymphatic malformations of the head and neck. A proposal for staging. Arch Otolaryngol Head Neck Surg. 1995;121(5):577-82.
20. Wiegand S, Eivazi B, Zimmermann AP, Neff A, Barth PJ, Sesterhenn AM, et al. Microcystic lymphatic malformations of the tongue: diagnosis, classification, and treatment. Arch Otolaryngol Head Neck Surg. 2009;135(10):976-83.
21. Chen WL, Huang ZQ, Chai Q, Zhang DM, Wang YY, Wang HJ, et al. Percutaneous sclerotherapy of massive macrocystic lymphatic malformations of the face and neck using fibrin glue with OK-432 and bleomycin. Int J Oral Maxillofac Surg. 2011;40(6):572-6.
22. Stefini S, Bazzana T, Smussi C, Piccioni M, Frusca T, Taddei F, et al. EXIT (Ex utero Intrapartum Treatment) in lymphatic malformations of the head and neck: discussion of three cases and proposal of an EXIT-TTP (Team Time Procedure) list. Int J Pediatr Otorhinolaryngol. 2012;76(1):20-7.
23. Gilony D, Schwartz M, Shpitzer T, Feinmesser R, Kornreich L, Raveh E. Treatment of lymphatic malformations: a more conservative approach. J Pediatr Surg. 2012;47(10):1837-42.
24. Wiegand S, Eivazi B, Bloch LM, Zimmermann AP, Sesterhenn AM, Schulze S, et al. Lymphatic malformations of the orbit. Clin Exp Otorhinolaryngol. 2013;6(1):30-5.
25. Giguère CM, Bauman NM, Sato Y, Burke DK, Greinwald JH, Pransky S, et al. Treatment of lymphangiomas with OK-432 (Picibanil) sclerotherapy: a prospective multi-institutional trial. Arch Otolaryngol Head Neck Surg. 2002;128(10):1137-44.
26. Luzzatto C, Midrio P, Tchaprassian Z, Guglielmi M. Sclerosing treatment of lymphangiomas with OK-432. Arch Dis Child. 2000;82(4):316-8.
27. Weitz-Tuoretmaa A, Rautio R, Valkila J, Keski-Säntti H, Keski-Nisula L, Laranne J. Efficacy of OK-432 sclerotherapy in treatment of lymphatic malformations: long-term follow-up results. Eur Arch Otorhinolaryngol. 2014;271(2):385-90.
Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP, Brasil
Instituição: Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP, Brasil.
Autor correspondente:
Dov Goldenberg
Rua Arminda 93 cj. 121
São Paulo, SP, Brasil CEP 04545-100
E-mail: dov.goldenberg@hc.fm.usp.br
Artigo submetido: 10/2/2016.
Artigo aceito: 23/6/2016.
Conflitos de interesse: não há.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter