

Reviw Article - Year 2016 - Volume 31 -
Enxerto autólogo de células-tronco derivadas do tecido adiposo: uma nova visão de sua aplicação no tratamento de queimados e na cirurgia plástica reparadora
Adipose tissue-derived stem cell autologous grafts: a new approach to application in the treatment of burn victims and reconstructive plastic surgery
RESUMO
No Brasil, 1 milhão de acidentes com queimaduras acontecem por ano e as infecções são responsáveis por 75% dos óbitos nestes pacientes, além de deixar lesões que ocasionam deformidades nas áreas atingidas. Sendo assim, o objetivo deste trabalho é fornecer uma visão atual sobre células-tronco mesenquimais (MSCs), com ênfase nas células-tronco derivadas do tecido adiposo (ADSCs), associadas a gel de plasma, gel de fibrina e membranas (scaffold). O uso de géis e membranas tendem a auxiliar o crescimento celular visando sua possível aplicação na Cirurgia Plástica Reparadora para o tratamento pacientes queimados ou que necessitam de enxerto de pele. O presente trabalho abordou de forma exploratória e narrativa o tema células-tronco mesenquimais, células-tronco mesenquimais derivadas do tecido adiposo, gel de fibrina, gel de plasma e scaffold. O tipo de pesquisa empregada foi conduzido com coleta de informações utilizando-se a Biblioteca Virtual em Saúde (BVS) e PubMed. O número absoluto de artigos publicados relacionados ao tratamento de queimaduras é considerável. Até o momento, a quantidade de pesquisas relacionadas à terapia com células-tronco derivadas do tecido adiposo, gel de fibrina, gel de plasma e scaffold para o tratamento de queimaduras apresenta-se escassa. O autoenxerto de ADSCs associado a biocurativos torna-se uma perspectiva promissora na Cirurgia Plástica Reparadora para o tratamento e recuperação de pacientes que sofreram queimaduras ou outros acidentes que necessitam de enxerto de pele. Estes recursos podem reduzir a dor e prover a dessecação da lesão, promovendo neovascularização e a reepitelização da ferida.
Palavras-chave: Células-tronco; Procedimentos cirúrgicos reconstrutivos; Bioprótese; Pele; Tecido adiposo.
ABSTRACT
In Brazil, 1 million burn accidents occur annually, and subsequent wound infections account for 75% cases of deaths among these patients, in addition to inducing deformities in the affected areas. Therefore, the aim of this study was to discuss the current status of mesenchymal stem cells, with an emphasis on adipose-derived stem cells (ADSCs), in combination with plasma gel, glue fibrin, and membranes (scaffold). The use of gels and membranes supports cell growth, and aims at potential application in reconstructive plastic surgery for the treatment of burn patients or individuals requiring skin grafts. This study explores and discusses the role of mesenchymal stem cells, adipose-derived mesenchymal stem cells, glue fibrin, plasma gel, and the scaffold. This research collected information from the Virtual Health Library (VHL) and PubMed. A considerable number of articles have been published on burn treatment. However, there is little research on burn treatment with ADSCs, glue fibrin, plasma gel, and scaffold. An ADSC autograft combined with a biological dressing is promising in reconstructive plastic surgery for the treatment and recovery of burn patients or individuals with other injuries that require skin grafts. These features can reduce pain and aid in drying of the lesion, thus promoting neovascularization and wound reepithelialization.
Keywords: Stem cells; Reconstructive surgical procedures; Bioprostheses; Skin; Adipose tissue.
Estimativas apontam que, entre os casos de queimaduras notificados no País, a maior parte acontece nas residências das vítimas e quase a metade das ocorrências envolve a participação de crianças1. Recentemente, a Organização Mundial da Saúde2 referiu que as queimaduras no corpo causam a morte de 195.000 pessoas todos os anos e quase 11 milhões de pessoas sofrem queimaduras graves o suficiente para exigir atenção médica.
Somado a isso, as infecções são responsáveis por 75% dos óbitos em pacientes queimados, devido à perda da proteção da pele e a presença de tecidos desvitalizados, o que proporciona um excelente meio para o desenvolvimento e a proliferação de microrganismos, favorecendo a instalação de quadros de bacteremia e septicemia3. Dados recentes, segundo estimativas do Ministério da Saúde4, mostram que o valor médio gasto com o tratamento de pacientes queimados que necessitam de internação hospitalar no Brasil chega a R$ 1 milhão por mês.
Atualmente, para o tratamento de lesões crônicas é disponibilizada no mercado uma variedade de curativos com a intenção de promover a neovascularização, a formação de tecido de granulação e o fechamento da ferida. Dentre os curativos, podemos citar os de primeira geração, com utilização de biomateriais, e os de segunda geração, com a utilização destes associados à terapia celular com uso de células-tronco5.
A enxertia de pele é um dos procedimentos utilizados para o tratamento de pessoas que sofreram queimaduras ou outros acidentes que envolvam a perda tecidual. Para ajudar a sanar o problema da perda da pele, o Banco de Pele do Brasil trabalha com doações de pele cadavéricas para posterior enxertia. Porém, a disponibilidade de pele homóloga ainda é muito limitada e tal tipo de enxerto apresenta a desvantagem de permanecer temporariamente sobre a ferida6. Em virtude disso, procuram-se enxertos que possam cobrir permanentemente a área afetada e que não seja rejeitado pele receptor. Neste contexto, o enxerto autólogo torna-se ideal para o tratamento de pessoas com grandes áreas corpóreas expostas por apresentar estas características.
Recentemente, as células-tronco mesenquimais (Mesenchymal Stem Cells - MSCs), demonstram grande valia em protocolos de reparação tecidual, por apresentar rápida expansão in vitro, podendo ser isoladas e manipuladas de modo reprodutível7. Almejando melhores tratamentos, as perspectivas de realizar enxertos autólogos de células-tronco derivadas do tecido adiposo (Adipose derived stem cell - ADSCs) torna-se uma estratégia promissora na Engenharia de Tecidos e na Cirurgia Plástica Reparadora. Estas células apresentam a vantagem de diferenciar-se em tecido epitelial, dentre estes a derme e epiderme8. Além da plasticidade das ADSCs, é notável a capacidade em aumentar significativamente o tecido de granulação e a epitelização, resultando na aceleração do fechamento de feridas9.
OBJETIVO
Em consequência aos desafios modernos no tratamento de pacientes que apresentam grandes áreas corporais queimadas, ou outros acidentes que envolvem a perda da pele, o objetivo deste trabalho é demonstrar por meio de forma investigativa e revisão bibliográfica narrativa pesquisas publicadas com células-tronco mesenquimais (MSCs), com ênfase em células-tronco derivadas do tecido adiposo (ADSCs). Será apresentada a associação de ADSCs a gel de plasma, gel de fibrina e membranas (scaffold) que tendem auxiliar o crescimento celular, visando sua possível aplicação na Cirurgia Plástica Reparadora para o tratamento e recuperação de pacientes que sofreram queimaduras ou outros acidentes que necessitam de enxerto de pele.
MÉTODOS
O presente trabalho abordou de forma exploratória e narrativa o tema células-tronco mesenquimais e células-tronco mesenquimais derivadas do tecido adiposo. O tipo de pesquisa empregada foi com a modalidade de coleta de informações, no qual utilizou-se a Biblioteca Virtual em saúde - BVS (http://www.bireme.br/php/index.php) e PubMed - NCBI (http://www.ncbi.nlm.nih.gov/pubmed).
Em adição, pesquisou-se artigos com as palavras-chave: Burn wound; Treatment burn wound; Adipose derived stem cells; Burn wound and cell therapy; Adipose stem cell and glue fibrina; Burn wound and adipose stem cell; Adipose stem cell and plasma gel; Adipose stem cell and scaffold and burn; Adipose stem cell and scaffold and glue fibrina; Adipose stem cell and scaffold and plasma gel. Foram selecionados os artigos mais atuais, no período de 2005 a 2015, que abordavam as palavras-chave citadas anteriormente.
RESULTADOS
A temática envolvendo feridas na pele e terapia celular tem crescido nos últimos anos. Tal afirmação pode ser corroborada pelo levantamento de revisão de publicações realizado nas bases de dados PubMed e Biblioteca Virtual em Saúde (BVS). Os números absolutos de publicações de 2005 até julho de 2015 encontrados nos dois sites relacionados à Burn wound são de 20.639 e para Treatment burn wound são 14.950 artigos. Já a quantidade de pesquisas relacionadas com Adipose derived stem cells são de 6.666 e Burn wound and cell therapy são de 1.376.
Os trabalhos que apresentaram-se escassos são os relacionados com: Adipose stem cell and glue fibrina; Burn wound and adipose stem cell; Adipose stem cell and plasma gel; Adipose stem cell and scaffold and burn; Adipose stem cell and scaffold and glue fibrina; Adipose stem cell and scaffold and plasma gel. A Figura 1 mostra a distribuição absoluta destes dados em números.
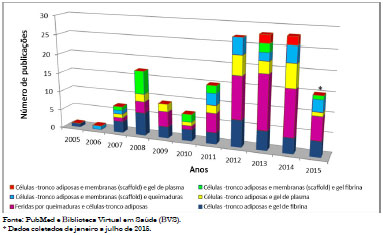
Figura 1. Distribuição anual absoluta dos termos que se apresentam escassos relacionados ao tratamento de feridas na pele e terapia celular (2005-2015).
DISCUSSÃO
Células-tronco mesenquimais (MSCs) e células-tronco derivadas do tecido adiposo (ADSCs)
Atualmente, as MSCs são isoladas e caracterizadas em diferentes tecidos do corpo, como medula óssea, cordão umbilical, encéfalo, epitélio, polpa de dente e tecido adiposo10. Além disso, MSCs apresentam marcadores de superfície que as caracterizam (Tabela 1) e são capazes de diferenciação em várias linhagens de células do tipo mesodérmico, contudo, recentemente observou-se que também podem diferenciar-se em outros tipos celulares não mesodérmicos11,12. Adicionalmente, estas apresentam grandes vantagens, levando-se em conta a facilidade de isolamento, sua capacidade de propagação em cultura, não serem imunogênicas, assim podendo ser empregadas em transplantes autólogos13.
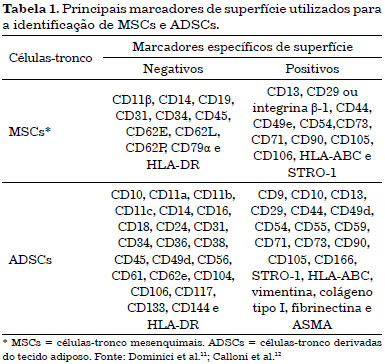
Dentre as células-tronco mesenquimais, as ADSCs despertam grande interesse na Cirurgia Plástica Reparadora, pois estão presentes em grande número, podem ser coletadas através de lipoaspiração, de modo que ofereça pequeno risco de morbidade e mortalidade ao doador9. A Figura 2 apresenta um esquema representativo da digestão, obtenção da fração vascular estromal (FVS), com perspectivas de tratamento de queimados e outros acidentes que envolvem a perda da pele. As ADSCs localizam-se em nicho na região perivascular, sendo composto pelos vasos sanguíneos em associação com células de tecido conjuntivo, adiposas, estromais, diversos progenitores e células-tronco (Figura 2)10. Através da lavagem extensiva e digestão enzimática obtemos a FVS que, além de conter células-tronco adultas, possui macrófagos, linfócitos, células endoteliais vasculares, dentre outras14.
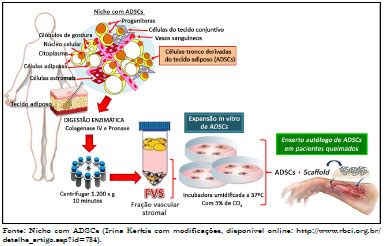
Figura 2. Esquema representativo do manejo experimental de células-tronco derivadas do tecido adiposo (ADSCs) associada à scaffold (membranas) com perspectiva de tratamento de queimados e outros acidentes que envolvem a perda da pele.
Outra característica importante das ADSCs é a aderência ao plástico e expansão em cultura. Deste modo, as células são isoladas através de cultura e posteriormente caracterizadas por seus marcadores específicos de superfície (Tabela 1)12. Em virtude de sua plasticidade, estas células quando induzidas adequadamente podem se diferenciar em múltiplas linhagens celulares, incluindo a derme e epiderme8,15. Sendo assim, a característica de multipotência das ADSCs contribui com novos tratamentos para diferentes patologias, principalmente em protocolos envolvendo terapia celular, que podem ser realizados com qualidade e reprodutibilidade.
Perspectivas de tratamento de queimados e outros acidentes que envolvem a perda da pele
Os principais objetivos no tratamento de feridas são o fechamento rápido, restauração da função e, também não menos importante, a satisfação estética. Com a perspectiva de buscar novas terapias para a correção de lesões, algumas pesquisas revelaram nos últimos anos que as ADSCs são uma fonte de célulastronco mesenquimais e que, quando utilizadas na enxertia, liberaram fatores que estimulam a angiogênese, acelerando o processo de cicatrização de feridas14,15.
Confirmando a capacidade de multipotência das ADSCs, Chavez-Munoz et al.16observaram que estas têm a capacidade de transdiferenciar-se em queratinócitos e epiderme estratificada. Além disso, o autor acrescenta que ADSCs podem ser úteis na terapia celular, pois estas oferecem uma cobertura epidérmica em casos de perda maciça de pele. Em continuidade, observou-se pela imunohistoquímica e Western blotting que ADSCs retiradas de modelos caninos quando introduzidas na região intradérmica nas bordas das feridas de ratos atímicos, juntamente com laserterapia de baixa intensidade, regeneram anexos da pele, estimulando a neovasculariazação, com consequente regeneração da pele histológica17.
Atualmente, evidencia-se que até mesmo as células-tronco retiradas do tecido subcutâneo debridado foram eficazes no tratamento in vivo em feridas de ratos atímicos, sugerindo que tais células podem ser utilizadas na reparação de feridas e terapias regenerativas da pele18. Outro aspecto relevante observado pela imunohistoquímica em estudos com transplante autólogo de ADSCs em ratos foi o aumento estatisticamente significativo da densidade dos vasos, colágeno e da secreção de fatores de crescimento de endotélio vascular (VEGF) e fator de crescimento transformante beta 3 (TGFb3). Tais fatores contribuem para o aumento da angiogênese, cicatrização de feridas e consequente aumento da sobrevivência e espessura total do enxerto de pele, mostrando-se um tratamento promissor para uso em cirurgias de reconstrução e reparação19.
Do mesmo modo, outras pesquisas demonstraram que as ADSCs, quando aplicadas em modelos murinos, colaboraram na regeneração da pele por ativarem as células-tronco do tecido epitelial e folicular, além disso, auxiliaram para reparar a inervação periférica20, 21. Em conjunto, resultados macroscópicos e histológicos em modelos murinos de ratos diabéticos, os quais apresentam grande dificuldade em cicatrização, revelaram que a aplicação de ADSCs na área com ferimento levou ao aumento significativo do tecido de granulação, epitelização e acelerou o fechamento da ferida8.
Wang et al.22, após isolarem ADSCs de modelos murinos e associar a membrana polipeptídica de poli-L-ácido glutâmico (PLGA) e quitosano (CS), observaram que o enxerto destas células teve proliferação em camadas (scaffold), reduzindo o tempo de fechamento da ferida. Lee et al.23 confirmaram através de ensaios de microtomografia computadorizada (micro-CT) que a incorporação de células-tronco isoladas do tecido adiposo a membranas polipeptídicas podem ser uma ferramenta útil e promissora para utilizar-se na engenharia de tecidos. Além destas, salienta-se que as membranas de celulose e elastina são biocompatíveis, citocompatíveis e adequadas para uso com células-tronco mesenquimais, visando seu uso imediatamente após isolamento24.
Recentemente, estudo controlado randomizado realizado em pacientes que se submeteram a grandes procedimentos cirúrgicos mostrou que a aplicação de ADSCs em feridas operatórias melhora o fechamento da ferida, atingindo níveis satisfatórios para a cicatrização da pele9. Além disso, a perda de tecido mole apresenta um desafio permanente para a Cirurgia Reconstrutiva, e a aplicação in vivo de ADSCs relacionadas com materiais biocompatíveis que servem como suporte para as células demonstraram resultados favoráveis em locais lesionados de ratos, sendo sugerida como uma possível nova terapia para o tratamento de feridas na pele25,26.
Gel de fibrina e plasma rico em plaquetas associados a células-tronco
O gel ou cola de fibrina (Figura 3) é constituído por dois componentes presentes no plasma, o fibrinogênio e a trombina, e na presença de cálcio ocorre sua polimerização para formar uma rede de fibrina27. A fibrina é uma malha que apresenta fatores de coagulação, proteínas adesivas que promove a adesão de células e interage com o meio estimulando a formação de colágeno e da MEC (matriz extracelular)28.
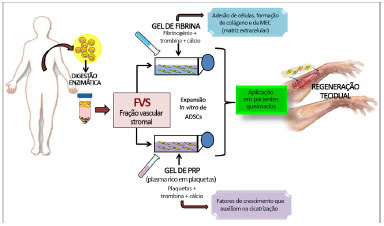
Figura 3. Esquema representativo do manejo experimental de células-tronco derivadas do tecido adiposo (ADSCs) associadas com gel de fibrina e gel de plasma rico em plaquetas (PRP) com perspectiva de tratamento de queimados e outros acidentes que envolvem a perda da pele.
Atualmente, existem preparações comerciais aprovadas para uso clínico como vedantes biológicos. Experimentalmente, vários estudos indicam que o gel de fibrina desempenha papel na homeostase, inflamação, cicatrização de feridas e regulação da angiogênese29. Além disso, muitos protocolos envolvendo a engenharia de tecidos propõem que o gel de fibrina pode ser utilizado como veículo e suporte para o enxerto de células-tronco, já que se trata de um gel que pode formar uma matriz tridimensional30.
Segundo Yang et al.31, a associação de células-tronco mesenquimais ao gel de fibrina pode induzir a formação de scaffold imitando a estrutura da pele e acelerar a cicatrização. Assim sendo, trata-se de uma estratégia promissora para enxerto como substituto da pele no tratamento de pacientes queimados. Recentemente, Taghiabadi et al.32 corroboraram com esta metodologia, acrescentando que o gel de fibrina associado à cultura de células de queratinócitos diminuiu a cicatriz hipertrófica de pacientes vítimas de queimaduras.
Em adição, a fibrina é um substrato natural que está prontamente disponível, encontra-se em abundância na cicatrização de feridas, e rapidamente é degradada pelo hospedeiro33. Além disso, a utilização de gel de fibrina pode aumentar a percentagem de aceitação do enxerto de pele, e evidências sugerem, também, melhoras na homeostasia e efeito protetor, resultando na redução de infecção bacteriana29,32.
Também em evidência e atualmente utilizado em protocolos na engenharia de tecidos, o gel de plasma (Figura 3), que é obtido pela centrifugação do sangue venoso autólogo, produz uma alta concentração de plaquetas em um pequeno volume de plasma, formando o plasma rico em plaquetas (PRP)34. Por sua vez, este trata-se de um hemocomponente, que adicionado de trombina e cálcio, resulta na ativação das plaquetas e início do processo de coagulação formando o gel de plaquetas. Este gel é rico em fatores de crescimento como o Fator de crescimento derivado de plaquetas (PDGF), fator de crescimento transformante alfa1 e beta1 (TGF-alfa1 e beta1), fator de crescimento endotelial (EGF), fator de crescimento de endotélio vascular (VEGF), prostaglandina E2 (PGE2) e fator de crescimento semelhante a insulina (IGF)35.
Com a atual procura de substratos e membranas que não sejam imunogênicas e que apresentem fatores apropriados para o crescimento celular, oferecendo melhor vascularização e cicatrização para os tecidos, o PRP mostra-se promissor como um veículo que possa atender as necessidades das células-tronco mesenquimais36,37. Ressalta-se, ainda, que o PRP apresenta fatores de crescimento recombinantes e, por ser de fonte autóloga, encontra-se livre de patógenos transmissíveis, tornando sua aplicação mais segura e eficaz para o paciente36.
Neste contexto, observou-se que os fatores de crescimento presentes no PRP não são mutagênicos e agem estimulando o processo de cicatrização de maneira eficaz, podendo ser utilizado isoladamente ou em combinação com células-tronco na regeneração tecidual38. Entre os estudos com células-tronco associados ao PRP, observou-se que as células-tronco expressam receptores que são ativados pelos fatores de crescimento presentes no PRP, com expressão positiva para genes da matriz extracelular, síntese de colágeno, proliferação celular, os quais atuam no processo de cicatrização39,40.
CONCLUSÃO
Embora atualmente tenhamos obtido avanços relacionados com procedimentos realizados em pacientes queimados e outros traumas que envolvam a perda da pele, torna-se notável a importância de buscar novas terapias que possam auxiliar na recuperação de pessoas que apresentam lesões cutâneas, com a finalidade de minimizar complicações de saúde, tempo e custos de tratamento, garantindo o retorno mais rápido possível do indivíduo às atividades normais.
Deste modo, o uso de ADSCs associadas a gel de fibrina ou gel de plasma em conjunto com membranas, que visam proporcionar o crescimento celular em scaffold, são estratégias promissoras como veículos que possam atender as necessidades das células-tronco. Nestas condições, mantém-se a homeostase dos tecidos ao repor células perdidas na maturação, envelhecimento ou dano, proporcionando um crescimento celular adequado com a intenção de reproduzir o mais fielmente possível a estrutura e função perdidas da pele original.
Por conseguinte, o enxerto autólogo de ADSCs associado a biocurativos torna-se uma perspectiva promissora na Cirurgia Plástica Reparadora para o tratamento e recuperação de pacientes que sofreram queimaduras ou outros acidentes que necessitam de enxerto de pele, uma vez que estes podem reduzir a dor e prevenir a dessecação da lesão, promovendo neovascularização e a reepitelização da ferida.
COLABORAÇÕES
CSCG Concepção e desenho do estudo; redação do manuscrito ou revisão crítica de seu conteúdo.
LCCG Redação do manuscrito ou revisão crítica de seu conteúdo.
JAPH Redação do manuscrito ou revisão crítica de seu conteúdo.
MRE Redação do manuscrito ou revisão crítica de seu conteúdo.
PMCG Aprovação final do manuscrito; redação do manuscrito ou revisão crítica de seu conteúdo.
AGRADECIMENTOS
Ao Instituto de Biotecnologia da Universidade de Caxias do Sul, Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - CAPES e Conselho Nacional de Desenvolvimento Científico e Tecnológico - CNPq.
REFERÊNCIAS
1. Tavares CS, Hora EC. Caracterização das vítimas de queimaduras em seguimento ambulatorial. Rev Bras Queimaduras. 2011;10(4):119-23.
2. WHO. World Health Organization. Media Centre. Fact sheet n. 365. 2012 [online]. [Acesso 2015 Mai 27]. Disponível em: http://www.who.int/mediacentre/factsheets/fs365/en/index.html
3. Rempel LCT, Tizzot MRPA, Vasco JFM. Incidência de infecções bacterianas em pacientes queimados sob tratamento em hospital universitário de Curitiba. Rev Bras Queimaduras. 2011;10(1):3-9.
4. Brasil. Ministério da Saúde. Secretaria de Atenção à Saúde Departamento de Atenção Especializada. Cartilha para tratamento de emergência das queimaduras [online]. 2012. [Acesso: 2015 Mai 23]. Disponível em: http://sbqueimaduras.org.br/wp/wp-content/uploads/2013/04/Cartilha_MS_2012.pdf
5. Suvarna K, Munira M. Wound Healing Process and Wound Care Dressing: A Detailed Review. J Pharm Res. 2013;2(11):6-12.
6. Schiozer W. Banco de pele no Brasil. Rev Bras Queimaduras. 2012;11(2):53-5.
7. Caplan AI. Why are MSCs therapeutic? New data: new insight. J Pathol. 2009;217(2):318-24.
8. Nie C, Yang D, Xu J, Si Z, Jin X, Zhang J. Locally administered adipose-derived stem cells accelerate wound healing through differentiation and vasculogenesis. Cell Transplant. 2011;20(2):205-16.
9. Martins PDE, Uebel CO, Machado DC, Da Silva JB. Uso de células-tronco adultas de tecido adiposo na cicatrização da pele: estudo controlado, randomizado. Rev Bras Cir Plást. 2009;26(3):394-401.
10. Yarak S, Okamoto OK. Células-tronco derivadas de tecido adiposo humano: desafios atuais e perspectivas clínicas. An Bras Dermatol 2010;85(5):647-56.
11. Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006;8(4):315-7.
12. Calloni R, Cordero EA, Henriques JA, Bonatto D. Reviewing and updating the major molecular markers for stem cells. Stem Cells Dev. 2013;22(9):1455-76.
13. Klinker MW, Wei CH. Mesenchymal stem cells in the treatment of inflammatory and autoimmune diseases in experimental animal models. World J Stem Cells. 2015;7(3):556-67.
14. Banyard DA, Salibian AA, Widgerow AD, Evans GR. Implications for human adipose-derived stem cells in plastic surgery. J Cell Mol Med. 2015;19(1):21-30.
15. Caruana G, Bertozzi N, Boschi E, Pio Grieco M, Grignaffini E, Raposio E. Role of adipose-derived stem cells in chronic cutaneous wound healing. Ann Ital Chir. 2015;86(1):1-4.
16. Chavez-Munoz C, Nguyen KT, Xu W, Hong SJ, Mustoe TA, Galiano RD. Transdifferentiation of adipose-derived stem cells into keratinocyte-like cells: engineering a stratified epidermis. PLoS One. 2013;8(12):e80587.
17. Kim H, Choi K, Kweon OK, Kim WH. Enhanced wound healing effect of canine adipose-derived mesenchymal stem cells with low-level laser therapy in athymic mice. J Dermatol Sci. 2012;68(3):149-56.
18. Natesan S, Zhang G, Baer DG, Walters TJ, Christy RJ, Suggs LJ. A bilayer construct controls adipose-derived stem cell differentiation into endothelial cells and pericytes without growth factor stimulation. Tissue Eng Part A. 2011;17(7-8):941-53.
19. Zografou A, Tsigris C, Papadopoulos O, Kavantzas N, Patsouris E, Donta I, et al. Improvement of skin-graft survival after autologous transplantation of adipose-derived stem cells in rats. J Plast Reconstr Aesthet Surg. 2011;64(12):1647-56.
20. Festa E, Fretz J, Berry R, Schmidt B, Rodeheffer M, Horowitz M, et al. Adipocyte lineage cells contribute to the skin stem cell niche to drive hair cycling. Cell. 2011;146(5):761-71.
21. Wu L, Cai X, Zhang S, Karperien M, Lin Y. Regeneration of articular cartilage by adipose tissue derived mesenchymal stem cells: perspectives from stem cell biology and molecular medicine. J Cell Physiol. 2013;228(5):938-44.
22. Wang W, Cao B, Cui L, Cai J, Yin J. Adipose tissue engineering with human adipose tissue-derived adult stem cells and a novel porous scaffold. J Biomed Mater Res B Appl Biomater. 2013;101(1):68-75.
23. Lee JW, Kim KJ, Kang KS, Chen S, Rhie JW, Cho DW. Development of a bone reconstruction technique using a solid free-form fabrication (SFF)-based drug releasing scaffold and adipose-derived stem cells. J Biomed Mater Res A. 2013;101(7):1865-75.
24. Alharbi Z, Almakadi S, Opländer C, Vogt M, Rennekampff HO, Pallua N. Intraoperative use of enriched collagen and elastin matrices with freshly isolated adipose-derived stem/stromal cells: a potential clinical approach for soft tissue reconstruction. BMC Surg. 2014;14:10.
25. de Paula AC, Zonari AA, Martins TM, Novikoff S, da Silva AR, Correlo VM, et al. Human serum is a suitable supplement for the osteogenic differentiation of human adipose-derived stem cells seeded on poly-3-hydroxibutyrate-co-3-hydroxyvalerate scaffolds. Tissue Eng Part A. 2013;19(1-2):277-89.
26. Chawla R, Tan A, Ahmed M, Crowley C, Moiemen NS, Cui Z, et al. A polyhedral oligomeric silsesquioxane-based bilayered dermal scaffold seeded with adipose tissue-derived stem cells: in vitro assessment of biomechanical properties. J Surg Res. 2014;188(2):361-72.
27. Laurens N, Koolwijk P, de Maat MP. Fibrin structure and wound healing. J Thromb Haemost. 2006;4(5):932-9.
28. Schmoekel HG, Weber FE, Schense JC, Grätz KW, Schawalder P, Hubbell JA. Bone repair with a form of BMP-2 engineered for incorporation into fibrin cell ingrowth matrices. Biotechnol Bioeng. 2005;89(3):253-62.
29. Cai M, Zhang J, Guan L, Zhao M. Novel implantable composite biomaterial by fibrin glue and amniotic membrane for ocular surface reconstruction. J Mater Sci Mater Med. 2015;26(3):149.
30. Bonilla Horcajo C, Otero L, Aguayo C, Rodriguez A, Zurita M, Vaquero J. Estudio de la utilidad del gel de fibrina como soporte celular en el trasplante intracerebral de células madre mesenquimales. Trauma. 2009;20(4):243-8.
31. Yang Y, Zhang W, Li Y, Fang G, Zhang K. Scalded skin of rat treated by using fibrin glue combined with allogeneic bone marrow mesenchymal stem cells. Ann Dermatol. 2014;26(3):289-95.
32. Taghiabadi E, Mohammadi P, Aghdami N, Falah N, Orouji Z, Nazari A, et al. Treatment of Hypertrophic Scar in Human with Autologous Transplantation of Cultured Keratinocytes and Fibroblasts along with Fibrin Glue. Cell J. 2015;17(1):49-58.
33. Tanikawa DY, Alonso N, Herson MR, Mathor MB, Caldini EG, Lourenço SV, et al. Ultrastructural evaluation of human keratinocyte growth and differentiation on a fibrin substrate. Acta Cir Bras. 2010;25(6):541-8.
34. Vendramin FS, Franco D, Franco TR. Método de obtenção do gel de plasma rico em plaquetas autólogo. Rev Bras Cir Plást. 2009;24(2):212-8.
35. Garcia RV, Gabrielli MA, Hochuli-Vieira E, Spolidorio LC, Filho JG, Neto FA, et al. Effect of platelet-rich plasma on peri-implant bone repair: a histologic study in dogs. J Oral Implantol. 2010;36(4):281-90.
36. Lacci KM, Dardik A. Platelet-rich plasma: support for its use in wound healing. Yale J Biol Med. 2010;83(1):1-9.
37. Formigli L, Benvenuti S, Mercatelli R, Quercioli F, Tani A, Mirabella C, et al. Dermal matrix scaffold engineered with adult mesenchymal stem cells and platelet-rich plasma as a potential tool for tissue repair and regeneration. J Tissue Eng Regen Med. 2012;6(2):125-34.
38. Chen WH, Liu HY, Lo WC, Wu SC, Chi CH, Chang HY, et al. Intervertebral disc regeneration in an ex vivo culture system using mesenchymal stem cells and platelet-rich plasma. Biomaterials. 2009;30(29):5523-33.
39. Mehrannia M, Vaezi M, Yousefshahi F, Rouhipour N. Platelet rich plasma for treatment of nonhealing diabetic foot ulcers: a case report. Can J Diabetes. 2014;38(1):5-8.
40. Picard F, Hersant B, Bosc R, Meningaud JP. Should we use platelet-rich plasma as an adjunct therapy to treat "acute wounds," "burns," and "laser therapies": A review and a proposal of a quality criteria checklist for further studies. Wound Repair Regen. 2015;23(2):163-70.
1. Instituto de Biotecnologia da Universidade de Caxias do Sul, Caxias do Sul, RS, Brasil
2. Sociedade Brasileira de Cirurgia Plástica, São Paulo, SP, Brasil
Instituição: Instituto de Biotecnologia da Universidade de Caxias do Sul, Caxias do Sul, RS, Brasil.
Autor correspondente:
Paulo Miguel Celi Garcia
Rua Francisco Getúlio Vargas, 1130
Caxias do Sul, RS, Brasil CEP 95070-560
E-mail: cirurplasticapgarcia@terra.com.br
Artigo submetido: 20/7/2015.
Artigo aceito: 10/4/2016.
Conflitos de interesse: não há.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter