

Original Article - Year 2021 - Volume 36 -
Avaliação da absorção de proteínas em ratas submetidas à colocação de mini-implantes de silicone nanotexturizados e revestidos pela espuma de poliuretano
Evaluation of protein adsorption in rats submitted to nanotextured and polyurethane foam-coated silicone mini-implants
RESUMO
Introdução: O controle da absorção de proteínas é necessário para a definição das propriedades dos biomateriais e de seus usos específicos. O plasma sanguíneo contém diversas proteínas diferentes, dentre elas o fibrinogênio, que apresenta importante papel na adesão celular e nos resultados de biocompatibilidade em implantes. Os objetivos deste estudo foram avaliar laboratorialmente as ratas submetidas à colocação de mini-implantes de silicone nanotexturizados e revestidos por espuma de poliuretano a partir da aferição do fibrinogênio sérico e mensuração da proteína plasmática.
Métodos: Foram utilizadas 60 ratas albinas, divididas em dois grupos de 30 animais para cada tipo de mini-implante de silicone (nanotexturizado e espuma de poliuretano) e subdivididas em 3 subgrupos, conforme o tempo de eutanásia dos animais (30, 60 e 90 dias). Os mini-implantes foram inseridos no dorso dos animais abaixo do Panniculus carnosus. No momento das eutanásias, amostras de sangue foram obtidas por punção cardíaca. Utilizou-se a técnica de precipitação térmica para determinação das proteínas plasmáticas total e sérica, e o valor do fibrinogênio foi obtido mediante a diferença entre estas duas últimas.
Resultados: Quando comparados os grupos entre si, observou-se que o grupo nanotexturizado apresentou uma maior quantidade de fibrinogênio e da proteína plasmática no subgrupo de 90 dias, com significância estatística (p=0,004). Ao comparar os subgrupos entre si, em ambos os grupos, evidenciou-se uma diferença significativa (p<0,001).
Conclusão: Os mini-implantes nanotexturizados mostraram uma menor absorção de proteínas em relação aos implantes revestidos pela espuma de poliuretano, no subgrupo de 90 dias.
Palavras-chave: Proteínas sanguíneas; Implantes experimentais; Implantes de mama; Mamoplastia; Ratos
ABSTRACT
Introduction: The control of protein absorption is necessary to define biomaterials' properties and their specific uses. Blood plasma contains several different proteins, including fibrinogen, which plays an important role in cell adhesion and biocompatibility results in implants. This study's objectives were to evaluate in the laboratory rats subjected to the placement of nano-textured silicone mini-implants and polyurethane foam-coated mini-implants based on the measurement of serum fibrinogen and plasma proteins.
Methods: Sixty albino rats were used, divided into two groups of 30 animals for each type of silicone mini-implant (nanotextured and polyurethane foam) and subdivided into three subgroups, according to the animals' euthanasia time (30, 60 and 90 days). The mini-implants were inserted in the animals' backs below the Panniculus carnosus. At the time of euthanasia, blood samples were obtained by cardiac puncture. The thermal precipitation technique was used to determine total and serum plasma proteins, and the difference between the latter two obtained the fibrinogen value.
Results: When the groups were compared, it was observed that the nanotextured group presented a higher amount of fibrinogen and plasma protein in the 90-day subgroup, with statistical significance (p=0.004). When comparing the subgroups among themselves, a significant difference was evidenced (p<0.001).
Conclusion: The nanotextured miniimplants showed a lower protein absorption concerning polyurethane foam-coated implants in the 90-day subgroup.
Keywords: Blood proteins; Experimental implants; Breast implants; Mammoplasty; Rats.
INTRODUÇÃO
O avanço das funções e da performance dos materiais é o maior objetivo da engenharia de superfícies, visando a produção de implantes que desencadeiem respostas biológicas cada vez mais controladas1. Quando um material aloplástico é colocado em contato com o organismo vivo, as proteínas presentes no sangue interagem com a superfície identificada como estranha. A absorção de proteínas, nestes biomateriais, é um dos pontos principais durante o desenvolvimento de tecnologias no campo dos biodispositivos2.
Isto porque, quando um material é implantado, a absorção de proteínas é um dos primeiros passos no processo biológico, bem como a cascata da coagulação, as quais desencadeiam as reações imunes e inflamatórias2,3. Portanto, o controle do fenômeno de absorção de proteínas é necessário para a definição das propriedades dos biomateriais e de seus usos específicos3.
O plasma sanguíneo contém várias proteínas diferentes, dentre elas o fibrinogênio, que é uma molécula de sinalização com amplo espectro de funções, que pode levar desde a um balanço entre a coagulação e a proteção contra infecções, até processos de fibrose e inflamação intensa4. Assim, o fibrinogênio demonstra ter um importante papel na adesão celular e, consequentemente, nos resultados de biocompatibilidade dos implantes3.
Durante a evolução dos implantes mamários, várias superfícies de revestimento foram propostas no intuito de minimizar as reações teciduais5, das quais os implantes nanotexturizados, por intermédio da nanotecnologia, provaram ser mais seguros em relação ao linfoma anaplásico de grandes células6 e a espuma de poliuretano se mostrou eficaz em reduzir a taxa de contratura capsular7.
O poliuretano segmentado é um elastômero termoplástico que tem sido extensivamente utilizado em procedimentos cirúrgicos, devido às suas excelentes propriedades físicas e mecânicas, termoplasticidade e biocompatibilidade8-10.
Atualmente, com o avanço da nanotecnologia, propuseram-se materiais com superfícies de tamanho cada vez menores e mais similares às estruturas biológicas, permitindo assim reações teciduais cada vez mais naturais entre o implante e os tecidos adjacentes, o que deve diminuir a intensidade da resposta inflamatória e influenciar na absorção de proteínas1,11.
OBJETIVOS
O presente estudo tem a finalidade de avaliar laboratorialmente as ratas submetidas à colocação de implantes de silicone nanotexturizados e revestidos por espuma de poliuretano, com os seguintes parâmetros:
MÉTODOS
A pesquisa foi realizada no biotério de cirurgia experimental da Universidade Estadual de Ponta Grossa (UEPG) após ser aprovada pela Comissão de Ética no Uso de Animais (CEUA), da UEPG. Processo CEUA - 041/2018. Protocolo UEPG: 16450/2018. Todos os procedimentos seguiram rigorosamente as regulamentações existentes para pesquisa com animais.
O delineamento do trabalho foi um estudo primário (ensaio clínico randomizado), intervencional, experimental em animais (ratas), prospectivo, analítico, controlado, aleatorizado, duplo-cego e unicêntrico.
Um total de 60 ratas albinas (Rattus norvegicus albinus, Roentia mammalia) com peso entre 190 a 250 gramas e 30 a 60 dias de vida, tiveram livre acesso à água e dieta específica para a espécie, com temperatura ambiente e ciclos circadianos de 12 horas.
Foram divididas aleatoriamente em dois grupos de 30 animais para cada tipo de mini-implante de silicone (nanotexturizado e espuma de poliuretano), e subdivididas em 3 subgrupos, conforme o tempo de eutanásia dos animais (30, 60 e 90 dias).
No grupo nanotexturizado, n=30, foram colocados mini-implantes com superfície nanotexturizada (Silimed®, Rio de Janeiro, Brasil), e no grupo poliuretano, n=30, foram colocados mini implantes com revestimento de espuma de poliuretano (Silimed®).
Os materiais implantados tinham as mesmas camadas de um implante de silicone mamário humano, formato discoide, com 22 +/- 1 milímetros (mm) de diâmetro e 9 +/- 1mm de altura nos mini-implantes com superfície nanotexturizada, e com 24 +/- 1 mm de diâmetro e 11 +/- 1mm de altura nos mini-implantes revestidos por espuma de poliuretano. A altura foi definida como o ponto de maior projeção do implante no eixo vertical (Figura 1).
Em relação aos poros na superfície dos mini-implantes, aqueles com superfície nanotexturizada possuíram as seguintes dimensões: diâmetro 0,3 a 8,7 micrômetros (300 a 8700 nanômetros); rugosidade média (Ra) 4,12 micrômetros (4120 nanômetros); e profundidade 3,08 a 10,74 micrômetros. Os mini-implantes revestidos pela espuma de poliuretano possuíram as dimensões a seguir: diâmetro 120 a 320 micrômetros; rugosidade média (Ra) 1500 micrômetros; e profundidade dos poros 480 a 1200 micrômetros.
Depois de realizada a distribuição por grupos as ratas foram retiradas aleatoriamente das gaiolas e anestesiadas por injeção intraperitoneal, composta de uma associação de cloridrato de quetamina 1% (Dopalen®, Hertape, Belo Horizonte, Brasil) na dose de 40mg/kg e cloridrato de xilazina 2% (Dopasen®, Hertape) na dose de 8mg/kg conforme o guia de anestesia e analgesia de animais de laboratório - UNIFESP/CEUA (2017)12.
A efetividade da anestesia foi avaliada pelas ausências de: movimentação; reflexo córneo-palpebral; e reação motora, após preensão com pinça do coxim adiposo de uma das patas traseiras, além de um bom padrão ventilatório.
Com as ratas posicionadas em decúbito ventral foi realizada a tricotomia na região dorsal, com posterior antissepsia e colocação de campo cirúrgico estéril.
A delimitação da incisão foi realizada tendo como referência uma linha horizontal subcostal, acompanhando o rebordo costal posteroinferior, que se encontrou com a linha sagital média. Com um cabo de bisturi nº 3, acoplado de uma lâmina nº 15, foi feita uma incisão horizontal, com extensão de 20mm na intersecção dessas linhas referenciais.
Foi confeccionada a loja para os mini-implantes em um plano retromuscular (abaixo do Panniculus carnosus) e, posteriormente, o mini-implante foi introduzido em direção vertical, sendo posicionado horizontalmente conforme o grupo (nanotexturizado ou poliuretano). A sutura da pele foi intradérmica com mononylon 5-0 (Ethicon®) com nós sepultados. Não houve retirada dos pontos no pós-operatório e a ferida operatória foi mantida exposta (Figura 2).
A analgesia pós-operatória foi com aplicação única, intramuscular, de dipirona sódica (20mg/kg) na região lateral do membro posterior. Não foram realizados curativos pós-operatórios nem a retirada de pontos.
A eutanásia ocorreu conforme os subgrupos de 30, 60 e 90 dias mediante a aplicação de quatro vezes a dose terapêutica de Dopalen® e Dopasen® e subsequente luxação cervical. Não houve morte, infecção do sítio cirúrgico nem extrusão dos implantes, portanto nenhuma rata foi excluída.
Metodologia de avaliação
As amostras de sangue foram obtidas no dia da eutanásia dos animais, de acordo com cada subgrupo, por punção intracardíaca realizada pelo médico veterinário (Vídeo 1), e foram colocadas em tubos sem e com anticoagulante ácido etilenodiamino tetra-acético (EDTA)13.
Utilizou-se a técnica de precipitação térmica em triplicata para cada animal, que consiste em preencher seis tubos capilares com sangue até 3/4 da capacidade, devidamente fechados em uma das extremidades. Após isso foram centrifugados a 8.0rpm em centrífuga de micro hematócrito, para separação do plasma durante 5 minutos. Depois de centrifugados, três dos capilares foram escolhidos aleatoriamente e quebrados para obtenção de uma gota, que foi posteriormente colocada no refratômetro de Goldberg para a mensuração da proteína plasmática total (PPT)13,14. Os três tubos capilares restantes foram levados ao banho-maria (temperatura de 56-58°C, durante três minutos) e após, novamente centrifugados, como descrito anteriormente, obtendo-se desta vez o soro, que foi mensurado no refratômetro, resultando na proteína sérica (PS)13.
O valor do fibrinogênio foi obtido mediante a diferença entre a proteína plasmática total e a proteína sérica. O resultado foi multiplicado por 1.000, pois o fibrinogênio é avaliado em mg.dL-¹13.
Avaliação estatística
Os resultados foram descritos por mediana, valores mínimo e máximo. Para a comparação dos grupos (nanotexturizado e poliuretano), em cada subgrupo (30, 60 e 90 dias), foi utilizado o teste não-paramétrico de Mann-Whitney. As comparações entre os subgrupos, para cada grupo, foram feitas utilizando-se o teste não- paramétrico de Kruskal-Wallis. Valores de p<0,05 indicaram significância estatística. Os dados foram analisados com o programa computacional Stata/SE v.14.1. StataCorpLP, USA.
RESULTADOS
Os grupos (nanotexturizado e poliuretano) foram comparados para as variáveis fibrinogênio e proteína plasmática nos subgrupos de 30, 60 e 90 dias.
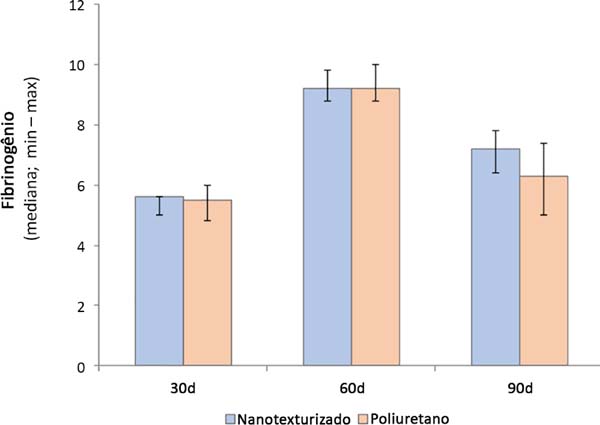
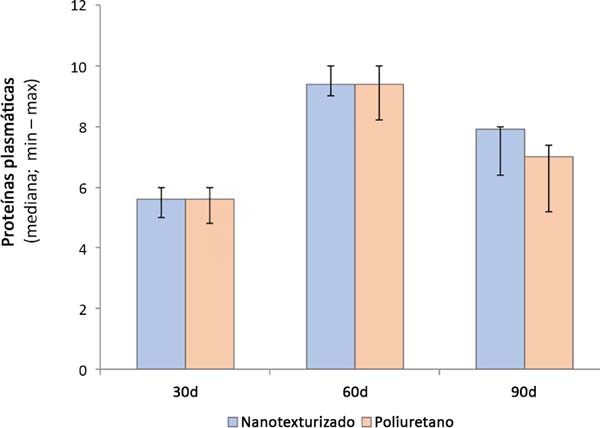
Quando comparados os grupos entre si, observou-se que o grupo nanotexturizado apresentou uma maior quantidade de fibrinogênio e de proteína plasmática no subgrupo de 90 dias, com significância estatística (p=0,004) (Tabelas 1 e 2 e Figuras 3 e 4).
| Subgrupos | Grupos | p* | |
|---|---|---|---|
| Nanotexturizado Mediana (mín-máx) | Poliuretano Mediana (mín-máx) | ||
| 30d | 5,6 (5-5,6) | 5,5 (4,8-6) | 0,962 |
| 60d | 9,2 (8,8-9,8) | 9,2 (8,8-10) | 0,673 |
| 90d | 7,2 (6,4-7,8) | 6,3 (5-7,4) | 0,004 |
| p** (30 x 60 x 90d) | <0,001*** | <0,001*** | |
| Subgrupos | Grupos | p* | |
|---|---|---|---|
| Nanotexturizado Mediana (mín-máx) | Poliuretano Mediana (mín-máx) | ||
| 30d | 5,6 (5 - 6) | 5,6 (4,8 - 6) | 0,813 |
| 60d | 9,4 (9 - 10) | 9,4 (8,2 - 10) | 0,393 |
| 90d | 7,9 (6,4 - 8) | 7 (5,2 - 7,4) | 0,002 |
| p** (30 x 60 x 90d) | <0,001*** | <0,001*** | |
Ao comparar os subgrupos entre si, em ambos os grupos, evidenciou-se uma diferença significativa (p<0,001) (Tabelas 1 e 2 e Figuras 3 e 4).
DISCUSSÃO
A reação de corpo estranho é a sequência inflamatória desencadeada pelo implante de biomateriais15, correspondendo à absorção de proteínas na superfície do implante, infiltração de células inflamatórias, fusão de macrófagos e células gigantes, ativação de fibroblastos e, finalmente, formação de uma cápsula fibrosa16.
A fase aguda da cicatrização está intimamente relacionada à ativação de macrófagos, os quais produzem uma variedade de fatores de crescimento (IGF-1, VEGF-α, TGF-b e Wnt) que são proteínas reguladoras da proliferação de células endoteliais e epiteliais, ativam miofibroblastos, e podem se diferenciar em células progenitoras e formação de neovasos. Os macrófagos, portanto, recuperam a homeostase do tecido ativando células anti-inflamatórias e regulando a deposição de colágeno e fibrina17.
Na vigência de inflamação é frequente a presença de fibrinogênio e fibrina. Assim como o macrófago, o fibrinogênio exerce seus efeitos dependendo do contexto em que se encontra, tanto na inflamação do tecido como em seu reparo, na cicatrização da ferida ou no desenvolvimento de fibrose18.
Desta maneira, os mecanismos que regulam estas diferentes ativações de macrófagos e fibrinogênio se tornaram áreas ativas de pesquisa18. Sabe-se hoje, que estas respostas variam segundo as características do material implantado, como sua dimensão, comportamento biológico, tamanho dos poros, topografia da superfície e técnicas de esterilização17.
A engenharia de biomateriais tem focado em criar implantes que simulem de maneira mais fidedigna os tecidos humanos, tanto fisicamente como quimicamente15. Com o crescimento anual do número de cirurgias de mamoplastia, a escolha pelo implante ideal ainda permanece um desafio, almejando resultados naturais e segurança nos procedimentos19.
Atualmente os implantes mamários podem ser classificados de acordo com o preenchimento (silicone ou solução salina), formato (redondo ou anatômico) e textura da superfície (liso, micro e macrotexturizado)20. A textura da superfície é determinada a partir da rugosidade do material: lisa (menor que 10µm), microtexturizada (10-50µm) e macrotexturizada (maior que 50µm)5.
O implante de silicone revestido por espuma de poliuretano é considerado um implante macrotexturizado. Tendo seu início em 1970, seu uso foi motivado por uma suposta redução na contratura capsular21. A espuma de poliuretano forma uma massa espumosa in situ contendo poros, essa porosidade permite o crescimento celular adentro levando à incorporação do revestimento do implante ao tecido adjacente. Após a formação da cápsula ao redor do implante, o revestimento de poliuretano se degrada e funde-se com a cápsula22.
Mais recentemente, com o advento da nanotecnologia tornou-se realidade uma maior mimetização dos tecidos23, sendo possível construir superfícies com nano protrusões específicas, a depender da necessidade, tanto para promoção como para impedimento da absorção de proteínas2.
As superfícies nanotexturizadas demonstraram a capacidade de controlar mais eficientemente as interações entre o tecido receptor e a superfície do implante, diminuindo a reação de corpo estranho, inflamação e formação de tecido cicatricial, além de um maior controle de colonização por patógenos24.
CONCLUSÃO
Os implantes nanotexturizados evidenciaram uma menor absorção de proteínas em relação aos implantes revestidos pela espuma de poliuretano, no subgrupo de 90 dias.
REFERÊNCIAS
1. Psarra E, Konig U, Ueda Y, Bellmann C, Janke A, Bittrich E, et al. Nanostructured biointerfaces: nanoarchitectonics of thermoresponsive polymer brushes impact protein adsorption and cell adhesion. ACS Appl Mater Interfaces. 2015 Jun;7(23):12516-29.
2. Garcia LEG, MacGregor-Ramiasa M, Visalakshan RM, Vasilev K. Protein interactions with nanoengineered polyoxazoline surfaces generated via plasma deposition. Langmuir. 2017 Jun;33(29):7322-31.
3. Kopf BS, Ruch S, Berner S, Spencer ND, Maniura-Weber K. The role of nanostructures and hydrophilicity in osseointegration: invitro proteinadsorption and bloodinteraction studies. J Biomed Mater Res A. 2015 Ago;103(8):2661-72.
4. Davalos D, Akassoglou K. Fibrinogen as a key regulator of inflammation in disease. Sem Immunopathol. 2012 Jan;34(1):43-62.
5. International Organization for Standardization (ISO). ISO 14607:2018: non-active surgical implants: mammary implants - particular requirements. Geneva: ISO; 2018. 48 p.
6. Collett DJ, Rakhorst H, Lennox P, Magnusson M, Cooter R, Deva AK. Current risk estimate of breast implant-associated anaplastic large cell lymphoma in textured breast implants. Plast Reconstr Surg. 2019 Mar;143(3S):30S-40S.
7. Barnsley GP, Sigurdson LJ, Barnsley SE. Textured surface breast implants in the prevention of capsular contracture among breast augmentation patients: a meta-analysis of randomized controlled trials. Plast Reconstr Surg. 2006 Jun;117(7):2182-90.
8. Stefanovic I, Djonlagic J, Tovilovic G, Nestrov J, Antic VV, Ostojic S, et al. Poly(urethanedimethylsiloxane) copolymers displaying a range of soft segment contents, noncytotoxic chemistry, and nonadherent properties toward endothelial cells. J Biomed Mater Res A. 2015 Abr;103(4):1459-75.
9. Silva EN, Ribas-Filho JM, Czeczko NG, Pachnicki JPA, Montemor Netto MR, Lipinski LC, et al. Histological evaluation of capsules formed by silicone implants coated with polyurethane foam and with a textured surface in rats. Acta Cir Bras. 2016 Dez;31(12):774-82.
10. Silva EN, Ribas-Filho JM, Tabushi FI, Silva MAP, Siqueira EBD, Noronha L, et al. Smooth muscle alpha actin immunoexpression (alfa-Sma) and CD-117 antibody (C-Kit) in capsules formed by polyurethane foam-coated silicone implants and with textured surface: a study on rats. Aesthetic Plast Surg. 2019 Fev;43(1):233-42.
11. Kang SH, Sutthiwanjampa C, Heo CY, Kim WS, Lee SH, Park H. Current approaches including novel nano/microtechniques to reduce silicone implant-induced contracture with adverse immune responses. Int J Mol Sci. 2018 Abr;19(4):1171.
12. Universidade Federal de São Paulo (UNIFESP). Comissão de Ética no Uso de Animais (CEUA). Guia de anestesia e analgesia de animais de laboratório. São Paulo (SP): UNIFESP/CEUA; 2017.
13. Tomaszewska E, Dobrowolski P, Kwiecien M. Intestinal alterations, basal hematology, and biochemical parameters in adolescent rats fed different sources of dietary copper. Biol Trace Elem Res. 2016 Mai;171(1):185-91.
14. Souza MV, Souza PC, Rodrigues BL, Júnior JIR, Cordeiro RR. Concentração do fibrinogênio no plasma sanguíneo de equinos da raça mangalarga marchador por diferentes métodos. Ceres. 2006;53(307):382-6.
15. Major MR, Wong VW, Nelson ER, Longaker MT, Gutner GC. The foreign body response: at the interface of surgery and bioengineering. Plast Reconstr Surg. 2015 Mai;135(5):1489-98.
16. Kastellorizios M, Tipnis N, Burgess DJ. Foreign body reaction to subcutaneous implants. Adv Exp Med Biol. 2005;865:93-108.
17. Boersema GSA, Grotenhuis G, Bayon Y, Lange JF, Bastiaansen-Jenniskens YM. The effect of biomaterials used for tissue regeneration purposes on polarization of macrophages. Biores Open Access. 2016;5(1):6-14.
18. Vanella KM, Wynn TA. Mechanisms of organ injury and repair by macrophages. Ann Rev Physiol. 2017 Fev;79:593-617.
19. Kaoutzanis C, Winocour J, Unger J, Gabriel A, Maxwell GP. The evolution of breast implants. Semin Plast Surg. 2014 Nov;134(1S):217-23.
20. Headon H, Kasem A, Mokbel K. Capsular contracture after breast augmentation: an update for clinical practice. Arch Plast Surg. 2015 Set;42(5):532-43.
21. Duxbury PJ, Harvey JR. Systematic review of the effectiveness of polyurethane-coated compared with textured silicone implants in breast surgery. J Plast Reconstr Aesthet Surg. 2016 Abr;69(4):452-60.
22. Laube T, Weisser J, Berger S, Borner S, Bischoff S, Schubert H, et al. In situ foamable, degradable polyurethane as biomaterial for soft tissue repair. Mater Sci Eng C. 2017 Set;78:163-74.
23. Barr S, Hill EW, Bayat A. Development, fabrication and evaluation of a novel biomimetic human breast tissue derived breast implant surface. Acta Biomater. 2016 Dez;49:260-71.
24. Prasad K, Zhou R, Zhou R, Schuessler D, Ostrikov KK, Bazaka K. Cosmetic reconstruction in breast cancer patients: opportunities for nanocomposite materials. Acta Biomater. 2019;86:41-65.
1. Universidade Estadual de Ponta Grossa, Ponta Grossa, PR, Brasil.
2. Universidade Federal de São Paulo, Programa de Pós-Graduação em Cirurgia Translacional,
São Paulo, SP, Brasil.
3. Universidade Estadual do Rio de Janeiro, Programa de Pós-Graduação em Fisiopatologia
e Ciências Cirúrgicas, Rio de Janeiro, RJ, Brasil.
ENS Análise e/ou interpretação dos dados, Análise estatística, Aprovação final do manuscrito, Coleta de Dados, Conceitualização, Concepção e desenho do estudo, Gerenciamento de Recursos, Gerenciamento do Projeto, Investigação, Metodologia, Redação - Preparação do original, Redação - Revisão e Edição, Software, Validação, Visualização
GHP Aquisição de financiamento, Gerenciamento de Recursos, Realização das operações e/ou experimentos
BZL Realização das operações e/ou experimentos, Redação - Preparação do original
Autor correspondente: Eduardo Nascimento Silva, Avenida Doutor Francisco Burzio, 991, Centro, Ponta Grossa, PR, Brasil. CEP: 84010-200. E-mail: dr_eduardosilva@yahoo.com.br
Artigo submetido: 01/12/2020.
Artigo aceito: 10/01/2021.
Conflitos de interesse: não há.










 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter